|
|
|||||||||||||||||||||||||||||||||||||||||||||||||
| FONAIAP DIVULGA > Colección > Número 05 Julio-Agosto 1982 | |||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
FONAIAP DIVULGA No. 05 Julio-Agosto 1982 |
|||||||||||||||||||||||||||||||||||||||||||||||||
Ing. Oscar Haddad, Alfonso
Ordosgoitti y Jesús Díaz |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||
El costo para su control es 4 veces superior al de la "Sigatoka amarilla o común". Se requieren de 33 a 36, o más, aplicaciones de funguicidas por año para lograr un control efectivo, por el contrario para "Sigatoka amarilla o común" se necesitan solamente de 10 a 16 aplicaciones anuales. INTRODUCCIÓN: En el curso se trataron tópicos relacionados con la distribución de la enfermedad en América, así como la sintomatología, característica del hongo causante de la misma y se discutieron alternativas de control y recomendaciones del mismo. Este trabajo tiene como finalidad transmitir estos conocimientos a las personas e instituciones interesadas en conocer aspectos sobresalientes sobre la enfermedad Sigatoka negra de los cambures y plátanos.
SIGATOKA NEGRA: Esta enfermedad todavía no ha sido detectada en Venezuela. Sin embargo, debemos estar muy alertas y tomar estrictas medidas de cuarentena, así como desplegar una campaña de concientización a través de un Programa de Entrenamiento al personal técnico de Sanidad Vegetal, con énfasis al personal de frontera y agricultores progresistas de la región del Táchira, Mérida y Zulia, en vista de que esta peligrosa enfermedad se encuentra en Colombia. De acuerdo a las opiniones recogidas, el hombre es el agente responsable en alto grado de la introducción y dispersión de este hongo en la América. En tal sentido pueden considerarse como elementos diseminantes en los que interviene el hombre los siguientes:
Sintomatología:
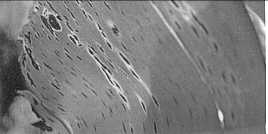
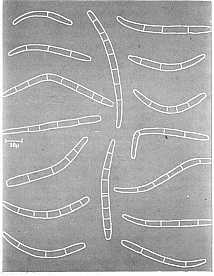
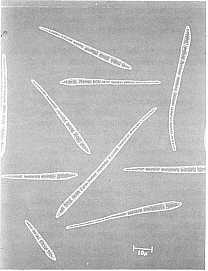
Las estrías se alargan y cambian de
color café rojizo a café oscuro o casi negro, haciéndose claramente
visible en el haz de la hoja. Esto constituye el segundo estado de
estrías. Las mismas se hacen más anchas, de forma algo elíptica, a
veces rodeada de un halo acuoso. Este es el estado de manchas. Algunas
veces se presenta un ligero amarillento del tejido alrededor de la
lesión (Fig. 2) pero normalmente esto no es frecuente, como si ocurre
en sigatoka amarilla y las lesiones entonces coalescen formando en
gran parte mancha negra sin mostrar zonas amarillentas a su alrededor.
El centro de la lesión se seca, se vuelve ligeramente gris y presenta
una depresión. La lesión es rodeada por un angosto borde negro bien
definido. Si se presenta gran densidad de lesiones, estos coalescen, la
hoja se torna negra y muere en 3-4 semanas apenas después de aparecer
los primeros síntomas. MEDIDAS DE CONTROL:
La dispersión del patógeno sucede en 3 formas: a) Camiones que transportan cambures y plátanos en los que se usan hojas infestadas, para evitar magulladuras y quemaduras del sol en la fruta. b) Material de siembra como son hijos o cormos, sin ningún trata. miento preventivo, llevados a áreas no infestadas. c) Dispersión de ascosporas por el viento. Según Stover (15) la dispersión es ineficiente si la distancia entre áreas infestadas y áreas no infestadas es mayor de 50 Km. Las medidas cuarentenarias han sido orientadas a demorar el avance de la enfermedad, llevada por el hombre, a través de las barreras naturales como son: las montañas, mares, selvas u otros cultivos no hospederos, que se. paran a las plantaciones de cambures y plátanos no infestadas, de los focos de infección. Esas medidas han sido difíciles de hacer cumplir, debido a que el hombre usa rutas evasivas porque tanto el cambur como el plátano, son productos de primera importancia en la dieta. Debe tenerse presente que al descubrirse un brote de la enfermedad en áreas nuevas, ya el patógeno tiene uno o dos años de establecido (15). La dispersión durante este período inicial, no siempre es posible detectarla, por lo cual la enfermedad abarca grandes extensiones, haciendo difícil el éxito de un programa de erradicación. El avance de la enfermedad, nos de. muestra que las medidas cuarentenarias para frenar la dispersión, no han sido del todo eficientes. 2. Uso de Productos Químicos
El control químico se ha hecho en la mayoría de países donde está presente esta enfermedad con benzimidazoles (Benlate, Topsin o Cycossin, excepto en parte de Honduras en los últimos dos años), y bisditiocarbamatos (Dithane M-45, Manzate 200), en emulsión de aceite yagua en volúmenes de 19 a 36 litros por hectárea, aplicados cada 10 a 15 días. Estos productos se han usado en mezcla o por separado, alternándolos entre un ciclo y otro o realizando 2 a 3 ciclos de Mancozeb (2,3,4, 7,8,16) Las dosis de estos productos van desde 200-280 gramos de Benlate O.D., por hectárea, 2, a 3 kg. de Mancozeb por hectárea y aceite de 5 a 7 .5 litros por hectárea. A raíz de la aparición en Honduras, de tolerancias del patógeno al Benlate desde 50 a 300 ppm en algunas plantaciones, después de un afiode aplicaciones continuas de solo Benlate (13,14), se hizo apremiante el uso de nuevos fungicidas y mezclas de éstos que fueran eficaces para así obviar el problema de las tolerancias a estos fungicidas (1). En la actualidad se cuenta con varias alternativas como son: Bravo 500 (Clorotalonil), Calixin, Imazalil, etc. -El Bravo 500 se usa en Honduras, Guatemala y Costa Rica, llegando a sustituir en gran parte al Benlate. Sin embargo, su uso ocasiona un incremento de los costos, por las dosis elevadas, frecuencias de ciclos y costos del producto. Este fungicida se usa a razón de 3,25 a 3.5 litros por hectárea, aplicados cada 8 a 10 días en agua solamente (sin aceite), en volúmenes de 19 a 23 litros por hectárea (2,3) Para evitar el aumento de tolerancia, unida a razones económicas, existe. el esquema de usar productos benzimidazoles -bisdithiocarbamatos en una etapa de aspersión, luego una etapa aplicando Clhorotalonil. Existen otros esquemas en etapa de experimentación, los cuales son muy prometedores. El uso de productos sistemáticos, conlleva a la necesidad de una revisión sistemática de la tolerancia al producto, existiendo una metodología desarrollada para tal caso.
En Venezuela, existe Daconil que es un polvo.
Bravo 500, es una solución emulsificante. Ambos tienen el mismo
ingrediente activo. Nota: Bravo 500, no debe mezclarse con aceite por efectos fitotóxicos, ya se ha mencionado. 3. Comportamiento varietal: En la actualidad, el Departamento de Investigaciones Agrícolas Tropicales de United Brand Company, lleva a cabo un interesante programa sobre mejoramiento genético de musáceas a fin de conseguir resistentes. Todas las variedades comerciales de bananos y plátanos son susceptibles a la enfermedad, "aun las resistentes o tolerantes a Sigatoka amarilla. El "guineo cuadrado" y el "pelipita" son tolerantes (grupo ABB) (2,3). La mayoría de los híbridos tetraploides tienen diferentes niveles de resistencia, pero el mayor grado de resistencia lo presentan los diploides silvestres Musa acuminata sub-especie burmannica y la sub-especie malaccensis. Este alto nivel de resistencia ya se ha incorporado a los diploides machos para producir mediante fitomejoramiento nuevas variedades de bananos. Estos mismos diploides pueden usarse en cruces para producir plátanos AAB que sean resistentes (6,15,16). RECOMENDACIONES: Las recomendaciones que aquí exponemos, fueron aprobadas durante la Reunión Técnica Internacional, efectuada en San José, Costa Rica en Enero de 1980, titulada "Recomendaciones para un Plan de Acción Conjunta para Control de Sigatoka negra. 1. En países donde NO se ha detectado la enfermedad: 1.1. Efectuar reconocimientos para detectar la presencia de la Sigatoka negra en áreas cultivadas de banano, plátano y otras especies del genero Musa. Que cada país, a través del Departamento de Sanidad Vegetal de su Ministerio de Agricultura, diseñe su propio sistema de muestreo de acuerdo a las circunstancias imperantes en el cultivo del banano y del plátano ya las experiencias de sus propios agricultores. 1.2. Establecer y reforzar las medidas de cuarentena para prevenir y retardar la introducción de la enfermedad, tanto en las fronteras como en las carreteras y caminos internos del país, a través de legislaciones adecuadas para mantener cuarentenas eficientes, fortaleciendo y aprovechando los programas. de divulgación y cooperación entre los países. Las cuarentenas en referencia, deben ser hechas por medio de baños de agua o cualquier otro producto o líquido similar que la sustituya, cuando se cuente con la existencia de ésta. Se instituirá en las fronteras entre países la presentación de constancias de que la procedencia del producto es de una zona no afectada por la Sigatoka negra, -o en su defecto- un certificado fitosanitario del Ministerio de Agricultura. 1.3. Promover la adopción de buenas prácticas culturales que provean condiciones adversas al patógeno que reduzcan el riesgo de ataque o severidad del daño que pueda ocasionar la enfermedad en los cultivos de banano y otras musáceas de valor económico. 2. En países donde. SI se ha detectado la enfermedad: 2.1. Efectuar reconocimientos continuos en áreas cultivadas de banano y plátano, libres de la enfermedad, con el propósito de detectarla. 2.2. Adoptar medidas estrictas de cuarentena interna, para prevenir y retardar la diseminación de la enfermedad a zonas libres de ellas. Debe prohibirse en forma total el traslado de material vegetal de musáceas, aparte de la fruta y del material de propagación debidamente tratado y certificado, de áreas infectadas hacia áreas libres de la enfermedad. 2.3. Establecer métodos eficaces y económicos para eliminar los focos y fuentes de inóculos del patógeno causante de la enfermedad. 2.4. Establecer programas adecuados de control químico preventivo de la enfermedad, en plantaciones de banano y plátano y otras musáceas cercanas a los focos de infección. 2.5 Promover investigaciones tendientes a encontrar métodos más económicos de control de la enfermedad, en comparación con los que se utilizan actualmente, deben investigarse los métodos de control que puedan ser convenientemente usados por pequeños productores de banano y plátano, que no tienen acceso a la tecnología desarrollada para grandes plantaciones. 2.6 Recomendar a las instituciones encargadas de la política bananera de cada país, que en coordinación con el Ministerio de Agricultura y otras entidades regionales e internacionales, realicen investigaciones en el área de epidemiología, que permitan predecir el comportamiento de la enfermedad y así lograr una utilización más racional y eficiente del control químico. En el campo del control químico, se deben estudiar otros productos teniendo especial cuidado de evitar el desarrollo de variantes o razas tolerantes del hongo a un determinado fungicida. 2.7. Promover la adopción de buenas prácticas culturales en todos los cultivos de banano y plátano, tales como: fertilización adecuada, deshije apropiado, control efectivo de malezas y mejoramiento de drenajes, asociadas a un estricto sistema de sanidad vegetal, dándole especial importancia a la labor de deshoja cuando la intensidad de la infección lo amerite. 3. Consideraciones generales: 3.1. Que la UPEB, gestione ante las instituciones responsables de los programas de mejoramiento genético del banano y plátano existentes en Jamaica, Honduras y el CATIE la evaluación del comportamiento del material genético producido en cuanto a posible resistencia a la Sigatoka negra, en la: áreas donde existe esa enfermedad. Buscar mecanismos que pro muevan una participación más activa de los países miembros, el estos programas de mejoramiento genético. 3.2. Que los países productores de banano y plátano coordinen esfuerzos para la adquisición de productos químicos para el control de la enfermedad, en volúmenes que, permitan obtener precios más favorables. 3.3. Apoyar con especial énfasis la medidas destinadas a proteger la siembras de plátano en todos lo países productores de banano, plátano. La importancia de este cultivo, su susceptibilidad al ataque de la Sigatoka negra, el tamaño de sus explotaciones y el tipo de agricultor involucrado, cuyos recursos limitados no permiten hacerle frente a la enfermedad, de una manera eficaz, requiere que se brinde una decidida ayuda para evitar y combatir esa dañina enfermedad. 3.4. Recomendar a las instituciones nacionales e internacionales que promuevan una agricultura diversificada e investiguen sobre cultivos asociados con el plátano, nivel de pequeños agricultores. 1. FOURCADE.J. y LA VILLE,E. Obtention in vitro de souches resistentes au Benomyl chez le Cercospora musae Zimm.Fruits 28: 103 -105. 1973 2. GONZÁLEZ ,W. Enfermedades del follaje en el banano. Dpto. de Investigación de BANDECO, S.A. 9 págs. 1980 (Mimeografiado). 3. GONZÁLEZ P.M. 1979. Enfermedad de la Sigatoka negra (Mycosphaerella fjjiensis Morelet var. difformis Mulder y Stov.r). Departamento de Investigaciones de BANDACO 11 p. 4. MEREDITH, D.S. Banana leaf sport disease (sigatoka) caused by Mycosphaerella musicola Leach. Conmonwealt Mycological Institute Kew, Surrey, England. 147 p. 1970. 5. MEREDITH. D.S. y LA WRENCE. J.S. Black leaf steak disease of bananas (Mycosphaerella fjjiensis) symptoms of disease in Hawaii, and notes on the conidial state of the caused fungus. Trans. Br .Mycol. Soc. 52: 459 -476.1969. 6. MULDER. J.L.. y STOVER. R.H. Mycosphaerella species causing bananas leaf sport. Transections of the British Mucologycal Society. 69 ( 1) : 77-82. 1976. 7. PHILIPPINE PACKING CORPORATION. Reserach Department. Banana Diseases. Pest. control manual. 1976. 133 p. 8. STOVER. R.H. Banana leaf sport caused by Mycosphaerella musicola: contrasting features of sigatoka and black leaf streak control. Plant.Disease Reporter: 55 (5) : 437-439. 1971. 9. STOVER R.H. Banana Plantain, sand Abaca Diseases. Comomnwealh Mycological Institute. Kew. Surrey. England 136p.19. 10. STOVER R,H, Pathogeníc and morphologic variation in M cosphaerella fijiensis (M. musicola), Proceddings of the American Phytopathological Society. 1: 123. 1974. 11. STOVER R.H. Distribution and cultural characteristists of pathogens causing banana leaf spot. Tropical Agriculture, (2): 11 -113,1976, 12. STOVER R.H. y DlCKSON, J,D. Banana Ieaf spot caused Mycosphaerella musicola and Mycosphaerella fijiensis Var. difformis. A comparison of the first Central American Epidemics.F.A.O, Plant Protection Bul1etin, 24 (2): 36-32. 19, 13. STOVER. R.H. Behaviour of Benomyl tolerant strains of the black sigatoka pathogen in the field. Annual Proceedings of the American Phytopathological Soc. 1977 14. STOVER. R,H. Extranuclear inherited tolerance to Benomyl in Mycosphaerella fijiensis var. difformis. Transactions of the British Mycological Soc. 68 (1): 122-124.1977. 15. STOVER, R.H, Sigatoka leaf spot of banana and planta Proceedings of the Sigatoka Workshop. La Lima. Honduras 99p, 1980,
16. UNIÓN DE PAÍSES EXPORTADORES DE BANANO Sigatoka negra. Memoria
de la Reunión Técnica Internacional (San José .Costa Rica) 44p. 1980. |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||