|
|
||||||
| FONAIAP DIVULGA > Colección > Número 59 Enero-Junio 1998 | ||||||
|
|
||||||
|
FONAIAP DIVULGA No. 59 Enero-Junio 1998 |
||||||
|
||||||
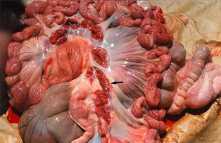
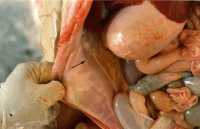
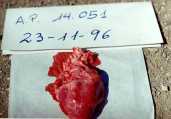
La Encefalo-miocarditis (EMC) es una enfermedad que se presenta en cerdos, causada por un virus del genero cardiovirus y perteneciente a la familia Picormaviridae. Produce una serie de síntomas y lesiones en los animales afectados incluyendo la muerte súbita, especialmente en animales en desarrollo. Las lesiones macro y microcópicas son extremadamente útiles para el diagnóstico. Las muestras ideales para el diagnóstico son el corazón, el hígado, el bazo, los pulmones, los glanglios linfáticos y el encéfalo. Por ser ésta una enfermedad viral no existe tratamiento específico eficaz; sin embargo puede disminuirse la mortalidad, evitando situación de excitación o de estrés en los animales. Introducción La encefalomiocarditis (EMC) es una enfermedad que se presenta en los cerdos, causada por un virus del género cardiovirus y perteneciente a la familia Picornaviridae. Ha sido diagnostica en diversos países de América y Europa, pudiendo afectar diferentes especies animales, tanto silvestres como domésticos e incluso al hombre. El virus ha sido aislado de cerdos, bovinos, primates, elefantes, leones, caprinos, ovinos, caninos, ratas, puercoespines y macerado de insectos. Por otra parte, se han detectado anticuerpos contra el virus en suero de humanos. Esta enfermedad produce una serie de síntomas y lesiones en los animales afectados. En rebaños porcinos con alta susceptibilidad se registran altos índices de mortalidad, presentándose muerte súbita en cerdos de todas las edades, siendo más afectados durante la etapa de desarrollo. Epidemiología Se considera que las ratas actúan como reservorio natural del virus, el cual se mantiene en el intestino de los mismos. El mecanismo por el cual se transfiere el virus de este reservorio al cerdo no está claro, se considera que la contaminación del alimento y del agua con virus excretado del reservorio, probablemente a través de la orina y heces, debe jugar un papel importante. La enfermedad es fatal en animales menores de 20 semanas de edad, pudiendo llegar a 100 % de mortalidad. En la mayoría de los animales adultos la enfermedad cursa de manera subclínica. El virus es ubicuo en roedores, así que la distribución de la enfermedad en cerdos puede depender de la distribución de las cepas virales en el huésped que actúa como reservorio. Clínica Los signos clínicos son escasos, pudiendo aparecer fiebre, depresión, inapetencia, temblores, vómitos o disnea. Lo más frecuente en los animales es la muerte súbita. En hembras se ha descrito fracaso productivo. Experimentalmente, después de un período de incubación de dos a cuatro días aparece fiebre alta (41 ° C) durante 24 horas, ocurriendo la muerte de los animales a consecuencia de algún evento que produzca estrés o excitación. Patogénesis Después de la exposición oral, la viremia ocurre entre los días dos y cinco de postinfección, manteniéndose durante dos a cuatro días. Los órganos con mayor concentración viral son: el bazo, ganglios linfáticos, cerebro y en especial, el corazón. La muerte en la fase de infección experimental ocurre entre los días dos y 11 de postexposición. Si la puerta de entrada del virus es la oral, el virus toma rápidamente la vía sanguínea, ocurriendo la multiplicacion viral en una variedad de tejidos y con mayor importancia, en los tejidos linfáticos. Lesiones Pueden presentarse manchas de color púrpura en la piel. Al examinar las cavidades orgánicas podemos observar fibrina en la región pleural, peritoneal y en el saco pericárdico. Se observa hepatomegalia, edema mesentérico, ascitis y edema pulmonar. En el miocardio ventricular, especialmente en el lado derecho, pueden encontrarse múltiples áreas de color blanco con un diámetro de 2 a 15 mm, que se corresponden con un proceso degenerativo del músculo cardíaco. Puede observarse también un proceso congestivo en el bazo y en el riñón. Los ganglios linfáticos se encuentran en su mayoría aumentados de volumen y congestionados. Microscópicamente se observan áreas de degenaración y necrosis del miocardio y un infiltrado inflamatorio de linfocitos y macrófagos. La mineralizacion del músculo cardíaco es frecuente, observándose en la región central de la necrosis calcificación distrófica, que se evidencia con coloraciones especiales como la de Von Kossa. En los cerdos que sobreviven, el músculo afectado es reemplazado por tejido fibroso. Las áreas más comúnmente afectadas del corazón son el ventrículo derecho cerca de la arteria pulmonar, seguido por el septum interventricular y músculos papilares. Es poco frecuente la presencia de meningoencefalitis no purulenta, con manguitos perivasculares. En el pulmón puede observarse congestión y edema, con presencia de linfocitos, células plasmáticas e histiocitos en áreas perialveolares, peribronquiales y bronquios. En el intestino se observa hiperemia y en algunos casos, necrosis focal de mucosa con marcada infiltración mononuclear. En el hígado encontramos congestión centrolobulillar y vacuolizacion de los hepatocitos. La musculatura esquelética muestra procesos focales inflamatorios y degenerativos. Diagnóstico Las lesiones macro y microscópicas son extremadamente útiles para el diagnóstico. Las muestras ideales para el diagnóstico son el corazón, el hígado, el bazo, los pulmones, los ganglios linfáticos y el encéfalo. Los mismos deben ser congelados para el aislamiento viral y conservados en formol al 10 % para el estudio histopatológico. El diagnóstico definitivo se base en la identificación y aislamiento del virus, lo cual puede realizarse mediante prueba biológica por inoculación intracraneal o intrapeitoneal de material sospechoso de ratones de 12 a 20 g, presentándose en éstos parálisis flácida del tren posterior entre 48 y 72 horas, pudiendo morir en cuatro a siete días postinoculación. Existe una gama de líneas celulares estables que pueden utilizarse para el aislamiento, entre las cuales podemos mencionar BHK, vero, PK15, PFT y ST. El efecto citopático producido por el virus se caracteriza por redondeamiento y picnosis de las células, lo cual se observa después del segundo día de inoculación. La microscopía electrónica es otra herramienta que nos permite identificar el picornavirus en tejidos de animales afectados. La detección de anticuerpos puede realizarse por medio de las técnicas de inhibición de la hemoaglutinación (HI) y de seroneutralización (SN). Diagnóstico diferencial -
Hepatosis dietética
de los cerdos. Tratamiento y prevención Por ser ésta una enfermedad viral no existe tratamiento específico eficaz; sin embargo, puede disminuirse la mortalidad evitando situaciones de excitación o de estrés en los animales. Algunos países han desarrollado vacunas a virus muerto para el control de esta enfermedad. Aun cuando el papel exacto de los roedores en la transmisión de la enfermedad no está completamente entendido, el control de los mismos en las granjas debe efectuarse, mediante un programa de desratización sistemático. Para la desinfección es recomendable el uso de formol 2 % y preparaciones con base en soda caústica 2 %, yodadas y cloradas. Para el año 1996 se presentaron en Venezuela los primeros brotes de esta enfermedad en algunas granjas porcinas, observándose una alta mortalidad en forma súbita, en cerdos de diferentes etapas productivas. En tres de las granjas afectadas se reportaron índices de mortalidad entre 25 y 37 %, en cerdos desde la lactancia hasta el engorde; en madres, con mortalidad entre 2 y 3 % y los abortos se presentaron entre 1 y 4 % de las cerdas afectadas. En las dos primeras granjas el brote inicial duró cuatro semanas y en la tercera, siete; ocurriendo el rebrote en esta última a las seis semanas de finalizdo el primer brote y con una duración de cuatro semanas, con las mismas características clínicas. En el Instituto de Investigaciones Veterinarias se efectuaron estudios clínicos, epidemiólogicos, anatomopatológicos, histopatológicos, bacteriológicos y virológicos. Los resultados obtenidos en los diferentes análisis permitieron idlentificar esta nueva patología en el rebaño porcino nacional. Es importante resaltar que la EMC viene presentándose en Venezuela desde 1996, con unn comportamiento patogénico agresivo y un evidente y complicado cuadro anatomopatológico que compromete la vida del cerdo afectado, registrándose altos índices de mortalidad, lo que ha resultado en cuantiosas pérdidas económicas para el sector productivo porcino. Esta situación amerita toda la atención necesaria para controlar este problema, especiamente deben tomarse en cuenta las medidas de bioseguridad, conjuntamente con la toma de decisiones de nuevas alternativas de manejo en la producción porcina. Imagenes
Leyenda Bibliografía Acland, H.; I. R. Littelejohns. 1975. Encephalomyocarditis virus infection of pigs. 1. An outbreak in new south wales. Aust. Vet. J. 51: 409-414. Dea, S. A.; R. Bilodeau; G. P. Martineau. 1991. Isolation of encephalomyocarditis virus among stillborn and post-weaning pigs in Quebec. Arch. Virol. (117): 121-128. Joo, H. S.; H. S. Kim; A. D. Leman. 1988. Detection of antibody to encephalomyocarditis virus in mummified or stillborn pigs. Arch. Virol. (100): 131-134. Seaman, J. T.; J. G. Boulton; M. J. Carrigan. 1986. Encephalomyocarditis virus disease of pigs associated with a plague of rodents. Aust. Vet. J. 63 (9): 292-294. Leman, A. D. y col. s/f. Disease of swine. Sixth edition. Iowa State University Press. Ames, Iowa. USA. Koenen, F.; H. Vanderhallen; F. Castryck; C. Miry; M. Fockedey. 1996. Epidemiologic, pathogenetic and molecular analysis of the firts encephalomyocarditis outbreak in fattening pigs in Belgium. Proceedings of 14th IPVS Congress. Bologna, Italia. p. 96. |