|
1 Mussaenda
erythrophylla, flor de trapo, multiplicación in vitro,
explanta. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
RESUMENINTRODUCCIONEl género Mussaenda pertenece a la familia Rubiaceae. Comprende unas 190 especies distribuídas ampliamente en la faja tropical que se extiende desde Africa y Madagascar hasta la India, Ceilán, China, Malasia, Filipinas, Nueva Zelandia y Australia. Incluye una serie de arbustos con gran valor ornamental debido a que los sépalos del cáliz desarrollan estructuras petaloides largas y llenas de colorido y a la presencia de heterostilia (16). Entre las especies comercialmente importantes se encuentran: a) Mussaenda erythrophylla, b) M. philippica y M. frondosa, (8). Todas han tenido buena aceptación como plantas ornamentales. En ello ha influído su belleza e igualmente la gran adaptabilidad a condiciones tropicales, como también el largo período de floración que dura todo el año, siendo menor durante los meses de enero a marzo (20). Recientemente en Venezuela, han sido introducidas dos cultivares: M. erythrophylla `Rosea' y M. philippica `Aurorae'. Su propagación se ha venido realizando en el país utilizando estacas de tallo. Sin embargo, este método tiene dificultades por exigir condiciones especiales para enraizar y un manejo cuidadoso en el transplante. Consecuentemente, los costos de producción son elevados, encareciendo el valor monetario de cada planta. La multiplicación clonal de plantas ornamentales tropicales a través de los métodos convencionales de propagación asexual, no ha sido suficientemente rápida para satisfacer la demanda. Esto ha motivado que aumenten las investigaciones sobre factibilidad de usar el cultivo de tejidos para una propagación clonal rápida, tanto de plantas difíciles de propagar, como en aquellas que tienen un bajo porcentaje de éxito por métodos tradicionales (18). La investigación realizada con el cultivar `Rosea', basado fundamentalmente en trabajos efectuados con otras plantas ornamentales, tuvo como objetivo principal su multiplicación en forma vegetativa mediante el cultivo in vitro como un método complementario de la propagación convencional de lo cual no se tenía información. Con ésto se lograría incrementar la población de plantas y abaratar los costos por unidad. Además, se tendría la posibilidad de introducir el producto a mercados internacionales. El mayor estímulo para el empleo de la técnica en el área de las ornamentales se atribuye a Morel, quien en 1960 la utilizó para la propagación clonal y restauración de orquídeas a partir de plantas infectadas con virus, por ello ha sido citado por varios autores, (12, 18, 24). A partir de allí, especies ornamentales pertenecientes a diversos géneros de diferentes familias, han demostrado el potencial para la multiplicación clonal in vitro. CONGER (1) y GEORGE et al (7), presentan una extensa lista de ornamentales herbáceas y leñosas propagadas a través de estas técnicas. Etapas de la técnica del cultivo in vitroMURASHIGE (24), ha propuesto tres etapas secuenciales para la propagación clonal: Primera Etapa: Establecimiento de un cultivo aséptico. Aquí se debe lograr la supervivencia de las explantas en proporción adecuada, un rápido crecimiento y cultivos libres de contaminantes. En esta etapa uno de los factores que merece consideración es la explanta a utilizar. Para fines de propagación clonal, la explanta mayormente empleada es el ápice caulinar proveniente de yemas laterales y terminales. Diversas especies ornamentales han sido multiplicadas de esta manera: Asparagus officinalis (10), Gerbera jamesonii (25), Dianthus caryophyllus (3), Pelargonium hortorum (22), Anthurium andreanum (19), Rosa hybrida (11) Rhododendron sp. (6), Exacum affine (37), Gardenia jasminoides (4), Vinca minor (33) y Syringa sp (5). Segunda Etapa: Multiplicación del propágulo. Puede lograrse por: 1) formación de brotes axilares y 2) inducción de brotes adventicios o embriones somáticos. Entre las especies micropropagadas usando el primer método están Asparagus officinallis (10), Gerbera jamesonii (25), Dianthus cariophyllus (3), Pelargonium hortorum (22), Rosa hybrida (11), Epiphyllum chrysocardium (21), Vinca minor (33), Gardenia jasminoides (4) y Syringa sp (5). Por el segundo método se ha logrado éxito con Narcissus sp. (13, 15, 31), algunas especies de la familia Bromeliaceae (14), Dracaena marginata (2), Hyacinthus orientalis (17) y Rhododendron sp (6). Sin embargo, los brotes y/o plantitas no siempre se originan de una sola manera. PAPACHATZI et al (28) cuando cultivaron Hosta decorata `Thomas Hogg', a partir de ápices caulinares, lograron la formación de brotes, tanto axilares como adventicios. Tercera Etapa: Preparación para el establecimiento final de las plantas. Aquí se persigue enraizar los brotes obtenidos in vitro, endurecer las plantitas, alcanzar cierta tolerancia contra algunos patógenos y la conversión de las plantas de su condición heterótrofa a autótrofa. Los brotes obtenidos in vitro pueden producir raíces en la etapa anterior. Ello ha sido posible en Asparagus (10), Saintpaulia (34) y Narcissus (13). Sin embargo, a menudo es necesario su inducción, como en los casos de Gerbera (25), Dianthus (3), Rosa (11), Hyacinthus (17), Dracaena (2), Rhododendron (6) y Epiphyllum (21). Cuando las plantitas producidas in vitro son transferidas a condiciones in vivo, se presentan fallas en la supervivencia de las mismas. Esto se debe, principalmente, a estrés de humedad (35) y a la falta de un desarrollo funcional adecuado del aparato fotosintético (10). MATERIALES Y METODOSEl estudio se realizó con la especie ornamental Mussaenda erythrophylla, `Rosea' en el Laboratorio de Cultivo in vitro de la Escuela de Agronomía de la Unviersidad Centro Occidental "Lisandro Alvarado", el cual funciona en el Postgrado de Horticultura, en Tarabana, distrito Palavecino, Edo. Lara. Preparación de la explanta.La explanta utilizada se obtuvo de yemas apicales y laterales provenientes de estacas caulinares de madera blanda con 10 a 15 cm de longitud, tomadas de plantas adultas de Mussaenda erythrophylla var `Rosea'. Después de eliminar las hojas, se cortaron los nudos en secciones de 1 cm de largo, aproximadamente. Dichas secciones fueron lavadas por 10 minutos con agua jabonosa, enjuagándolas después hasta eliminar los residuos del detergente. La desinfección se hizo con una solución de hipoclorito de sodio al 10% (Clorowet, 6% de ingrediente activo), y el adherente Citowett (3 gotas por cada 100 ml), durante 20 minutos. A partir de este momento, todo el proceso fue realizado bajo condiciones asépticas en una cámara de flujo laminar, "IAS" (Integrated Air Systems). Para eliminar el exceso de hipoclorito, el material desinfectado se lavó por tres veces consecutivas con agua destilada, desmineralizada y esterilizada en autoclave durante 30 minutos a 121oC de temperatura y 15 lb/pulg2 de presión. Con la ayuda de un microscopio de disección Wild-Heerbrugg M-5, usando 12 x de aumento, se eliminaron los primordios de hojas más externas hasta dejar al descubierto el ápice caulinar. La explanta resultante, de 2 a 3 mm de longitud y compuesta del domo meristemático más unos pocos primordios de hojas, fue colocada en una solución de hipoclorito de sodio al 1% de producto comercial y luego plantada en el tubo de ensayo contentivo del medio de cultivo. En cada experimento fueron empleados 10 tubos por tratamiento y una explanta en cada tubo. Medio de cultivo.En la preparación del medio de cultivo se usó la formulación de MURASHIGE y SKOOG (26), para sales inorgánicas y fueron probadas las concentraciones de 1/4, 1/2, 3/4 y 1 de los macro y microelementos que constituyen el medio. Con respecto a los componentes orgánicos y su concentración, se probaron los reguladores del desarrollo, vitaminas, carbohidratos y aminoácidos, mencionados a continuación: a. Reguladores del desarrollo: Citocininas: Cinetina (6 furfuril aminopurina) a concentraciones de 0-0.5 - 1 y 2 mg/l, Benziladenina (6 benzil aminopurina) a 0-1.25 - 2.50 y 5 mg/l e Isopenteniladenina (6 dimetil aminopurina) a 0-1.5 - 2.5 y 5 mg/l. Auxinas: Acido Indol Acético (AIA), Acido Indol Butírico (AIB) y Acido Naftalenoacético (ANA). Se realizaron combinaciones entre citocininas y auxinas variándose ambas sustancias en las concentraciones de 1-2 y 4 mg/l. Para la formación de raíces se probó el AIB y el ANA en concentraciones de 1-2-4-8 y 10 ppm. b. Sulfato de Adenina (SA): Se usó en concentraciones de 0-20-40-80 y 120 mg/l. c. Vitaminas: Clorohidrato de tiamina a 0-10-20 y 30 mg/l. Acido nicotínico a 0-2.5-5 y 10 mg/l y Clorohidrato de piridoxina a 0-0.5-1 y 2 mg/l. d. Meso-inositol: Se usó en concentraciones de 0-50-100 y 150 mg/l. e. Carbohidratos: Glucosa y Sacarosa, en concentraciones de 0-10-20 y 30 g/l. f. Aminoácidos: L-Tirosina a 0-25-50 y 100 mg/l y L-Cisteina HCL a 0-20-30 y 40 mg/l. El estado físico del medio fue semisólido, empleando Difco Bacto Agar en concentraciones de 10 g/l. El pH de las soluciones se ajustó a 5.7 0.1 con NaOH o HCL 1 N. Los medios preparados y distribuídos en tubos de ensayos 25x150 mm, en partes alícuotas de 25 ml por tubo, fueron tapados y esterilizados en autoclave a temperatura de 121oC y 15 lb/pulg2 de presión durante 15 minutos. De acuerdo con los resultados obtenidos en cada uno de los experimentos, se seleccionó el componente y su concentración más apropiada. El criterio empleado para esta selección fue el mayor porcentaje de cultivos con brotes y/o raíces, su desarrollo normal y el menor tiempo de crecimiento. La información lograda en cada ensayo fue usada en los experimentos posteriores con el propósito de mejorar el medio definitivo. Condiciones de cultivo.Los cultivos fueron colocados en un cuarto de crecimiento a una temperatura aproximada de 27oC y 16 horas de iluminación diaria. El estudio se dividió en las tres etapas, de acuerdo con las recomendaciones de MURASHIGE (24). En la fase de iniciación, las explantas crecieron bajo una intensidad luminosa de 1 000 lux durante cuatro semanas. Luego los brotes fueron transferidos a un medio de multiplicación, donde continuaron su desarrollo por un período de tres a cuatro semanas bajo 3 000 lux de iluminación. Posteriormente, se separaron los brotes de 1 a 1.5 cm de longitud, colocándolos en un medio para la formación de raíces bajo intensidad luminosa de 10 000 lux por un lapso de dos semanas, aproximadamente. Trasplante y endurecimiento de las plantas.A los 14 días de haber sido colocados los brotes en el medio para enraizar, las plantitas tenían suficientes raíces. El transplante se hizo desde el tubo de ensayo a los "jiffy" (pequños cilindros de turba compactada en vuelta en una malla). Estos fueron colocados en vasos plásticos cubiertos con una envoltura de "envo-plast" para mantener una alta humedad relativa y evitar la deshidratación de las plantitas. Así se conservaron durante 2 a 3 semanas bajo una intensidad luminosa de 10 000 lux, hasta lograr su endurecimiento. Transcurrido este tiempo, se retiró el "envo-plast" y posteriormente, cuando las plantitas alcanzaban una altura aproximadamente de 10 cm, eran trasplantadas a bolsas o envases plásticos con una mezcla de tierra, arena y materia orgánica, en proporción 2:1:1, respectivamente y esterilizada en autoclave a temperatura de 121oC y 15 lb/pulg2 de presión durante 30 minutos. RESULTADOS Y DISCUSIONI. Fase de Iniciación:Origen de la Explanta: Los ápices caulinares provenientes de yemas apicales y laterales, fueron capaces de formar brotes y raíces in vitro en medios de cultivo similares. Sin embargo, el número de brotes formado, a medida que se repica el material, es ligeramente mayor cuando la fuente de la explanta son las yemas apicales. Asimismo, el crecimiento es más acelerado especialmente en esta fase (Figura 1). Esto comprueba que dichos ápices constituyen una explanta apropiada para iniciar el cultivo de Mussaenda erythrophylla `Rosea' al igual que ocurre en otras plantas ornamentales (3, 4, 5, 6, 10, 11, 19, 22, 28, 33, 36).
Efecto de las sales de Murashige y Skoog: Al aumentar la concentración desde 1/4 a 1/2, 3/4 y 1, el porcentaje de cultivos con brotes se incrementó marcadamente. La proporción de 1 resultó ser mejor; con ella el 80% de los cultivos desarrolló brotes, disminuyendo la formación de callo. De acuerdo con estos resultados el medio Murashige y Skoog en la concentración establecida en su formulación (26), fue efectivo en las tres fases de propagación in vitro de Mussaenda. Efecto de las Citocinicas: En el Cuadro 1, se observa que los mejores resultados se obtuvieron con la utilización de Benziladenina (BA) en el medio de cultivo. A 1.25 y 2.50 mg/l los brotes desarrollaron rápidamente, formando menor cantidad de callo. El follaje presentó mejores características en la concentración de 2.50 mg/l. A 5 mg/l los brotes desarrollaron hojas muy alargadas, deformadas y hubo formación de un callo abundante. Fue seleccionada la concentración de 2.5 mg/l como la más apropiada. Tanto cinetina (C) como isopenteniladenina (2ip), en las concentraciones probadas, tuvieron poco efecto en la formación de brotes y hubo abundante proliferación de callo.
Efecto de la combinación de Citocininas y Auxinas: Los mejores resultados se lograron al combinar las citocininas con el AIA, obteniéndose formación de brotes en todas las concentraciones probadas. Por el contrario, cuando la auxina era ANA, se formó solamente tejido de callo y al utilizar AIB, sólo se observaron brotes en algunas de las combinaciones. El Cuadro 2, muestra que los porcentajes más altos de cultivos con brotes fueron alcanzados con BA/AIA. La óptima concentración de BA varió de 1 a 4 mg/l cuando la concentración con AIA era de 2 mg/l. Las características de crecimiento fueron muy similares en las combinaciones 1/2 y 2/2; pero, en esta última el 20% de los cultivos desarrolló callo. La mayor formación de brotes se observó con la combinación 4/2; pero, su desarrollo fue un poco más lento que en las dos combinaciones anteriores. En la combinación 4/4, el 60% de los cultivos desarrolló brotes y abundante formación de callo. En este ensayo se escogió la concentración 1/2 mg/l como la más efectiva. En igual forma, SAMARTIN et al (30), encontraron que la combinación BA/AIA produjo los mejores resultados en la propagación in vitro de Camellia.
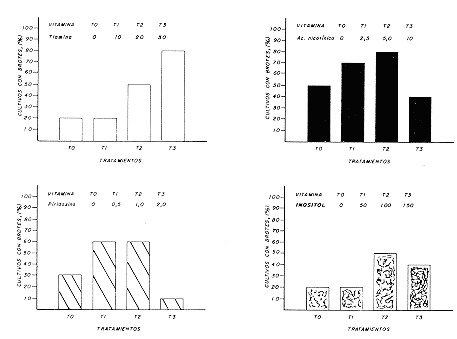
En las combinaciones cinetina/AIA y 2ip/AIA, se obtuvieron brotes en porcentajes inferiores y con poco crecimiento. Efecto del Sulfato de Adenina (SA): El número de cultivos formadores de brotes fue muy homogéneo en todos los tratamientos; pero el desarrollo de los mismos y la calidad del callo formado dependieron de la adición del SA. No obstante, a medida que aumentaba la concentración de este compuesto, se produjo un quemado en las hojas que alcanzó a 100% cuando se usaron 120 mg/l. El nivel de 40 mg/l fue considerado como el más efectivo. Estos resultados concuerdan con los obtenidos en Gerbera (25), Saintpaulia (34), Dianthus (3), Pelargonium (22), Hosta (28) y Camellia (30), donde el SA se manifestó como un factor responsable del crecimiento de la explanta y/o de la formación de brotes, tanto axilares como adventicios. Efecto de las Vitaminas y del Inositol: En la Figura 2, se observa que las tres vitaminas influyeron positivamente en la formación y desarrollo de los brotes de Mussaenda. El porcentaje de cultivos con brotes incrementó a medida que los niveles de tiamina aumentaron de 10 a 30 mg/l. Con esta última concentración, la cual fue seleccionada, se obtuvieron mejores resultados. Los niveles de 2.5 y 5 mg/l de ácido nicotínico produjeron la mayor formación de cultivos con brotes. Fue elegida la concentración de 5 mg/l porque los brotes presentaron mejores características y un mayor crecimiento. Al utilizar la Piridoxina en los niveles de 0, 0.5 y 1.0 mg/l se incrementó el porcentaje de cultivo con brotes desde 30% a 60%. Debido a que las características de los brotes fueron muy semejantes, se escogió el nivel de 0.5 mg/l.
El Inositol produjo sus mejores efecto al nivel de 100 mg/l, siendo ésta la concentración seleccionada. De acuerdo con estos resultados, la combinación de vitaminas e Inositol utilizada en el cultivo de Gerbera (25), también fue efectiva para la Mussaenda, aunque hubo necesidad de reducir a la mitad el ácido nicotínico de 10 a 5 mg/l y la Piridoxina de 1 a 0.5 mg/l. En cambio, la Tiamina e Inositol permanecieron igual, a un nivel de 30 mg/l y 100 mg/l, respectivamente. Efecto de los Carbohidratos: Sacarosa y glucosa porcentajes similares de cultivos con brotes en las cuatro concentraciones probadas. Al aumentar los niveles de carbohidrados se incrementó el número de cultivos formadores de brotes, obteniéndose el máximo con 30 g/l. Con glucosa el crecimiento fue mucho menor y hubo formación de callo en la base de la explanta. Por su mayor influencia en el crecimiento y calidad del brote formado, se seleccionó la sacarosa al nivel de 30 g/l, al igual que se ha obtenido en otros cultivos ornamentales (2, 9, 10, 11, 17, 19, 21, 30, 33, 34). Efecto de los Aminoácidos: El Cuadro 3, muestra que el aminoácido L-tirosina no tuvo efecto positivo en la formación de brotes de Mussaenda. Sin embargo, la cisteína empleada en los niveles de 20 y 30 mg/l incrementó en un 20% el número de cultivos con brotes en relación con el testigo. Fue seleccionada la concentración de 30 mg/l por la mejor apariencia de los brotes y su mayor crecimiento. Este resultado se asemeja al obtenido por PEÑA y PEREA (29) en la propagación in vitro de Coffea, donde señalaron que la concentración óptima de cisteína fue de 36.88 mg/l.
II. Fase de Multiplicación:La multiplicación de los brotes se logró utilizando el mismo medio empleado en la fase de iniciación; pero variando los niveles de los reguladores del desarrollo y excluyendo el SA. Con respecto a los reguladores del desarrollo, se excluyó el AIA y fue aumentada a 2.5 mg/l la concentración de BA. Esta modificación permitió incrementar el desarrollo y el número de brotes por cultivo como consecuencia de la proliferación de brotes axilares (Figura 3). Esto puede ser explicado por el efecto opuesto de las auxinas y citocininas sobre la dominación apical (37). En este caso el AIA la refuerza, mientras que el BA la reprime, favoreciendo el desarrollo de brotes axilares. Resultados similares fueron obtenidos en el cultivo de Rosa `Improved Blaze' (11), Hosta decorata `Thomas Hogg' (28) y en doce especies y cultivares ornamentales de la familia Rosaceae (27).
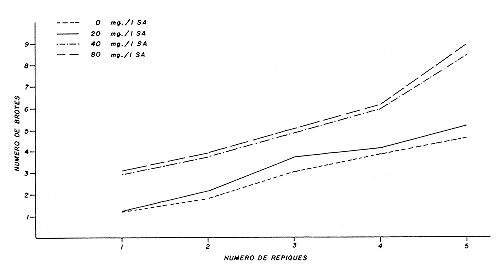
La exclusión del SA fue debido a que su incorporación en el medio de multiplicación ocasionó un crecimiento anormal de los brotes, especialmente en las hojas, las cuales tornaron gruesas y de apariencia rugosa. Estas alteraciones morfológicas desaparecieron con la omisión de este compuesto, tal como sucedió en Dianthus (3). No obstante, cuando fue transferido a esta fase el material proveniente del medio de iniciación contentivo de 40 mg/l de SA, se observó el efecto promotor de este compuesto en la proliferación de brotes axilares (Figura 4), obteniéndose un incremento promedio de 3.8 brotes en el quinto repique con respecto a los cultivos que provenían del mismo medio nutritivo sin SA.
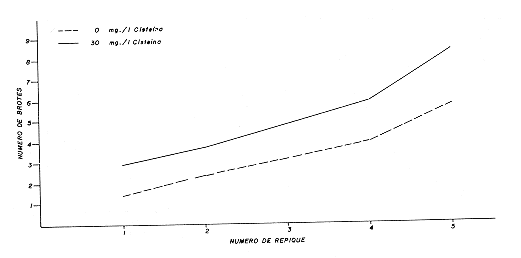
Los resultados concuerdan con lo demostrado por SKOOG y TSUI (32), quienes observaron por primera vez el efecto estimulante de la Adenina en la iniciación y diferenciación de los brotes de tabaco. Esta respuesta puede atribuirse a la inversión del efecto antagónico de la auxina sobre la formación de brotes ocasionada, según MILLER y SKOOG (23), por el Sulfato de Adenina y a la acción sinergética de este compuesto con la Benziladenina señalada en Hosta (28) y Camellia (30), lo cual mejoró la producción y calidad de los brotes. El SA, también estimuló la formación de brotes adventicios, ya que a partir del tejido de callo hubo diferenciación de un gran número de éllos. Sin embargo, la propagación in vitro de la Mussaenda se logró por la multiplicación de los brotes axilares, al igual que en Asparagus (10), Gerbera (25) Dianthus (3), Rosa (11), Camellia (30), Gardenia (4) y Vinca (33). La cisteína también fue incluída en esta fase, porque al transferir la explanta del medio de iniciación al de multiplicación con y sin cisteína, se observó que la presencia del aminoácido ocasionó un incremento promedio de 2.7 brotes al nivel del quinto repique (Figura 5). Esto reafirma el hecho que algunos aminoácidos pueden causar efectos beneficiosos en la multiplicación de órganos (24).
III. Fase de Formación de Raíces:La formación de raíces se logró eliminando las citocininas del medio adicionando auxinas. De las dos auxinas probadas el AIB fue superior al ANA. En el Cuadro 4, se observa que al aumentar la concentración del AIB de 1 a 8 ppm, se incrementa el porcentaje de raíces acortando el tiempo de la formación de un sistema radical largo, delgado y bien ramificado. Con la concentración de 10 ppm, todos los brotes sufrieron quemaduras en el follaje.
Con ANA en todas las concentraciones probadas se obtuvo menor porcentaje de brotes con raíces en relación con AIB, aunque el tiempo fue muy similar. Sólo al nivel de 1 ppm se formaron raíces largas y gruesas y poca cantidad de tejido de callo en la base del brote. Al aumentar las concentraciones, las raíces se hacían más cortas y muy gruesas y la proliferación de callo fue mayor, PAPACHATZI et al (28) observaron resultados similares en Hosta. Basándose en estos resultados, se seleccionó el nivel de 8 ppm de AIB. Esta auxina también ha sido efectiva para enraizar brotes producidos in vitro de otras ornamentales como Epiphyllum (21), algunas especies de Rosaceae (27) y Camellia (30). En esta fase también fue excluída la cisteína y se redujo la sacarosa a 15 g/l. Estas modificaciones facilitaron el cambio y adaptación de las plantitas de su conducción heterótrofa a autótrofa. Potencial de multiplicación in vitro: El brote original formado por crecimiento de la explanta en el medio de iniciación, al ser transferido al de multiplicación, permitió el incremento del material a través de los sucesivos subcultivos. En el Cuadro 5, se observa que la tasa de multiplicación ascendio con el número de repiques, alcanzando un promedio de 8.4 brotes por cultivo a nivel del quinto pasaje. Este fue estimado como límite, a pesar que en el sexto repique continuó aumentando el número de brote; pero el tamaño se redujo considerablemente. Partiendo de una estaca terminal con 10 yemas y considerando un 60% de éxito en la fase de iniciación y un 75% durante la fase de formación de raíces, puede estimarse una producción aproximada de más de 30 000 plantitas por año con capacidad de ser transplantadas. Transplante: El trasplante de las plantitas desde el medio de
formación de raíces hasta los "jiffy" resultó bastante satisfactorio.
Posteriormente, cuando fueron transferidas a bolsas o envases plásticos
continuaron normalmente su crecimiento y desarrollo
SUMMARYBIBLIOGRAFIACONGER, B. V. Cloning Agricultural. Plants Via in vitro Techniques. CRC Press. Boca Raton, Florida. pp. 23-33. 1982. CHUA, B. U., J. T. KUNISAKI and Y. SAGAWA. In vitro propagation of Dracaena marginata `Tricolor'. HortScience 16(4): 494. 1981. DAVIS, M. J., R. BAKER and J.HANAN. Clonal multiplication of carnation by micropropagation. J. Amer. Soc. Hort. Sci. 102(1): 48-53. 1977. ECONOMOU, A. and M. SPANOUDAKI. In vitro propagation of Gardenia. HortScience 20(2): 213. 1985. EINSET, J. W. and J. H. ALEXANDER. Multiplication of Syringa species and cultivars in tissue culture. Horticultural Abstracts 56(10): 864. 1986. FORDHAM, I. and D. STIMART. Axillary and adventitious shoot proliferation of exbury azaleas in vitro. HortScience 17(5): 738-739. 1982. GEORGE, E. F. and P. D. SHERRINGTON. Plant propagation by tissue culture. Ed. Exegetics. Ltd. England. 1984. pp. 398-447. GRAF, A. B. Tropica Color Cyclopedia of Exotic Plants and Trees. Roehrs Company Pub. New-Jersey. 1979. p. 1036. HARAMAKI, C. Tissue culture of Gloxinia. The international Plant Propagator's Society 21: 442-448. 1971. HASEGAWA, P. M. Further investigations on shoot apex culture of Asparagus officinalis L. M.S. Thesis University of California. Riverside. 1972. 59 p. HASEGAWA, P. M. Factors affecting shoot and root initiation from cultured rose shoot. tips. J. Amer. Soc. Hort. Sci. 105(2): 216-220. 1980. HOLDGATE, D. P. Propagation of ornamentals by tissue culture. In: Applied and Fundamental Aspects of Plant Cell, Tissue and Organ Culture. Ed. Reinert and Bajas. Springer Verlang. Berlin. 1977. pp. 19-43. HOSOKI, T. y T. ASAHIRA. In vitro propagation of Narcissus. HortScience 15(5): 602-603. 1980a. HOSOKI, T. and T. ASAHIRA. In vitro propagation of Bromeliads in liquid culture. HostScience 15(5): 603-604. 1980b. HUSSEY, G. In vitro propagation of Narcissus. Ann. Bot. 49: 707-719. 1982. JAYAWEERA, D. The Rubiaceous genus Mussaenda. The morphology of asiatic species. J. Arnold Arboretum 44: 111-126. 1963. KIM, Y., P. HASEGAWA and R. BRESSAN. In vitro propagation of Hyacinth. HortScience 16(5): 645-647. 1981. KUNISAKI, J. T. Tissue culture of tropical ornamental plants. HortScience 12(2): 141-142. 1977. KUNISAKI, J. T. In vitro propagation of Anthurium andreanum Lind. HortScience 15(4): 508-509. 1980. LATIN-ROSARIO, T. and D. A. RAMIREZ. The citology of the Philippine ornamental Mussaendas. The Philippine Agriculturist 52(2): 101-110. 1968. LAZARTE, J. E., M. S. GAISER and O. R. BROWN. In vitro propagation of Epiphyllum chrysocardium. HortScience 17(1): 84. 1982. MESSEGUER, J., E. MELE y F. VAN HOOF. Cultivo In vitro de ápices meristemáticos de Pelargonium hortorum. Madrid. Instituto Nacional de Investigaciones Agrarias. 1980. 26 p. MILLER, C. and F. SKOOG. Chemical Control of bud formation in tobacco stem segments. Amer. J. Bot. 40(10): 768-773. 1953. MURASHIGE, T. Plant propagation through tissue cultures. Ann. Rev. Plant Physiol. 25: 135-166.1974. MURASHIGE, T., M. SERPA and J. JONES. Clonal multiplication of Gerbera through tissue culture. HortScience 19(2): 175-180. 1974. MURASHIGE, T. and F. SKOOG. A revised medium for rapid growth and bioassays wiht tobacco tissue cultures. Physiol. Plant. 15: 473-497. 1962. NORTON, M. E. and A. A. BOE. In vitro propagation of ornamental rosaceous plants. HortScience 17(2): 190-191. 1982. PAPACHATZI, M., P. ALLEN and P. HASEWAGA. In vitro propagation of Hosta decorata `Thomas Hogg' using cultured shoot tips. HortScience 106(2): 232-236. 1981. PEÑA, N. y M. PEREA. Regeneración de plántulas in vitro del género Coffea. Universidad Nacional de Bogotá, Bogotá. 1981. 33 p. SAMARTIN, A., A. VIEITEZ and E. VIEITEZ. In vitro propagation of Camellia japonica seedlings. HortScience 19(2): 225-226. 1984. SEABROOK, J., B. CUMMING and L. DIONNE. The in vitro induction of adventitious shoot and root apices on Narcissus (daffodil and narcissus) cultivar tissue. Can. J. Bot. 54(9): 814-819. 1976. SKOOG, F. and C. TSUI. Chemical control of growth and bud formation in tobacco stem segments and callus cultured in vitro. Amer. J. Bot. 35(10): 782-787. 1948. STAPFER, R. E. and C. W. HEUSER. In vitro propagation of periwinkle. HortScience 20(1): 141-142. 1985. START, N. and B. CUMMING In vitro propagation of Saintpaulia ionantha. HortScience 11(3): 204-206. 1976. SUTTER, E. and R. W. LANGHANS. Epicuticular wax formation on carnation plantlets regenerated from shoot tip culture. J. Amer. Soc. Hort. Sci. 104(4): 493-496. 1979. TORRES, K. C. and N. J. NATARELLA. In vitro propagation of Exacum. Hortscience 19(2): 224-225. 1984. WICKSOM, M. E. and K. V. THIMANN. The antagonism of auxin and kinetin in apical dominance. Physiol. Plant. 11: 62-74. 1958. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||