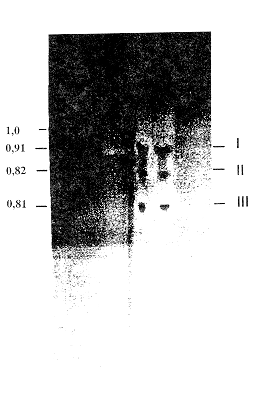|
Agronomía Tropical 49(4):491-504. 1999.
Profesores investigadores. Universidad Central de
Venezuela RECIBIDO: junio 12, 1998 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
RESUMENPalabras Clave: Curcuma longa L.; pigmentos; curcumina. SUMMARYKey Words: Curcuma longa L.; pigments; Turmeric. INTRODUCCIÓNLa cúrcuma, Curcuma sp., es una planta perteneciente a la familia de las Zingiberaceae, originaria del sureste de Asia y muy cultivada en India, Jamaica, Perú, Haití, Taiwan y parte de China. La Curcuma longa L., representa al "turmeric" usado comercialmente como fuente de pigmento y como especia (Montalbo, 1972; Schnee, 1984). El cultivo de cúrcuma en el país es reciente; en 1993 la producción aproximada fue de 100 t/año de rizomas; sin embargo, se desconoce la calidad del producto nacional para evaluar su potencial como colorante y saborizante en comparación al producto importado, del cual se importan aproximadamente 25 916 kg. de rizomas secos pulverizados, lo que equivale a 94 688 kg. de producto fresco. La cúrcuma imparte color y sabor a los alimentos, el pigmento es muy usado en preparados de mostaza, curry en polvo, sopas, arroz, vegetales, condimentos y salsas. Los componentes que caracterizan la cúrcuma son los pigmentos amarillos y los aceites volátiles. El principal pigmento amarillo es curcumina [1,7-bis-(4'-hidroxi-3'metoxi-fenil)hepta-1,6-dieno-3,5-diona]; otros curcuminoides son; desmetoxicurcumina y bisdesmetoxicurcumina (Govindarajan, 1980; Karasz et al., 1973; Raghuveer et al., 1979; Sen et al., 1974). Por su parte, Janben (1984) determinó por el método de cromatografía de capa fina (CCF) los tres componentes colorantes de la curcumina, y señaló que el polvo de los rizomas de cúrcuma contiene además 5,5% de aceites volátiles. El autor señaló que los tres diferuloil metano pueden ser reconocidos luego de la separación, pero el color desaparece rápidamente. Sólo el reactivo ácido acético-bórico produjo color dependiendo de la concentración una mancha roja, la cual fluorece rojo sangre y el color se retuvo por más de una hora. La rubrocurcumina producida tiene un rojo más intenso que la rosocianina, sin embargo, señaló el autor que la desmetoxicurcumina es más naranja. A través de sus investigaciones Smith y Witowska (1984) determinaron curcumina en cúrcuma por cromatografía líquida a alta presión (CLAP) y espectrofotometría ultravioleta comparando la sensibilidad de los dos detectores. Los autores señalaron que la elusión de los componentes con acetonitrilo: agua (60:40) fue insatisfactoria debido a que no se obtuvo buena resolución de los picos. Los cromatogramas obtenidos usando un detector de ultravioleta a 254 nm y acetonitrilo: buffer de pH 4,4(60:40) como eluente mostró un pico a un tiempo de retención de k'= 2,25, lo cual según los autores se identificó como curcumina por comparación con un estándar, y dos picos menores de similar tiempo de retención (k'= 1,93 y 2,09), los cuales están presentes también en el estándar. Estos últimos autores citados señalaron que en ausencia de cetonas, la separación de los curcuminoides pudo realizarse usando acetonitrilo: buffer (50:50) como eluyente. Debido a que se obtuvo un pequeño solapamiento de los picos de los curcuminoides, los autores examinaron otras alternativas con similar polaridad como metanol: buffer (70:30) donde todos los curcuminoides fueron eluidos como un pico simple. Con tetrahidrofurano: buffer (45:55) los curcuminoides se eluyeron en orden reverso al acetonitrilo-buffer. Los autores indicaron que las diferencias entre los índices de retención de los estándares en los tres eluyentes reflejan una marcada diferencia en las interacciones presentes. Puesto que los tres circuminoides son fenólicos, la sustitución de los grupos metoxilos presumiblemente altera el enlazamiento intermolecular de los hidrógenos y causó la reversión en el orden de elución de los diferentes eluyentes. Por otro lado, Rouseff (1988) realizó la separación de los pigmentos de cúrcuma y onoto por CLAP en muestras de alimentos. El autor señaló que por CLAP mucho de los problemas fotoquímicos y oxidativos de las separaciones en placas son eliminados debido a que las separaciones en CLAP son en columnas de acero inoxidable. También observó que la descomposición oxidativa es minimizada debido a que la separación ocurre rápidamente y el oxígeno es removido de la fase móvil durante el paso del solvente. El método empleado por Rouseff consistió en la extracción de la muestra con tetrahidrofurano: agua (50:50). El solvente usado para la elusión fue THT-H2O en forma de gradiente desde 42% de agua y 58% de THF, con un flujo de 1 ml/min. por 10 min. El autor indicó que la mezcla de solventes agua-metanol y acetonitrilo-agua fueron insatisfactorias, y que con agua-tetrahidrofurano como solventes se obtuvo una buena resolución y forma de los picos. El factor de separación aumenta desde 1,0 para los tres curcuminoides a 60% de THF hasta 1,09 y 1,11 a 50% de THF. A 35% de THF el valor del factor de separación entre la curcumina y la desmetoxicurcumina fue 1,23 y entre la desmetoxicurcumina y la bisdesmetoxicurcumina fue también 1,23. El autor señaló que la resolución aumenta con la disminución de la proporción de THF en la fase móvil. A 50% THF la resolución fue 1,05 y 1,08, respectivamente, y 1,90 y 1,93 a 45% de THF; por lo que la resolución disminuyó drásticamente cuando la concentración de THF aumentó hasta 50%. Con respecto a la separación isocrática contra el gradiente de separación fue posible usando 50% de THF a un flujo de 1 ml/min. La resolución de los tres curcuminoides bajo las condiciones señaladas fue 1,30 y 1,34. Para la separación de los curcuminoides por separación isocrática se requiere 58% de THF-42% H2O con un tiempo de análisis de 10 min. El primer pico obtenido fue curcumina con absorbancia máxima a 428 nm, según el autor; el segundo es desmetoxicurcumina con absorbancia máxima a 424 nm y el tercero es bisdesmetoxicurcumina con absorbancia máxima a 428 nm. El objetivo del estudio fue el caracterizar los pigmentos de cúrcuma cosechada en el estado Portuguesa, Venezuela, así también evaluar la calidad con respecto a productos importados. MATERIALES Y MÉTODOSLa materia prima, rizomas de cúrcuma, C. longa L., utilizada fue obtenida por un proveedor del estado Portuguesa, Venezuela. Los rizomas de cúrcuma (1 kg. de materia prima) fueron seleccionados por su aparente estado de madurez o tamaño; descartándose aquellos que presentaban visiblemente ataque microbiano y/o defectos físicos. Luego fueron lavados, cortados en rodajas y secados en un secador de bandejas con corriente de aire caliente a 60 oC por 7 h según el método descrito por Sampathu et al. (1988). Las rodajas se procesaron en un molino marca Black and Decker hasta un tamaño de partícula de 40 mallas, para ser almacenadas en frascos ambar bajo refrigeración, para su posterior análisis histoquímico. Análisis químico: En la determinación de la composición química de los rizomas de la cúrcuma; contenido en agua por destilación con solventes no miscibles, cenizas totales, cenizas insolubles en ácido, fibra cruda, aceites esenciales no volátiles, se utilizaron los métodos de análisis recomendados por la American Spice Trade Association (1960). La determinación del contenido total de pigmento expresado como curcumina se realizó por el método señalado por Manjunath et al. (1989). La determinación de almidón se realizó por el método No. 76-10 de la A.A.C.C. (1987), modificado y señalado por Emaldi (1988). Cromatografía en capa fina (CCF): Se realizó según el método señalado por Janben (1984). Cromatografía líquida de alta presión (CLAP): Esta se utilizó para separar los componentes pigmentantes de la cúrcuma. Esta experiencia estuvo basada según el método señalado por Rouseff (1988). Espectros de absorción: Los espectros de absorción se determinaron en extractos de etanol al 90%, obtenidos después de separar los pigmentos de capa fina, realizando un barrido entre longitudes de onda desde 190 a 820 nm, obteniéndose los espectros de absorción correspondientes. RESULTADOS Y DISCUSIÓNComposición Química Los resultados obtenidos de los análisis químicos en los rizomas frescos se muestran en el Cuadro 1. Se observa que los rizomas de cúrcuma presentan un alto contenido de humedad, así como de materia colorante.
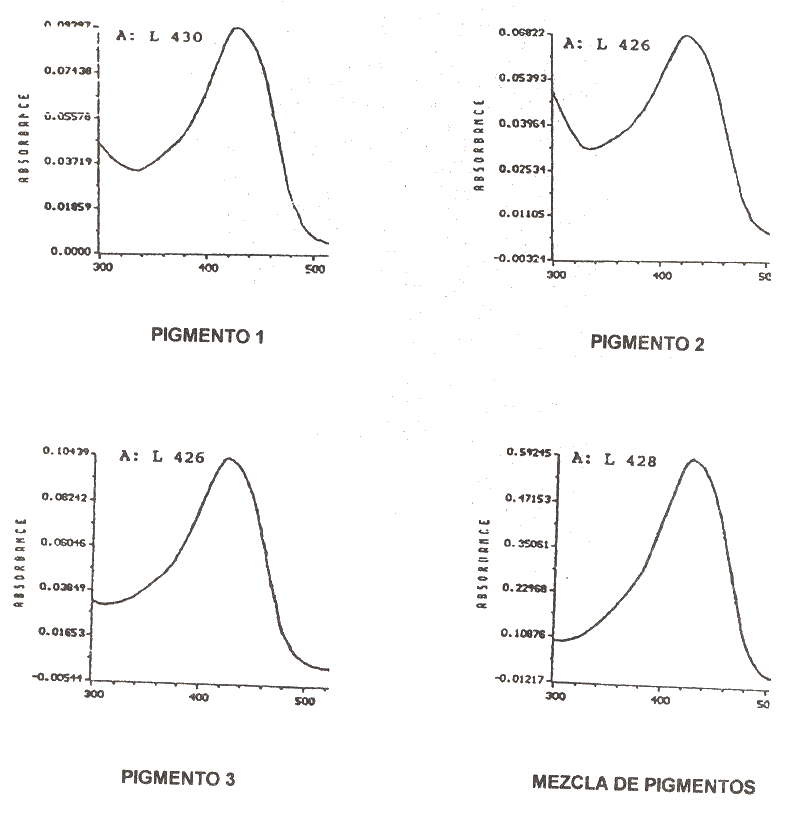
Por los resultados obtenidos se podría inferir que la variedad que se cosecha en el estado Portuguesa es la C. longa L., utilizada como colorante en alimentos y como especia. El contenido de materia colorante es alto así como el de aceites esenciales no volátiles, lo cual le da un gran valor comercial como colorante y saborizante en alimentos coincidiendo con lo señalado por Turmeric (1991) y Viasan et al. (1989). Pigmentos de la cúrcuma Cromatografía de capa fina La separación de los pigmentos contenidos en la cúrcuma se realizó por CCF según el método señalado por Janben (1984). Este autor señaló que la mezcla de cloroformo: ácido acético en una proporción 90:10 como la que produjo una mejor separación de los componentes pigmentantes; por lo que en las determinaciones sólo se utilizó esta mezcla en las mismas proporciones. En la Figura 1 se observa el cromatograma obtenido. En este cromatograma se aprecian los tres componentes pigmentantes. Donde la curcumina (I) presenta un valor de Rf de 0,92; la desmetoxicurcumina (II), de Rf de 0,82 y la bisdesmetoxicurcumina (III) de 0,81; lo cual coincide con los resultados obtenidos por Janben (1984) para la cúrcuma. Los tres curcuminoides son separados y a diferencia de lo señalado por Janben (1984) el color amarillo claro inicial pasan a un amarillo oscuro y permanecen así por largo tiempo. Al agregar la solución de ácido bórico al cromatograma los curcuminoides muestran una coloración rojo - naranja característica de la rosocianina y rubrocurcumina producida por estos compuestos. La rubrocurcumina es producida por la curcumina debido al color rojo intenso presentado y la rosocianina es producida por la desmetoxicurcumina y bisdesmetoxicurcumina debido al color naranja producido. Esta coloración también permanece por largo tiempo. Espectros de Absorción Para la determinación de la absorbancia máxima de los componentes pigmentantes, se realizó una curva de absorbancia en el rango visible a la mezcla de pigmentos curcuminoides y a los componentes separados por CCF obteniéndose los resultados que se muestran en la Figura 2. Se observa que los tres curcuminoides presentaron una absorbancia máxima entre 426 nm y 430 nm; alcanzando la mezcla un máximo a 428 nm; donde dos de los pigmentos desmetoxicurcumina y bisdesmetoxicurcumina arrojaron un máximo de absorbancia a la misma longitud de onda (426 nm).
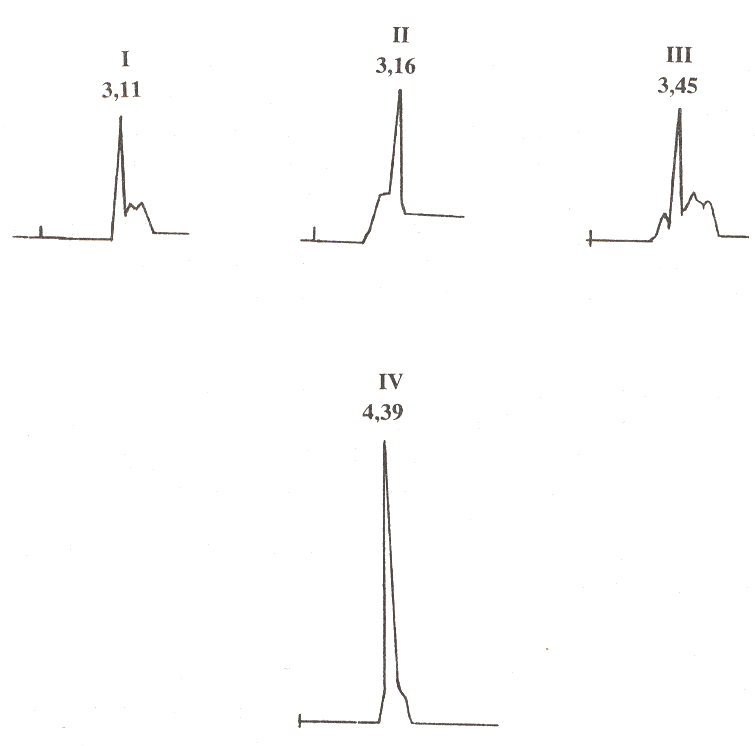
Cromatografía Líquida de Alta Presión (CLAP) Otra separación realizada en los pigmentos contenidos en la cúrcuma fue utilizando la técnica de CLAP. Los pigmentos fueron separados por CCF y redisuelto tanto en la mezcla utilizada en la separación (cloroformo: ácido acético), como en metanol. Los pigmentos y la mezcla de estos fueron inyectados en el cromatógrafo usando primeramente una mezcla de tetrahidrofurano (THF): agua en forma de gradiente y midiendo la absorbancia a 405 nm, como se observa en la Figura 3, donde I corresponde al cromatograma adquirido al inyectar la curcumina alcanzándose un pico a un tiempo de retención de 3,11 min.; II es el obtenido al inyectar la desmetoxicurcumina, con un tiempo de retención de 3,16 min. y III es el logrado al inyectar la bisdesmetoxicurcumina, con un tiempo de retención de 3,45 min. y 4,39 min. para la mezcla de pigmentos. Se trató de obtener una mejor separación de los curcuminoides utilizando otro tipo de columnas y fase móvil, arrojando resultados insatisfactorios. Con una columna C8 y usando como fase móvil metanol: agua en diferentes proporciones isocráticamente y a una absorbancia de 425 nm se obtuvo un solo pico al inyectar la mezcla de pigmentos; los mismos resultados fueron logrados al cambiar la fase móvil por THF: agua en diferentes proporciones. También se variaron las velocidades de flujo así como la presión de la fase móvil obteniéndose los mismos resultados. Influyendo enormemente los solventes utilizados en la extracción, presentando al mismo tiempo de retención de los pigmentos al separar picos negativos en los cromatogramas. Se trató de disminuir o eliminar estos picos cambiando los solventes de extracción o haciendo diluciones con la fase móvil a utilizar, sin ningún resultado positivo debido a que el pico se hizo menos intenso no pudiéndose detectar. En la extracción de la muestra con THF: agua 50:50 recomendada por Rouseff (1988) se obtuvo una solución muy turbia la cual no se inyectó al cromatógrafo por interferir en la detección en el rango visible.
Comparación de la C. longa L., nacional con otras importadas A fin de comparar la calidad de la cúrcuma cosechada en el estado Portuguesa con otras importadas, se recolectaron muestras de las importadas de la India y de Colombia. A estas se les realizaron análisis de humedad, contenido de pigmento expresado como curcumina, y contenido de aceites esenciales. La Cuadro 2 muestra los resultados; sin embargo, el tipo de procesamiento realizado a las muestras importadas se desconoce.
De los resultados logrados se observa que el contenido de humedad de la muestra nacional es menor que las muestras importadas, no obstante, el contenido de pigmento es mucho mayor que las procedentes del extranjero, aunque el color de las tres muestras es muy parecido, como se observa en la Figura 4. Al realizarles CCF es notorio que las tres muestras presentan el mismo cromatograma, con una separación de los componentes pigmentantes muy nítida. Con respecto al contenido de aceites esenciales se observa que la muestra nacional presenta el mayor contenido de estos y el menor valor lo muestra el material proveniente de la India. Comparando la cúrcuma nacional producida en el estado Portuguesa con respecto a los productos de la India y Colombia; la nacional presentó un menor contenido de humedad (9,77%) que las muestras importadas (India 11,18%, Colombia 11,47%) y mayor contenido de aceites esenciales (11,68%, India 6,17%, Colombia 9,96%) y materia colorante (3,18%, India 1,85%, Colombia 1,99%), lo cual es muy ventajoso como pigmentante y saborizante en formulaciones de productos alimenticios. La CCF de un extracto de pigmento presentó los mismos resultados para las tres muestras.
BIBLIOGRAFÍAAMERICAN SPICE TRADE ASSOCIATION: Official Analitycal Methods (ASTA). 1960. Fisher H. J. y Hart F. (1971). Análisis Moderno de Alimentos. Ed. Acribia. España. Cap 15. p. 403-407. EMALDI, U. 1988. Evaluación de las propiedades reológicas del almidón de tres especies de Amaranto (Amaranthus hypochondriacus L, A. cruentus L. y A. cruentus x A. ensiformis) y tres cultivares de Canavalia ensiformis (DC). Tesis de grado. Maracay. Universidad Central de Venezuela. Facultad de Ciencias. Instituto de Ciencia y Tecnología de Alimentos. p. 64. GOVINDARAJAN, V. S. 1980. Turmeric, Chemistry, Technology and Quality CRC Critical Reviews in Food Science and Nutrition 12(3):199-301. JANBEN, A/TH. GOLE. 1984. Thin-Layer Chromatographic determination of Curmine (Turmeric) in Spices. Chromatographia 18(10):546-549. KARASZ, A. B., F. DE COCCO and L. BOKUS. 1973. Detecion of Turmeric in foods by Rapid Florometric Method and by Improved Spot Test. J.A.O.A.C. 56(3):626-628. KRISHNAMURTHY, M. N., R. PADMABAI, C. P. NATARAJAN and S. KUPPUSWAMY. 1975. Colour Content of Turmeric Varieties and Studies on its Processing. J. Fd. Sci. Technol 12:12-14. MANJUNATH, M. N., V. D. SATTIGERI and K. V. NAGARAJA. 1989. Curcumina in Turmeric. Indian Spices. p. 9-12. MONTALBO, A. 1972. Cultivo de Raíces y Tuberculos Tropicales. Lima-Perú. Interamericana de Ciencias Agrícolas de la OEA. p. 257-258. RAGHUVEER, K. G. and V. S. GOVINDARAJAN. 1979. Detection of Admixtures of turmeric, Curcuma longa Linn with Curcuma aromática Salibs. by Thin Layer and Gas-Liquid Chromatography. J A.O.A.C. 62(6):1 333-1 337. ROUSEFF, R. R. 1988. High Performance Liquid Chromatographic Separation and Spectral Characterization of the Pigments in Turmeric and Annatto. J. Fd. Sci. 53(6):1 823-1 826. SAMPATHU, S. R., N. KRISNAMURTHY, H. B. SOWBHAGYA and M. L. HANKARANARAYANA. 1988. Studies on Quality of Turmeric (Curcuma longa) in Relation to Curing Methods. J. Fd. Sci. Technol. 25(3):152-155. SCHNEE, L. 1984. Plantas Comúnes de Venezuela. Ediciones de la Biblioteca: Colección Ciencias Biológicas. VIII U.C.V. p. 256-257. SEN A. R., P. S. GUPTA and N. G. DASTIDAR. 1974. Detection of Curcuma zedoaria and Curcuma aromática in Curcuma longa (Turmeric) by Thin-layer Chromatography. Analyst. 99:153-155. SMITH R. M. and B. A. WITOWSKA. 1984. Comparison of Detectors for the Determination of Curcumin in Turmeric by High-performance Liquid Chromatography. Analys (109):259-261. TURMERIC. 1991. Indian Spices. 28(4):23. VIASAN, V. A., A. NIMALA, J. M. RAO, C. S. NARAYANAN and A. G. MATHEW. 1989. Chemical Analysis of Some Cultivars of Cúrcuma (1988). J. Fd. Sci. Technol. 26(5):293-295. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||