|
Veterinaria Tropical. 1: 15-40. 1976 DIAGNOSTICO SEROLÓGICO DE LA TRIPANOSOMIASIS
BOVINA USANDO MANUEL TORO E.* *Instituto de Investigaciones
Veterinarias |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
INTRODUCCIÓN KILLICK-KENDRICK (20) revisó los varios métodos disponibles para el diagnóstico de la tripanosomiasis del ganado y señaló que cada uno tiene sus usos especiales y limitaciones particulares. Las preparaciones al fresco ( frotis directo) son una forma simple, rápida y útil cuando se requiere examinar un gran número de animales pero no detectan infecciones leves y/o sublatentes y, además, las especies de Trypanosoma no pueden ser identificadas. Los extendidos de sangre teñidos por cualesquiera de los métodos de coloración de uso corriente, son ineficientes como métodos aunque son esenciales para la identificación de las especies. El examen de gotas gruesas teñidas ha demostrado ser más efectivo en la detección de infecciones por tripanosoma que los métodos señalados anteriormente debido a que se investiga una mayor cantidad de sangre (21). Algunos investigadores (1,12,18,28,37) han demostrado que el T. vivax puede ser hallado en el jugo linfático obtenido por punción; pero ADAMS ( 1 ) trabajando en bovinos con cepas acíclicas de T. vivax, en la isla Mauricio, encontró que esto sólo es factible durante la primera semana de la infección. DÍAZ-UNGRÍA y MALDONADO (10,11) examinaron bovinos usando frotis frescos y punción ganglionar, en el Estado Zulia, y llegaron a la conclusión de que el fluido ganglionar es siempre fuertemente positivo en animales infectados en forma natural; en tanto que, la sangre es frecuentemente negativa y encontraron que del total de diagnósticos hechos por punción ganglionar ninguno fue positivo en sangre solamente. STEPHEN (34) opinó que la punción ganglionar es de dudoso valor en los animales domésticos, aun cuando algunos investigadores han reportado el hallazgo de tripanosomas en el fluido ganglionar siendo la sangre negativa y no obstante su utilidad en las infecciones por T. gambiense en humanos. La inoculación de animales susceptibles es un método diagnóstico de utilidad en algunas infecciones tripanosómicas. (T. evansi, T. brucei), pero el T. vivax, sólo produce infecciones transitorias ocasionales en roedores y este método carece de valor ya que los únicos hospedadores apropiados son bovinos, ovinos y caprinos. A pesar de que el T. vivax ha sido adaptado en conejos (36) y en ratas (9,19) mediante la utilización de suero ovino normal como suplemento, esta técnica es difícil de efectuar como trabajo rutinario de diagnóstico ya que las infecciones iniciales son prácticamente indetectables. El cultivo "In Vitro" considerado el mejor método en la especie no patógena de los bovinos T. theileri, no es efectivo para diagnosticar la presencia de especies patógenas del ganado aunque WEIMANN (39) ha demostrado que es de valor en la tripanosomiasis causada por T. gambiense y T. rhodesiense. Se ha constatado que el T. vivax puede crecer en cultivos celulares de Glossina (35) pero éste no es un método práctico de diagnóstico y sólo es aplicable a las especies africanas que muestran afinidad por estos insectos. LANHAM y GODFREY (23, 24) trabajando en la filtración de varias especies de tripanosomas del grupo salivaria a través de columnas de dietil-aminoetil-celulosa tipo DE-52, mostraron que los triponosomas pueden ser aislados de la sangre de animales con infecciones inaparentes y este método podría tener un valor diagnóstico potencial. Este método es bastante complejo, dependiendo de la viabilidad de los tripanosomas, por lo cual, su uso práctico es limitado. Hasta la fecha, el examen microscópico de gotas gruesas de sangre parece ser el método más efectivo de diagnóstico de la tripanosomiasis de los bovinos causada por el T. vivax. ROBSON y GILLETTE (30) en una encuesta a gran escala sobre tripanosomiasis bovina en Kenya, encontraron que la gota fresa fue el mejor método diagnóstico en comparación con otros métodos directos. A pesar de esto, también la gota gruesa puede dar resultados negativos en animales infectados debido a la escasez o ausencia de parásitos en los intervalos de los oleajes parasitarios. Como resultado de los inconvenientes que presentan los métodos parasicológicos, se ha intentado aplicar varios métodos serológicos. La prueba de Fijación de Complemento (Fc.) constituye un excelente medio de diagnóstico de la tripanosomiasis de los equinos causada por el T .equiperdium y fue utilizada con éxito en el control de la durina de los caballos en el Canadá (38) .Esta prueba es la reacción serológica de más amplia utilización en el diagnóstico de los casos crónicos de la enfermedad de Chagras y tiene una efectividad del 90% (26). Se ha demostrado que la prueba de Hemaglutinación Pasiva (HA) es altamente sensible y relativamente fácil de realizar. GILL (15,16) modificó el método de BOyDEN (3) y usando eritrocitos ovinos tanizados recubiertos de antígeno soluble proveniente de tripanosomas desintegrados, logró detectar altos títulos de anticuerpos en el suero de conejos infectados en forma experimental con T. evansi. CLARKSON, COTTRELL y ENAYAT (6) aplicaron esta prueba en el diagnóstico de infecciones tanto experimentales como naturales de T. vivax en ovejas y encontraron que el método fue extremadamente sensible aunque deben introducirse controles adecuados para detectar las reacciones inespecíficas. SADUM y col. (32), mediante una modificación de la técnica de FIFE y MUSCHEL (14) para el serodiagnóstico de la enfermedad de Chagas, demostraron que la prueba Indirecta de Anticuerpos Fluorescentes (AF) era de utilidad en el diagnóstico de las infecciones por tripanosomas y detectaron anticuerpos en el suero de personas infectadas en forma natural con T. cruzi y T. rhodesiense, KIMBER (22) modificó la técnica de SADUM y col. usando T. rhodesiense como antígeno y logró detectar altos títulos. La recolección de muestras en condiciones de campo se simplificó cuando se demostró que la sangre absorbida en papel filtro podía servir como fuente de suero utilizable en la prueba. WILSON (42) probó sueros bovinos recolectados a nivel de campo en Uganda Oriental y llegó a la conclusión de que la prueba de Inmunofluorescencia Indirecta (AF) es de valor en la detección de casos crónicos y que la sangre absorbida en papel filtro podía ser usada en muestreos rápidos para determinar la prevalencia de la enfermedad. WELLS, BETANCOURT y PAGE (40) realizaron estudios sobre la epizootología de la tripanosomiasis bovina en Colombia y opinaron que la técnica indirecta de inmunofluorescencia podría contribuir a dilucidar algunos de los actuales problemas del diagnóstico y ser una ayuda en la investigación. RISTIC (29) desarrolló un método simple para
detectar portadores de Anaplasma por medio de una prueba
de aglutinación en tubo capilar (CA) usando una suspensión de cuerpos
iniciales del parásito como antígeno. La prueba ha sido usada para
determinar la prevalencia de portadores en varios países ( 4, 27, 33) y
aplicada a otros hemoparásitos mediante el uso de antígenos
específicos (25). Ross (31) aplicó la técnica de RISTIC en la
tripanosomiasis para detectar anticuerpos en los sueros de personas y
bovinos infectados. Los antígenos fueron preparados con tripanosomas (T.
brucei y T. rhodesiense ) obtenidos por
centrifugación y desintegrados por oscilación sónica. Los antígenos
no reaccionaron frente a 171 sueros controles negativos, en tanto que,
obtuvo reacciones positivas en 130 sueros de humanos y bovinos
infectados. Los antígenos se utilizaron para detectar anticuerpos en 69
bovinos con infecciones mixtas experimentales y naturales por T.
brucei, T. congolense y T. vivax,
resultando todos los sueros positivos. En un becerro infectado con T.
vivax (experimental) , los anticuerpos se detectaron, por primera vez,
20 días después de la infección y se observó un título máximo de
5. La prueba pareció ser específica, no observándose reacciones
cruzadas con otras hemoparasitosis humanas o bovinas, excepto en la
theilerosis, en la cual, una reacción débil fue eliminada al ser
diluido el suero. El propósito del presente trabajo fue preparar un antígeno para tubos capilares semejantes al descrito por Ross (31) utilizando tripanosomas de la especie T. vivax y probar este antígeno con una gran cantidad de sueros provenientes de bovinos, ovinos y caprinos infectados en forma natural o experimental con diferentes cepas de T. vivax para determinar su sensibilidad y efectividad en el diagnóstico de la tripanosomiasis; seguir el curso de infecciones experimentales con T. vivax para determinar el tiempo de aparición, duración y variación de los niveles de anticuerpos durante el curso de la infección; comparar los resultados de la prueba CA con los obtenidos mediante otros métodos a fin de conocer la validez de la prueba como instrumento diagnóstico y, finalmente, indagar la posibilidad de reacciones cruzadas con otras especies de tripanosomas, en particular, la especie no patógena de los bovinos T. theileri.
1. Animales experimentales Para el mantenimiento de los tripanosomas, se utilizaron ratones blancos cepa Laca (Fisons Pharmaceutical Ltd., Crewe, Cheschire) con peso entre 20 y 25 g. que fueron alojados en jaulas plásticas pequeñas con rejilla galvanizada y alimentados con Oxoid 418 yagua ad libitum. Para la obtención de gran número de tripanosomas necesarios para la producción de antígeno, se utilizaron ratas blancas Wistars, criadas en la Escuela de Medicina Tropical de Liverpool y con peso entre 150 y 200 g. Se alojaron en jaulas plásticas grandes con rejilla galvanizada recibieron una dieta similar a la de los ratones y se infectaron mediante la inoculación intraperitoneal de 1,0 ml. de sangre altamente positiva a T. vivax (aproximadamente 107 tripanosoma). Al momento de máxima parasitemia, fueron sangradas en "blanco" bajo anestesia por cloroformo. 2. Cepa de Tripanosoma Para producir el antígeno. se utilizó una cepa de T. vivax (ver figura I) denominada "Swain" ( 19) la cual, se aisló originalmente en Nigeria y ha sido mantenida en rumiantes mediante transmisión cíclica por Glossina morsitans en Liverpool. La cepa se adaptó en ratas inoculando gran cantidad de tripanosomas y dando suero ovino normal como suplemento. La parasitemia fue muy baja durante los primeros 20 pasajes pero, luego, el tripanosoma se hizo más virulento y, actualmente, tiene más de 150 pasajes en ratas, no requiere suero ovino como suplemento, no es infectarte para G. morsitans y su morfología es la típica del T. vivax (CLARKSON, comunicación personal) La cepa se mantuvo congelada a -196°C en nitrógeno líquido y, cuando se requirió, la sangre se descongeló a temperatura ambiente, se constató la motilidad de los tripanosomas mediante examen microscópico e, inmediatamente, se inoculó en ratones .En 2 ó 3 días, se obtuvieron infecciones masivas.
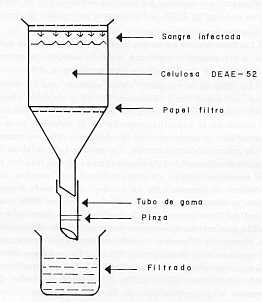
3. Muestras de suero. Los sueros se obtuvieron de diversas fuentes y se almacenaron a -20°C hasta que fueron requeridos para la prueba. Un grupo de 129 muestras provenían de ovejas y becerros infectados en forma experimental con diferentes cepas de T. vivax (Desowitz, Africana Occidental, Suramericana). La cepa Desowitz es una cepa de T. vivax adaptada a ratas (9) obtenida del Instituto Lister, Londres, en 1953. Un solo tripanosoma se inoculó en un ratón y, luego, se hicieron pasajes. La sangre infectada se congeló y guardó en nitrógeno líquido. La cepa no infecta a las moscas tse-tse. La cepa Africana Occidental (AO) se aisló de bovinos en Nigeria y ha sido mantenida por pasajes en ovejas y becerros en Liverpool. Es muy infectante para G. morsitans (7). La cepa Suramericana (SA) se aisló en bovinos de Colombia en 1969 y ha sido pasada regularmente por ovejas en Liverpool. Produce una parasitemia crónica y no infecta G. morsitans (19). Un segundo grupo de sueros (88) se obtuvo del Instituto Nigeriano para Investigación de la Tripanosomiasis (Nigerian Institute for Trypanosomiasis Research, N.I.T.R.) y de la Organización para Investigación de la Tripanosomiasis de Africa Oriental (East African Trypanosomiasis Research Organization, E.A.T .R.O. ) .Estos sueros habían sido recolectados durante el curso de infecciones experimentales por diferentes especies de tripanosomas en bovinos. 250 muestras adicionales fueron traidas de Venezuela por el doctor Clarkson y consistían de sueros de bovinos, ovinos y caprinos recolectados en fincas ganaderas del Estado Zulia; sueros de cabras, ovejas y becerros infectados en forma experimental con T. vivax en la Facultad de Ciencias Veterinarias de la Universidad del Zulia (F.C V. , L .U. Z .) en Maracaibo y 127 sueros recolectados durante una encuesta sobre anaplasmosis realizada en 6 zonas del país por personal del Centro de Investigaciones Veterinarias (C.I.V., M.A.C. ), Maracay. Cuando se requirió, los sueros fueron descongelados a temperatura ambiente y se inactivaron a 56°C durante 30 minutos en "Baño de María". 4 .Filtración de los Tripanosomas para producir antígeno. Los tripanosomas se separaron de acuerdo a la técnica descrita por LANHAM (23) y LANHAM-GODFREY (24 ). Este método se basa en que la carga eléctrica superficial de la mayoría de las especies de tripanosomas es menos negativa que la de las células sanguíneas en un pH que oscile entre 6 y 9, de manera que, estas últimas son completamente absorbidas cuando la sangre pasa a través de una columna intercambiadora de iones, en tanto que, los tripanosomas atraviesan libremente la columna junto con el plasma. La dietil-amino-etil-celulosa (tipo DE52, Watmon Chromedia) se equilibró con solución salina fosfatada glucosa buffer (PSG) pH 8,0 en una relación de 100 g. de celulosa para 1 litro de buffer y el pH se ajustó a 8,0 con ácido ortofosfórico al 5% .Se dejó sedimentar y el sobrenadante se descartó por succión. La celulosa sedimentada se re suspendió y lavó 4 veces con buffer PSG y, finalmente, se verificó y corrigió el pH, si fue necesario, antes de usarla. La filtración de la sangre y la equilibración de la columna se efectuaron a temperatura ambiente, pero la sangre no procesada, el filtrado y la celulosa equilibrada se mantuvieron a 4°C . La celulosa se compactó en un embudo tipo Buchner colocando en el fondo un papel filtro Whatman N° 41 y dejando correr el fluido excedente hasta obtener la compactación deseada. Un pedacito de papel filtro se colocó en la superficie superior de la columna para evitar su ruptura y se añadió la sangre diluida. En la figura N° 2, se muestra la disposición de la columna de separación. La cantidad de celulosa utilizada fue proporcional a la cantidad de sangre filtrada en una relación de 100 a 25 ( 4:1 ). La sangre se obtuvo de ratas infectadas al máximo de parasitemia, se recolectó un promedio de 10 ml. por rata usando heparina (10 u.i./ml.) como anticoagulante, se diluyó 1: 3 con buffer PSG y se filtró. La velocidad del flujo fue controlada mediante una pinza colocada en el tubo de salida y se mantuvo constante por medio de la adición continua de buffer . Se detuvo la filtración cuando se observaron muy pocos tripanosomas al examen microscópico del filtrado. La celulosa utilizada se regeneró lavado con solución salina (NaCl 0,3M) y tratando con soluciones de ácido clorhídrico (HCI 0,5N) e hidróxido de sodio (NaOH 0,5N) de acuerdo a las instrucciones de la casa fabricante. 5. Preparación del antígeno de Aglutinación Capilar. El filtrado se concentró por centrifugación a 10.000 g. durante 10 minutos a 4°C (Centrífuga M SE, High Speed 18, cabezal 8 x 50 ml.) y los tripanosomas se lavaron 2 veces con solución PSG buffer pH 8,0 a fin de eliminar las proteínas del plasma Después del último lavado, se descartó el sobrenadante y el taco de tripanosomas se guardó a -20°C . El siguiente día se descongeló, resuspendió en 50 ml. de PSG buffer y homogenizó en un triturador de tejidos, los tripanosomas se desintegraron mediante un tratamiento en un oscilador sónico (Ultrasonicador M SE, 20 Kcs. 100 watts.) a 1,54 amps. durante 5 minutos y el material se centrifugó a 70.000 g. durante 30 minutos a 4°C (Supercentrífuga M SE 65, rotor 8x50 ml.). Se descartó el sobrenadante y el taco se resuspendió en 50 ml.de solución salina fosfatada buffer (PBS) pH 7,2, se homogenizó y se repitió la centrifugación .El taco final se re suspendió y homogenizó en 3-5 veces su volumen en solución salina buffer de veronal (VES) pH 7,2 .Los detritos y partículas grandes se eliminaron por centrifugación a baja velocidad ( aproximadamente 1.000 g. ) durante 10 segundos y se añadió formalina como preservativo a una concentración final de 0,2% El antígeno se guardó en refrigeración
6. Realización de la prueba. Se utilizaron tubos capilares que medían 75 x 1 mm. Se permitió que tanto los sueros como el antígeno alcanzaran la temperatura ambiente después de ser removidos de su lugar de almacenamiento y el antígeno se agitó y mezcló bien antes de usar. El tubo capilar se llenó hasta aproximadamente un tercio de su longitud con el antígeno y se completó de llenar por capilaridad con el suero problema. Los tubos capilares llenos se invirtieron sobre plastilina en un portatubos especial, en posición vertical, la parte superior se selló para evitar la evaporación y se dejaron a temperatura ambiente durante 18 a 24 horas. Las reacciones positivas aparecieron como agregados macroscópicos claramente visibles a simple vista, en tanto que, en sueros conocidos negativos no se presentaron estos agregados Los grados de aglutinación se clasificaron como 3 + , 2 + , 1+ ,±, de acuerdo a la intensidad de la reacción, tamaño y número de los grumos, a las 24 horas. Los tres primeros grados fueron considerados como positivos, en tanto que, el último se dio como negativo ( figura N° 3) .Se tuvo especial cuidado en no permitir la entrada de burbujas de aire o partículas materiales ( es deseable un suero limpio y claro) en los tubos capilares ya que interfieren en la reacción al no permitir que los reactivos se mezclen adecuadamente. Cada vez que se realizó la prueba, se utilizaron sueros conocidos (positivo y negativo) para controlar la efectividad y estabilidad del antígeno) . RESULTADOS Se prepararon 2 lotes de antígeno con tripanosomas filtrados usando la cepa "Swain" del T. vivax en ratas y se obtuvo un total de 9,0 ml. de antígeno Capilar-aglutinante (CA). Se procesó un total de 200 ml. de sangre infectada y se necesito aproximadamente 20 ml. para producir cada ml. de antígeno. Se obtuvo un promedio de 80 pruebas por cada ml. de antígeno.
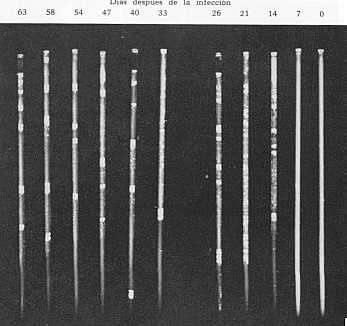
Se realizaron los siguientes estudios: 1. Prueba de Calidad. Se hicieron pruebas preliminares para determinar la especificidad, sensibilidad y actividad del antígeno de aglutinación capilar ( CA ). N° se observó autoaglutinación cuando el antígeno se probó en tubos capilares frente a soluciones salinas fosfatadas (PBS) o salina buffer de veronal (VES), en un lapso de 24 horas. La especificidad se determinó probando el antígeno frente a sueros pre y post-infección obtenidos de un becerro infectado (N° 759), inoculado con la cepa africana de T. vivax. En el suero pre-infección (SO) se observó una completa ausencia de reacción aglutinante. en tanto que, en el suero post-infección S62 se notó una reacción fuerte de aglutinación que se inició aproximadamente a los 10 minutos de montada la prueba y permaneció estable por más de 24 horas. Estas muestras se reservaron como sueros controles, negativo y positivo, y se usaron para controlar la estabilidad y efectividad del antígeno cada vez que se realizó la prueba. Se hicieron diluciones dobles del antígeno ( 1: 2, 1: 4, 1: 8) que se probaron contra el suero positivo no diluido. observándose reacciones de aglutinación hasta la segunda dilución solamente. No se observaron reacciones cuando se probaron 20 sueros provenientes de bovinos infectados con T. theileri. En 18 sueros bovinos infectados con T. congolense se notó una reacción débil de intensividad variable ( 1 + ). 2 .Pruebas preliminares con sueros de Infecciones Experimentales en Liverpool. Los sueros de bovinos y ovinos infectados en forma experimental con varias cepas de T. vivax, se utilizaron para las pruebas preliminares del antígeno (becerro N° 379 y oveja N° 42, inoculados con cepa Suramericana; becerro N° 11 y ovejas N° 19 y N° 50, inoculados con cepa Desowitz; becerro N° 759, inoculado con cepa Africana). Se probaron sueros tomados antes y, luego semanalmente después de la infección. Todos los sueros preinfección dieron reacciones negativas. Los anticuerpos se detectaron entre los 8 y 15 días y persistieron durante todo el curso de la infección. En la figura N° 4, se muestran las reacciones de aglutinación del becerro N° 379. El cuadro N° 1, muestra los resultados obtenidos en este grupo de animales. Se realizó la titulación de los sueros de los becerros 379 y 759. En ambos animales, los anticuerpos aparecieron en la segunda semana de la infección y alcanzaron un título máximo de 40 (Figuras 5 y 6) .
En los sueros de 13 bovinos y ovinos infectados en forma experimental con T. vivax (cepa Suramericana, Africana y Desowitz), los resultados obtenidos fueron similares a los del primer grupo de animales estudiados. Todos los sueros pre-infección fueron negativos, los anticuerpos se detectaron por vez primera entre los 7 y 14 días y persistieron durante toda la infección. En 2 animales (oveja N° 51 y becerro N° 12), se observaron reacciones débiles de aglutinación hasta el día 32, a partir del cual, se obtuvo una reacción positiva ( 1+) .Estos animales, infectados con las cepas Suramericana y Desowitz respectivamente, eran muy jóvenes, presentaron parasitemias intensas y el becerro murió. En el Cuadro 2, se muestran los resultados obtenidos en este grupo de animales. 3. Pruebas en anima7es infectados experimentalmente en África y Venezuela. Se probó un grupo de sueros provenientes de 6 bovinos que habían sido infectados con tripanosomas transmitidos por moscas tse-tse cazadas a campo, en África y re-expuestos a la infección hasta 3 veces a intervalos mensuales. Todos eran sospechosos de albergar infecciones mixtas por T. brucei, T. congolense y T. vivax. Otros 3 bovinos habían sido infectados con T. vivax mediante moscas tse-tse. Tres animales se habían mantenido como controles no infectados durante el experimento. Los sueros de estos animales se recolectaron antes y, luego, mensualmente después de la infección. Un segundo grupo, traído por el Dr. Clarkson, comprendía los sueros de un becerro y 4 cabras que habían sido infectados en forma experimental con una cepa venezolana de T. vivax y un becerro infectado en forma natural. El becerro N° 1 y la cabra N° 3, en los cuales se aisló la cepa, se inocularon con sangre de campo y, luego, la cepa se pasó a las cabras 5,6 y 7. En este grupo de animales, todos los sueros controles fueron negativos, en tanto que, los sueros post-infección dieron reacciones positivas a través del curso de la infección. Los resultados se muestran en los cuadros N° 3 y N° 4.
4. Pruebas en animales de un muestreo a campo en Venezuela. Se probó un total de 237 sueros recolectados en el campo. De éstos, 110 provenían de 4 fincas ubicadas en el Estado Zulia, en las cuales, bovinos, ovinos y caprinos se examinaron mediante frotis fresco, gota gruesa y punción ganglionar. Se diagnosticó tripanosomiasis en 2 fincas. a) Muestras de fincas con diagnóstico confirmado por examen de sangre. La primera finca (A) era pequeña y se encontró un 5% de bovinos infectados. Se probaron 30 sueros por medio de la prueba de aglutinación capilar (CA) y 2 (6,6%) fueron positivos. En la segunda finca (E), con aproximadamente 2.000 cabezas bovinas, y 50 ovinas, la prevalencia de tripanosomiasis se estimó en un 15% en bovinos. Se examinaron 20 gotas gruesas de ovinos y no se observaron tripanosomas. De 41 sueros estudiados por aglutinación capilar, 15 (36,5%) dieron reacciones positivas ( detalles en Cuadro 5).
b) Muestras de fincas sin diagnóstico confirmado por el examen de sangre En otras 2 fincas, no se demostró la presencia de tripanosomas al examen directo. La finca C era muy pequeña y de 11 sueros probados, 1 (9,0% ) fue positivo. En la otra finca (D ), los bovinos eran tratados cada 6 meses con Antrycide Pro-Salt, y según su propietario, la tripanosomiasis no representaba un problema como lo había sido 5 años atrás. El examen de gotas gruesas en 30 bovinos, 15 ovinos y 15 caprinos no reveló tripanosomas. Se probaron 28 sueros por la prueba CA y 2 (7,1%), una cabra y una oveja, resultaron positivos, en tanto que, los bovinos fueron negativos (resultados en Cuadro 6) .
Se probaron 127 sueros adicionales que habían sido recolectados durante una encuesta sobre anaplasmosis en 6 zonas ganaderas del país, como un sondeo preliminar para determinar la prevalencia y distribución de la tripanosomiasis en Venezuela. En el Estado Bolívar, se observó un alto porcentaje de reactores (43,3%), en tanto que, en el Estado Lara se encontró el número más bajo (7,1%) de animales positivos. En el Cuadro 7, se dan los resultados del total de sueros provenientes de campo examinados por la prueba CA. De 237 muestras, 49 (20,6%) fueron positivas. DISCUSIÓN En vista de que los métodos utilizados para el diagnóstico de la tripanosomiasis, tanto en humanos como animales domésticos, fallan en la detección de los parásitos, se han hecho intentos para desarrollar métodos indirectos (20, 39). Los métodos serológicos deben ser capaces de detectar los anticuerpos tan pronto como éstos se producen y durante el tiempo que están presentes. En consecuencia, son independientes de la presencia de los tripanosomas en el momento en que se realiza el examen. Sin embargo, sus resultados deben interpretarse en base a la especificidad de la reacción y compararlos con los obtenidos por otros métodos. En la evaluación de la utilidad de un método serodiagnóstico, deben considerarse cierto número de factores relacionados con el antígeno, los anticuerpos y la especificidad de la prueba. El lento progreso de los estudios en la especie T. vivax, ha sido parcialmente superado con la adaptación de ésta en roedores y conejos (9,19, 36 ), lo que ha hecho posible la realización de estudios inmunológicos ( 5, 17) y el empleo de pruebas serológicas en el diagnóstico de la infección (6, 42). Un método serodiagnóstico debe ser simple, específico y rápido, siendo además deseable la estabilidad del antígeno y la reproducibilidad de la prueba. En el caso del T. vivax, se requiere también de aplicabilidad de la prueba a todas las cepas de este tripanosoma y la ausencia de reacciones cruzadas con otros agentes infectantes para los bovinos. Algunas pruebas serológicas han probado ser muy sensibles y efectivas en la detección de la infección, tanto experimental como natural, del T. vivax (6,42), pero requieren contar con las facilidades de un laboratorio bien equipado. La prueba de Aglutinación en Tubos Capilares (CA), desarrollada por RISTIC (29) para la anaplasmosis, ha sido usada por otros investigadores para detectar anticuerpos de Babesia bigemina en bovinos (25) y de tripanosomas en humanos y bovinos ( 31) . En la primera parte de este estudio, se probaron los sueros de bovinos, ovinos y caprinos infectados experimentalmente con varias cepas de T. vivax y se obtuvieron reacciones positivas de aglutinación en el 96,6% de los sueros de la post-infección (Cuadro 8). De 207 sueros probados, solamente 9 ( 4,4% ) fueron negativos. Todos los sueros de la pre-infección y sueros controles negativos obtenidos de animales no infectados dieron reacciones negativas. Cuatro ( 4) de las reacciones negativas de los sueros post-infección, se obtuvieron en animales muy jóvenes (becerro N° 12 y oveja N° 51), los cuales, no habían mostrado respuesta inmunitaria cuando se probaron por otros métodos serológicos (CLARKSON, comunicación personal). Sin embargo, se observó una reacción positiva a partir de los 32 días después de la infección. Otros cuatro sueros no dieron reacciones positivas en el lapso comprendido entre los 28 y 35 días después de la infección, a pesar de que, en fecha anterior y posterior eran positivos y sería necesario mayor investigación durante este período de la infección (becerros N° 11, 18, 379 y oveja N° 44) .En la oveja N° 50, infectada con la cepa Desowitz, se notó una reacción débil a los 168 días, probablemente debido, a una disminución de los niveles de anticuerpos ya que había sufrido auto-curación 80 días antes. Estos estudios preliminares, sugieren que el antígeno CA es sensible y efectivo en la detección de anticuerpos en los sueros de animales infectados, pero sería necesario hacer estudios adicionales para determinar su utilidad y aplicabilidad en condiciones de campo donde hay que considerar cierto número de factores diferentes. El antígeno CA no reaccionó en infecciones por T. theileri pero habría que investigar la existencia de reacciones cruzadas con otros hemoparásitos, tales como B. bigemina, B. argentina y Anaplasma marginale, muy comunes en los bovinos de Venezuela. El antígeno CA se utilizó para la titulación de los sueros, pero los títulos obtenidos no fueron tan altos como los que se pueden obtener por otras técnicas serológicas utilizadas en el diagnóstico de la tripanosomiasis. En la titulación de los sueros del becerro N° 379, infectado con la cepa Suramericana del T. vivax, (Figura 1) y el becerro N° 759,infectados con la cepa Africana (Figura 6), se observo un titulo máximo de 40 en ambos animales. En previos estudios, los mismo sueros del becerro N° 759 se habían titulado por medio de la prueba de Hemaglutinación pasiva (HA), obteniéndose un titulo de hasta 168 en los sueros bovinos de Uganda, utilizando la técnica de inmunoflurecencia indirecta (AF). En comparación con la aglutinación capilar, tanto la prueba Ha como la AF parecen ser más sensibles. Sin embargo, debido a su simplicidad de tripanosomas en un rebaño de una forma rápida y eficiente.
En la segunda parte de este estudio, se probaron muestras de suero recolectadas
en el campo (Venezuela ). en cuatro fincas del estado Zulia, se
observaron reacciones positivas cuando los sueros se probaron por
medio de la aglutinación capilar (Cuadros 5,6,y 9), a pesar de que en
algunas no se pudo demostrar la presencia de tripanosomas por medio de
métodos directos. De 110 sueros probados por medio de la prueba CA,
20 (18,1%) fueron positivos, en tanto que, de 441 gotas gruesas
examinadas, 32 (7,27% ) resultaron positivas (Cuadro 9). Los sueros de
dos grupos de ovejas y cabras recolectados en 2 fincas diferentes
habían sido previamente probados mediante la prueba HA (13). En
una de las fincas (D), donde los bovinos eran tratados con Antrycide-Prosalt,
9 de 15 muestras mostraron títulos de 20 y una dio título de 40 (
cabra 75) .Se consideraron todas negativas, excepto la cabra N° 75 ya
que frecuentemente se había visto que los sueros normales conocidos
daban resultados positivos a esta dilución. Todos estos sueros dieron
reacciones negativas cuando se probaron mediante la aglutinación
capilar, excepto la cabra 75, la cual, fue positiva indicando
concordancia entre las dos pruebas En otra finca (B), donde un 15% de
los bovinos estaban infectados con T. vivax, todos los
sueros ovinos habían sido positivos en la prueba HA con títulos
mayores que los del primer grupo y todos se consideraron como
probablemente infectados, a pesar de que no se vieron tripanosomas en el
examen de sangre (3 ). En los sueros de estos animales, al ser exa-ovejas
102, 103 y 104 con títulos de 20 fueron negativas. La comparación de
los resultados obtenidos en dos diferentes métodos serológicos
utilizando al mismo grupo de sueros, sugiere una positiva correlación
entre ambas pruebas para detectar anticuerpos de tripanosomas y entre
los títulos HA y los reactores positivos CA.
Se probaron muestras adicionales de campo y se encontró un porcentaje relativamente alto de reactores (Cuadro 7). Estos sueros se recolectaron originalmente durante una encuesta sobre Anaplasmosis y no se disponía de información sobre la presencia de tripanosomas en base a métodos directos de diagnóstico. Sería necesario estudios más exhaustivos sobre la epidemiología de la tripanosomiasis bovina en Venezuela, en vista de que, los resultados de esta pequeña encuesta utilizando antígeno CA de T. vivax son bastante significativos. Los resultados serológicos no son nunca la conclusión final y el diagnóstico definitivo de la tripanosomiasis depende, en última instancia, del hallazgo de los parásitos mediante métodos directos de examen. Sin embargo, a la luz de los resultados obtenidos en este estudio, la prueba CA se presenta como una técnica sencilla que podría ser útil en estudios sobre la epizootología de la tripanosomiasis en Venezuela y suplementar los métodos convencionales de diagnóstico. RESUMEN Se preparó un antígeno para aglutinación en tubos capilares (CA) de acuerdo a la técnica descrita por Ross utilizando tripanosomas de la cepa "Swain" de T. vivax, reproducidos en ratas y filtrados a través de columnas de celulosa. Se probaron 263 sueros de bovinos, ovinos y caprinos infectados experimentalmente con varias cepas de T. vivax y se obtuvo un 95,6% de reacciones positivas en sueros post-infección, en tanto que todos los sueros pre-infección y controles fueron negativos. En 237 sueros recolectados en el campo (Venezuela ) y provenientes de bovinos, ovinos y caprinos, se encontró un 20.6% de reactores. al ser examinados. El antígeno CA demostró ser sensible para la detección de anticuerpos en infecciones experimentales por T. vivax en bovinos. ovinos y caprinos y no mostró reacción cruzada con T. theileri. Se sugiere que la prueba CA podría ser útil para el diagnóstico de infecciones por T. vivax y una ayuda en estudios epizootológicos y trabajos de campo. SUMMARY A capillary-tube aglutinating antigen ( CA ) like the one described by Ross wass prepared with the T. vivax Swain strain, produced in rats and filtered through cellulose colum. Two hundred and sixty three serum samples from cattle, sheep and goats experimentaIly infected with various strains of T. vivax were tested and 95,6% were positive in post-infection sera while the pre-infection and control sera were aIl negative. Two hundred and thirty seven serum samples from cattle, sheep and goats collected in the field (Venezuela) were examined and 20,6% were positive. The CA antigen was sensitive in the detection of antibody against T. vivax experimental infections in cattle, sheep and goats and showed no cross reaction with T. theiIeri. It is suggested that the CA test could be usefuIl for the diagnosis of T. vivax and an aid in epidemiological studies and survey work. BIBLIOGRAFÍA 1 .ADAMS, A. R .D .Trypanosomiasis of stock in mauritius, III : The diagnosis and course of untreated Trypanosoma vivax infections in domestic animals. Ann . Trop. M..d. Parasit. 30, 521-531. (1936) . 2. BAILEY, N. M., CUNNINGHAM, M. and KIMBER, C. D. The indirect fluorescent antibody technique applied to dried blood for use as a screening test in the diagnosis of human trypanosomiasis in Africa. Trans, R .Soc. Trop. Med . Hyg. 61,696-700. (1967). 3. BOYDEN, S. Y. The absorption of proteins on erythrocytes treated with tannic acid and subsequent haemaglutination by antiprotein sera. J. Exp. Med. 93, 107. (1951). 4. CASTILLO, A.
C. Survey of bovine anaplasmosis by means of capil1ary-tube aglutination
test in three geographic regions of Peru. Proc. 5th. National
Anaplasmosis Conference StiI1water Oklohoma. ( 1968) . 6. CLARKSON, M. J. COTTRELL, B. A. and ENAYAT, M. S. The indirect haemagglutination test in the study od Trypanosoma vivax infections of sheep. Ann . Trop. Med. Parasit. 65, 335340. (1971) . 7. CLARKSON, M. J. and MCCABE, W. The transmission of monomorphic trypanosomes by laboratory-reared tsetse f1ies. In Symposium on Tsetse f1y breeding under laboratory conditions and its practical application: Lisboa, 1969. ( 1970) . 8. CUNNINGHAM, M. P. .WILSON, A. J. and KIMBER, C. D. Modification of the infirect f1uorescent antibody test as applied to bovine trypanosomiasis E.A. T .R.O. Ann. Report. 1966 p. 29. (1966). 9. DESOWITZ, R. S. and WATSON, H. J. C. Studies on Trypanosoma vivax: IV. The maintenance of a strain in white rats without sheep serum supplement . Ann. trop. Med. Parasit. 47, 62-67. (1952) . lO. DíAZ-UNGRÍA, C. and MALDONADO, C. Diagnóstico de las tripanosomiasis animales. Asovac, Memorias 1969., p. 54. (1969) . 11. DÍAZ-UNGRÍA, C. and MALDONADO. C. Contribución al diagnóstico de las tripanosomiasis. Cienc. Vet. 2 (1-4), 21-40 (1972) . 12. DuUTOIT, P. J. A note on the diagnosis of T. vivax infection. 15th Rep. Dir . Vet. Serv. S. Africa, Part I pp. 3-B. (1929) . 13. ENAYAT, M. S. Pasive Haemagglutination test in the diagnosis of Animal trypanosomiasis. Diss. Paras. Applied Biology, Liverpool, ( 1970) . 14. FIFE, E. H. and MUSCHEL, L. H. Fluorescent Antibody technique for serodiagnosis of Trypanosoma cruzi infection. Proc. Soc. Exp .Biol. Med. 101, 540. (1959). 15. GILL, B. S. A procedure for the indirect haemagglutination test for the study of experimental Trypanosoma evansi infections. Ann trop. Med. Parasit. 58, 473. (1964) . 16. GILL, B. S. Studies on the serological diagnosis of Trypanosoma evansi J . Comp. Path. 75, 175. (1965) . 17. GRAY, A. R. Soluble antigens of Trypanosoma vivax and of other trypanosomes. Inmunology, 4,253-261. (1961) . 18 .HORNBY, H. E. The relative pathogenicity for cattle of Trypanosoma congolense and T. vivax. Vet. J. 77,77-78. (1921). 19. HULL, R. N.
SWAIN, F. MCCABE, W. JONES, T. W. and CLARKSON, M. J . Adaptation of
Trypanosoma vivax to laboratory animals. Trans. R. Soc.
trop . Med. Hyg. 65 14-15. (1971). 21.
KILLICK-KENDRICK, R. and GODFREY, D. G. Bovine trypanosomiasis in
Nigeria. II: The incidence among some migrating cattle with observations
on the examination of wet blood preparations as a method of survey. Ann.
trop. Med . Parasit. 57, 177-126. (1963) . 26. MEEKELT, G. S. Diagnóstico de Laboratorio de las tripanosomiasis americana. Rev. Venez. Sanidad Asistencia Social, 29, 1-18. (1964) . 27. MORALES, H. S. Determinación de porcentajes de anaplasmosis en México por medio de la prueba aglutinación en tubos capilares. Reunión Anual Centro Nacional de Investigaciones Pecuarias. Palo Alto, México, 1966, p. 26. (1965) . 28. PARKIN, B. S. 17th Rep. Dir. vet. Serv. Sci. Anim. Ind. S. Africa. Part I pp. 83.;86 (1931). 29. RISTIC, M. A capillary-tube agglutination test for anaplasmosis. A preliminary report. J. Amer. Vet. Med. Med. Assoc. 141. 588-594. (1962) . 30. ROBSOH, J. and WILLET, K. C. A note on the relative value of varius methods of xamination in the diagnosis of bovine Trypanosomiasis. Joint WHO/FAO African Trypanosomiasis Inf. Service, Try IInf .68. 29. (1968) . 31. Ross, J. P. J. The detection of circulating trypanosomal antibodies by capillary-tube agglutination test. Ann. trop. Med. Parasit 65, 327-333. ( 1971) . 32. SADUM, E. H. DUXBURY, R. E. WILLIAMS, J. S. and ANDERSON, R. I. Fluores cent antibody test in the diagnosis of African and American Trypanosomiasis in Man c J. Parasit. 49, 385-388. ( 1963) . 33. SCHROEDER, W. F. LE6N, R. C. TORO, M. and LOPEZ R. Estudio de la epizootología de la anaplasmosis en Venezuela por medio de la prueba de aglutinación en tubo capilar. Bol. Inst. Invest. Vet. 14,3-14. (1970) . 34. STEPHEN, L. E. Clinical manifestations of the trypanosomiasis in livestock and other domestic animals. In: The Africlln Trypanosomiasis, la ed. 1970, 774-794 (Ed. H. L. Mulligan) London Allen-Unwin. (1970) . 35. TRAGER, W. Tsetse tissue culture and the development of trypanosomes to the infective stage. Ann. trop. Med. Parasit. 53, 473. ( 1959) . 36. U,NSWORTH, K. and NESBIT, P. E. Studies on Trypanosoma vivex II: The maintenance of a strain in rabbits. Am. trop. Med. Parasit. 46,85-91. (1952). 37. VAN SACEGHAM, R. Bull Agri. Congo Belge 26, 152-154. (1935) . 38. WATSON, E. A. Dourine in Canada, 1904-1920, history, research and supresion. Otawa: Canad. Dep. Agri. Hlth of animals Branoh. (1920) . 39. WEINMAN, D. Problems of diagnosis of trypanosomiasis. Bull. W. H. O. 28,731-743. (1936) . 40. WELLS, E. A. BETANOOURT, A. PAGE, W. A. The epidemiology of bovine Trypanosomiasis in Colombia. Trop. Anim. H1th. Production, 2, 11-125. ( 1970) . 41. WILSON, A. J., CUNINGHAM, M. P., KIMBER. C. D. The indirect fluorescent antibody test applied to Bovine Trypanosomiasis, E. A. T .R .O. Ann . Report. p. 28. (1966) . 42. WILSON, A. J. Value of the indirect fluorescent antibody test as a serological aid to diagnosis of Glossina, transmitted bovine trypanosomiasis. Trop. Anim. Hlth. Prod. 1. 89-95. (1969). |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||