|
Veterinaria Tropical. 1: 51-61. 1976 DILUENTES TAMPONIZADOS PARA LA ELABORACIÓN DE LA VACUNA BIVALENTE ANTI-AFTOSA EN RATONES LACTANTES PEDRO PABLO CASTILLO*
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
INTRODUCCIÓN Para la elaboración de vacuna bivalente a virus vivo modificado "A" Cruzeiro y "O" Campos, la Sección de Producción Inmunobiológica del Instituto de Investigaciones Veterinarias, exige dos tipos de soluciones de glicerina amortiguada, una al 20% v/v y otra al 40% v/v. La introducción de ratones lactantes como materia prima de multiplición viral trajo como consecuencia, que el ampón de fosfatos que tradicionalmente se venía empleando, cuando se utilizaba como materia prima huevos embrionados, resultara inadecuado debido a su baja capacidad de tamponización. Ante tal situación las medidas tomadas por el Servicio de Química de la Sección de Bioquímica y Control de Productos, se informan en el presente trabajo. MATERIALES Y MÉTODOS EXPERIMENTO N° 1. Valores de pH para mezclas de soluciones Na2HP04-0,1 M y NaH2P04-0,1 M . 1. Reactivos y Equipos Solución 0,1 M
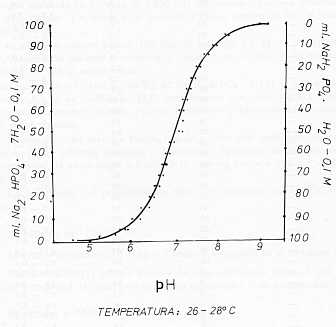
de NaH2P04. 7H2O (26,8 gr/lts) 2. Procedimiento El potenciómetro es calibrado a pH 6,50 ± 0,02. Se colocan 900 ml. de agua destilada en un vaso de 1.000 ml., agitándose durante 5 minutos. Se deja reposar 3 minutos y se procede a tomar lectura de pH y temperatura (4). Se añade mediante bureta 100 ml. de solución 0,1 M de Na2HPO4 7H2O, agitando durante 5 minutos y dejando en reposo 3'; se toman lecturas de pH y temperatura. Se toman 99 ml. de solución 0,1 M de Na2HPO4. 7H2O y 1,0 ml. de solución 0,1 M de NaH2PO4. H2O, completando con agua hasta 1 litro, se agitan 5 minutos; dejando reposar 3 minutos y procediendo a tomar pH y temperatura. Continuando en idéntica forma, tomando cada vez cantidades decrecientes de la solución dibásica y cantidades crecientes de la solución monobásica, así hasta llegar a 0 ml. de la primera frente a 100 ml. de la segunda. La calibración del potenciómetro debe ser verificada cada 50 ó 60 minutos. 3. Resultados del Ensayo N° 1 Los datos obtenidos se dan en el Cuadro 1 y se grafican en la Figura 1.
EXPERIMENTO N° 2. Efectos de la esterilización sobre el pH y sobre la densidad de soluciones tampones glicerinadas y no glicerinadas. 1. Materiales y Métodos Se prepararon soluciones glicerinadas y no glicerinadas amortiguadas a diferentes valores de pH, con un tampón 0,010 M y 0,015 en fosfatos. Se hicieron determinaciones de pH y densidad (hidrómetro) antes del envasado en frascos de 200 ml. de capacidad (4). Las condiciones de esterilización fueron 14-15 libras durante una hora en autoclave. 2. Resultados Los resultados obtenidos se dan en el Cuadro 2.
EXPERIMENTO N° 3. Curvas de Titulación (Capacidad de Tamponización). 1. Materiales y Métodos Se tomaron 25 ml. de c/solución y se titularon potenciométricamente con HCI N/100. 2. Resultados En la Figura 2, se representan las curvas de titulación para las glicerinas tamponizadas al 20% y 40% respectivamente. EXPERIMENTO N° 4. Estabilidad del pH con el tiempo. 1. Materiales y Métodos Las soluciones una vez esterilizadas fueron conservadas en refrigeración (4° - 6°C): se controló el pH cada 15 días durante 1 año. 2. Resultados Como resultado de esta experiencia se encontró una fluctuación de pH entre ± 0,05 unidades, lo cual se considera dentro del margen de error tolerable.
RESULTADOS Los resultados de los ensayos antes expuestos permitieron obtener los siguientes resultados generales de formulación, elaboración y control. 1. Formulación Para el cálculo de las cantidades necesarias de fosfatos se usa la fórmula siguiente: V x G x F x L =
g. Sal/lote (fórmula I) Ejemplo N° 1 La Sección de Producción Inmunobiológica exige un lote de 560 litros de glicerina amortiguada al 20% v/v con pH final de 7,8 - 7,9 unidades. Se procede de la manera siguiente: Según el Cuadro 2 se debe partir de un pH inicial 8,0 - 8,1 y 0,010 M; y el Cuadro 1, indica que para un pH 8,0 - 8,1 se debe tomar 94 ml. de la solución 0,1 M de la sal dibásica y 6 ml. de solución de la sal monobásica por litro de solución. De acuerdo a la
fórmula, para la sal dibásica, el cálculo es: Ejemplo N° 2 Para un lote de 400 litros de glicerina amortiguada al 40% v/v con pH final 8,1 - 8,2. El Cuadro 2, indica que se debe partir de un pH inicial 8,3 - 8,4 y 0,015 M; y el Cuadro 1, indica que para ese pH se deben tomar 96 ml. y 4ml. de las soluciones respectivas. Para la sal
dibásica, el cálculo es: Formulación para glicerina amortiguada al 20% v/v. Con pH 7,8 - 7,9 (lote de 560 litros) Na2HPO4.7H2O...............................................................
1.410,8 gr.
Na2HPO4.7H2O.................................................................
1.543,8 gr. 2 .Elaboración Para la elaboración de la glicerina amortiguada se usan tanques de acero inoxidable provistos de propela de agitación accionada por motor eléctrico. La técnica de elaboración es la siguiente: Se pesan las cantidades necesarias de sales y se disuelven en 10 lts. de agua destilada (Estos 10 litros de agua que aparentemente van en exceso, es con el objeto de compensar la contracción de volumen y la pérdida por evaporación.). Se colocan las cantidades de agua destilada necesarias (448 lts. ó 240 lts). en los tanques de agitación, y se le añaden las sales previamente disueltas. Se someten a agitación durante 30 minutos, se añade enseguida las cantidades necesarias de glicerina (112 lts. ó 160 lts.). Se agita durante 2 horas. Se deja reposar 2 - 3 horas y se procede a tomar pH y densidad (En caso de que el pH baje del valor exigido, se procede a hacer los ajustes necesarios mediante el agregado de NaOH al 5%.). Luego de 18 - 20 horas de reposo, se procede nuevamente a tomar pH (En caso de que el pH baje del valor exigido, se procede a hacer los ajustes necesarios mediante el agregado de NaOH al 5%.). Se envasa y luego se somete a esterilización en autoclave (14 - 15 libras durante 1 hora). 3. Control Las principales variables físico-químicas que se controlan son el PH y la densidad (hidrómetro) (4), los valores exigidos se dan en el Cuadro 3.
4. Sustancias Químicas Tanto los fosfatos como el hidróxido de sodio son marca Merck; una solución 0,1 M de Na2HPO4 .7H2O debe dar un pH entre 9,0-9,2 unidades y una solución 0,1 M de NaH2PO4.H2O debe dar un pH entre 4,5 - 4,7 (3). La glicerina debe cumplir con todas las exigencias U.S.P., debiendo tener una densidad no menor de 1,250 (no menos de 95% de C3H3O8) y un índice de esteres y ácidos grasos muy próximo a 0 ml. de NaOH 0,5N. Así mismo un alto contenido de hierro es causa de que la mezcla amortiguada se tome oscura, o tome un color amarillento luego de efectuada la esterilización. DISCUSIÓN Una solución tampón, es una solución que tiende a mantener constante el pH y consiste casi invariablemente en una mezcla de un ácido débil o una base y su sal (1). La acción reguladora en una disolución de un ácido débil (HA) y su sal (A) se explica por el hecho de que se neutralizan iones de hidrógeno por los iones de la sal, que actúan como una base débil; así : H3O+ + A- HA + H2O mientras que se eliminen iones hidróxido por la neutralización: OH- + HA H2O + A- Para la tamponización de la glicerina se emplean dos sales: Na2HPO4 y NaH2PO4 las cuales representan dos etapas diferentes de la neutralización de un ácido poliprótico; en este caso la primera es la base conjugada y la segunda es el ácido conjugado, siendo la constante de disociación del sistema, la del ácido H2PO4 (2) . Considerando que el pKa del sistema es 7,13 y que la propiedad tampón va de pk ± 1, se determina que el intervalo eficaz de tamponización del sistema está entre pH 6,13 y 8,13 (2). Estando el pH del sistema por encima de 4 y por debajo de 10, para el cálculo teórico del pH del tampón se puede aplicar la ecuación de HENDERSON (1):
(sal) asi para la glicerina tamponizada al 20%, tendremos: (sal) = 0,0094 M
en Na2HPO4, (0,0144 ) El pH determinado potenciométricamente, siempre ha estado entre 8,2 - 8,1. Para la glicerina tamponizada al 40%. (0,0094 ) y el pH determinado siempre ha estado entre 8,3 - 8,4 Cuando en la elaboración se usa glicerina con un elevado índice de esteres y ácidos grasos, o bien con un apreciable contenido de hierro como es lógico el pH tiende a bajar de los límites exigidos. En estos casos es necesario agregar NaOH al 5% en cantidad suficiente hasta alcanzar esos límites de pH (1, 2). Por lo general basta añadir entre 80 - 120 ml y 180 - 220 ml. de NaOH al 5% para los tampones al 20% y 40% v/v en glicerina respectivamente. Considerando que las sales sufren los siguientes procesos de hidrólisis: H2O Este NaOH (Producto de hidrólisis) es consumido por la glicerina con elevado contenido de ácidos graso y ésteres, o bien hierro, por lo tanto al añadir NaOH, se está restaurando éste a su concentración original. Por lo tanto las formulaciones obtenidas, tanto para la glicerina al 20% como para la glicerina al 40% cumplen con los requisitos de elaboración, exigidos por la Sección de Producción Immunobiológica y además la fórmula (I) es aplicable al cálculo de cualquier tampón de fosfatos dentro del rango de pH dado por la Figura 1; pudiéndose incrementar la capacidad de amortiguación (factor F) en cualquier valor entero o fraccionado. RESUMEN En la elaboración de la vacuna Bivalente Anti-Aftosa a Virus Modificado que se produce en Venezuela, se emplea como diluente Glicerina Amortiguada. Se consiguió que las formulaciones establecidas en el presente trabajo son apropiadas como vehículo de los virus vacunales. Estas formulaciones son soluciones de Glicerina al 20% y 40% v/v. amortiguadas con un tampón de fosfatos 0,010 y 0,015 Molar, respectivamente. SUMMARY In Venezuela a glycerine buffer solution is used as diluent for the production of Foot and Mouth Disease live virus vaccine. A concentration of 20% and 40% of glycerine solution buffered with phosphate 0,010 and 0,015 M is found to be appropriate as vehicle for the vaccine. BIBLIOGRAFÍA 1. DANIELS, F. y ALBERTY , R. A. Fisioquímica, México, Editora Continental, 1963. 2. GLASSTONE, S. Tratado de Química-Física, Madrid, Aguilar, 1961. 3. The United States Pharmacopeia. 17th. Revisión, Maryland, Mack Publishing CO, 1965. 4. WILLARD H. H., MERRIT, L. L. y DEAN, J. A. Métodos Instrumentales de Análisis, México, Editora Continental, 1965. RECONOCIMIENTO En la realización de este trabajo colaboró el personal de la Sección Control de Productos, así como también los Servicios de Envases y Esterilización de la Sección Producción Inmunobiológica del Instituto de Investigaciones Veterinarias. Mención muy especial merece la colaboración del señor Sebastián Silva. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||