|
Veterinaria Tropical 10: 19-34. 1985 MECANISMOS DE TRANSMISIÓN
DEL VIRUS DE ESTOMATITIS VESICULAR. I. J. CASTAÑEDA G.** y O. SUÁREZ*** *Este trabajo es
parte de los resultados obtenidos |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
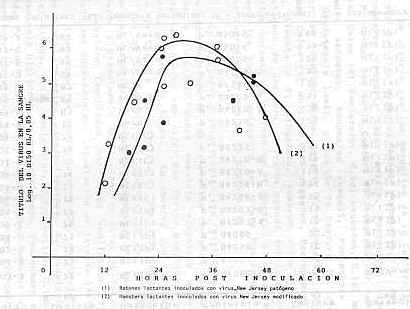
RESUMEN Se realizaron más de cien capturas de mosquitos en haciendas donde la estomatitis vesicular es enzoótica en algunas de ellas. En estas capturas se identificaron ocho géneros y veintitrés especies de mosquitos. En treinta y nueve de las capturas se investigó la presencia de virus mediante la inoculación en ratones y hamsters lactantes y en células Vero, pero ningún virus fue aislado. Se realizaron quince experimentos de infección de mosquitos que succionaron sangre de ratones y hamsters lactantes virémicos y en nueve de estos experimentos se pudo aislar virus New Jersey modificado o patógeno de los mosquitos. En tres experimentos fue posible transmitir a hamsters lactantes sanos virus New Jersey patógeno por picadura de mosquitos, los cuales previamente habían succionado sangre de hamsters virémicos. Las capturas de mosquitos que transmitieron el virus estaban conformadas por especies de los géneros Aedes, Anopheles, Culex, Psorophora y Uranotaenia. INTRODUCCIÓN La epidemiología de la estomatitis vesicular presenta aspectos que todavía no han podido ser aclarados, como es el caso de su mayor ocurrencia en zonas de clima cálido y húmedo, o en áreas geográficas con este tipo de clima, donde los artrópodos son abundantes y podrían muy bien participar en su perpetuación y transmisión. No obstante, la mayor incidencia observada para el virus New Jersey, en relación con los pocos brotes producidos por el virus Indiana, sugiere que estos dos tipos de virus son epidemiológicamente diferentes, por lo menos en cuanto a sus mecanismos de transmisión. El papel de los vectores sugerido por Hanson (4) fue investigado luego por Ferris et al. (3), quienes lograron la transmisión experimental del virus New Jersey mediante tábanos y mosquitos a huéspedes de laboratorio. Esta transmisión fue aparentemente mecánica y no biológica y observaron que los mosquitos pudieron transmitir el virus pero sin producir la enfermedad y sólo se produjo una respuesta serológica contra el virus. Sin embargo, Mulhern (6) no tuvo éxito al tratar de obtener evidencias a nivel de campo, de la participación de los dípteros succionadores en la transmisión del virus New Jersey, pues no le fue posible aislar el virus de los artrópodos que fueron capturados en una epizootia ocurrida en Texas. La participación de los vectores frente al virus Indiana es un tanto diferente si se observan los resultados señalados por Musgay y Suárez (7), quienes obtuvieron la multiplicación experimental del virus Indiana en mosquitos Aedes aegypti, y los de Jonkers et al. (5), quienes aislaron el virus cocal de ácaros Gigantolaelaps de ratas de los arrozales de Trinidad, el cual fue clasificado posteriormente como un sub-tipo del virus Indiana. Shelokoy y Peralta (9) informaron sobre el aislamiento del virus Indiana de un pool de Phlebotomus, capturados en una zona boscosa de Panamá en 1959, donde también detectaron anticuerpos circulantes contra este virus en la población humana vecina. Sudia et al. (10) lograron el aislamiento del virus tipo Indiana de un pool de mosquitos Aedes, probablemente de la especie dorsalis, indicando que este fue el primer aislamiento de ese virus en condiciones naturales en un brote de estomatitis vesicular que afectó bovinos y equinos en el Estado de New México, durante el verano de 1965. Bergold et al. (1) también reportan la multiplicación y transmisión del virus Indiana en mosquitos Aedes aegypti. Tesh et al. (12) demostraron la transmisión transovárica del virus Indiana de moscas Phlebotomus, de las especies Lutzomyia trapidoi y L. ylephiletrix, experimentalmente inoculadas a sus descendientes. Estos, a su vez, transmitieron el virus cuando, succionaron sangre de hamsters susceptibles. Este trabajo informa sobre los resultados obtenidos en ensayos de transmisión del virus New Jersey por mosquitos, en condiciones experimentales. MATERIALES Y MÉTODOS Virus Se utilizó una cepa de virus New Jersey patógeno de origen bovino y la cepa de virus New Jersey modificado, la cual se utiliza en el Instituto de Investigaciones Veterinarias para la elaboración de vacuna contra estomatitis vesicular (2). Estas cepas de virus se emplearon según se indica en las diferentes experiencias señaladas en esta comunicación. Cultivos celulares Para la detección y titulación de virus se empleó cultivos de células Vera y BHK 21, con medio de Eagle adicionado de penicilina, streptomicina y fungizona. Animales de laboratorio Se utilizaron hamsters y ratones lactantes, de cuatro a seis días de edad, los cuales fueron inoculados, por vía intraperitoneal o intracerebral, para detección de virus y posteriormente sangrados por vía intracardíaca para estudios de viremia. Captura y procesamiento de mosquitos Pools de mosquitos fueron capturados con trampas de luz tipo CDC miniatura; en estos pools se identificaron los géneros y especies presentes. Cuando en las diferentes capturas se contaba con suficientes mosquitos, éstos se separaban en tres grupos: uno para identificación, otro para aislamiento de virus, los cuales eran congelados inmediatamente en hielo seco, y el tercer grupo para ensayos de transmisión. Detección de virus en mosquitos capturados o infectados experimentalmente Los mosquitos eran triturados en morteros fríos, luego se hacia una suspensión al 1/10 en medio de Eagle adicionado de antibióticos, y después de centrifugar a 3000 r.p.m., durante 20 minutos, el sobrenadante era inoculado en cultivos de células Vero o BHK 21 y en ratones o hamsters lactantes, por vía intracerebral o intraperitoneal. Los cultivos celulares se mantuvieron en observación por espacio de tres días para apreciar la producción de efecto citopático (ECP), y los hamsters y ratones fueron observados por siete días para constatar parálisis o muerte. De los ratones y hamsters muertos se tomaban sus cerebros y músculos, se trituraban en medio de Eagle con antibióticos y después de centrifugación en frío, a 3000 r.p.m., el sobrenadante era utilizado para la identificación del virus por fijación de complemento, frente a suero hiperinmune de cobayos. Además de la observación de ECP, la presencia de virus en los cultivos celulares infectados era comprobada por fijación de complemento. Determinación y cuantificación de viremia en hamsters y ratones lactantes Con el fin de establecer el momento más apropiado para que los mosquitos tomaron el virus presente en la sangre circulante, se cuantificó la viremia en hamsters y ratones lactantes, los cuales después de ser inoculados intraperitonealmente con una dosis fija de virus eran sangrados cada seis horas por vía intracardíaca; con la sangre tratada con heparina sódica se hacían diluciones decuples y después se inoculaban células Vero y ratones y hamsters lactantes. El titulo de la viremia se calculó por el método de Reed y Muench (8). Determinación de la transmisión por picadura de mosquitos En todas las experiencias, los hamsters virémicos, luego de 22-24 horas de inoculación, fueron expuestos a los mosquitos para que éstos los picaran y succionaran la sangre. Los hamsters eran retirados 24 horas más tarde, cuando ya algunos de ellos estaban paralíticos o muriendo, luego se agregaban nuevos hamsters lactantes susceptibles, los cuales eran observados por siete días, retirando los que murieran. Estos eran procesados para identificación del virus presente en sus cerebros y músculos por fijación de complemento. RESULTADOS El Cuadro1 muestra los géneros y especies de mosquitos recolectados en las diferentes capturas y posteriormente utilizados en esta investigación. Cada pool o captura estaba constituida por más de una especie de mosquitos, los cuales fueron identificados en cada caso. En la Figura 1 se aprecia la evolución de la viremia en ratones y hamsters lactantes, inoculados con virus New Jersey, modificado o patógeno. Los títulos más altos de viremia se observaron entre las 24 y 36 horas post-inoculación.
El Cuadro 2 resume las experiencias de detección de virus en pools de mosquitos, después que los mismos fueron triturados y las suspensiones de tejidos fueron inoculadas en ratones y hamsters o en cultivos celulares. En ninguno de los experimentos fue posible aislar virus.
Los primeros resultados obtenidos de varias capturas de mosquitos, que succionaron sobre hamsters y ratones lactantes, los cuales habían sido inoculados con virus New Jersey patógeno o modificado, aparecen en el Cuadro 3. Se observa que los mosquitos de la Captura 3, integrada por las especies Aedes scapularis, A. serratus, Anopheles rangeli, Culex mollis, Psorophora cingulata y P. ferox; los de la Captura 10 integrada por las especies Culex (c) declarator, C.(c) usquatos, C.(c) mollis, Aedes serratus, Anopheles rangeli, Psorophora ferox y Uranotaenia lowii, y los de la Captura 18 integrada por las especies Aedes aegypti, A. scapularis, A. serratus, Culex (c) mollis, C(c) usquatus, Psorophora ferox, P. lineata y P. cingulata, tomaron virus New Jersey patógeno de hamsters virémicos cuando succionaron sobre ellos durante un periodo de 24 horas. El virus modificado fue tomado solamente por siete Psorophora ferox, que fueron separadas de la Captura 18.
En el Cuadro 4 se presentan los resultados obtenidos cuando mosquitos de las diferentes capturas fueron puestos a succionar sobre hamsters virémicos que habían sido inoculados con virus New Jersey modificado o patógeno, durante 24 horas. Se observa que los mosquitos de la Captura 85, constituida por 200 Aedes serratus y los de la Captura 4C, constituida por 16 mosquitos de las especies Psorophora cingulata, P. confinis, P. ferox y Uranotaenia lowii, tomaron virus de los ratones y hamsters inoculados con virus modificado, el cual pudo ser detectado por inoculación en ratones lactantes. Los mosquitos de la Captura 126, compuesta por las especies Anopheles neomaculipalpus, A. oswaldoi, Culex (c) bidens, C.(c) declarator, C.(c) mollis, C.(c) donni, Mansonia nigricans, M. venezuelensis, Psorophora cingulata, P. confinis y Uranotaenia lowii, tomaron virus de hamsters inoculados con virus New Jersey patógeno y éste pudo ser detectado en ratones lactantes.
El Cuadro 5 muestra los resultados de transmisión del virus New Jersey, cuando pools de mosquitos de los géneros Psorophora, Aedes, Culex, Anopheles y Uranotaenia succionaron sangre de hamsters lactantes virémicos, que habían sido infectados con virus New Jersey patógeno, y luego de 24 horas puestos nuevamente a succionar sobre hamsters lactantes sanos. El virus New Jersey P. 83118 inoculado en hamsters que luego fueron expuestos a los mosquitos de la Captura 116, fue obtenido de lesiones pódales (de generalización) de un bovino inoculado experimentalmente con virus patógeno de campo y luego sometido a tres pasajes seriados en células Vero. Los hamsters lactantes expuestos posteriormente a los mosquitos infectados murieron por la acción del virus New Jersey, el cual fue luego aislado de sus tejidos e identificado por pruebas de fijación de complemento frente a suero hiperinmune de referencia. El virus utilizado en los otros dos experimentos mostrados en el Cuadro 5, fue obtenido de mosquitos de la Captura 116, los cuales succionaron sangre de animales virémicos que habían sido inoculados con el mismo virus P. 83118. Este fue el mismo virus con el cual se infectaron los mosquitos de la Captura 126 mostrada en el Cuadro 4.
DISCUSIÓN Los resultados obtenidos en este trabajo indican que algunas de las especies de mosquitos utilizadas, podrían jugar un papel importante en la transmisión del virus de la estomatitis vesicular, tipo New Jersey, en condiciones naturales. Esta transmisión parece ser mecánica ya que después que los mosquitos infectados succionaron por 24 horas o más sobre hamsters sanos, fueron triturados para aislamiento de virus con resultados negativos. Estas pruebas serán realizadas nuevamente con las distintas especies de mosquitos utilizadas, pero empleando una sola especie en cada caso. También se llevarán a cabo una serie de experiencias con cerdos y bovinos jóvenes mantenidos en cautiverio. SUMMARY More than on hundred pools of mosquitoes were captured in farms where vesicular stomatitis is enzootic. Eigth genera and twenty three species of mosquitoes were identified in these pools. In thirty nine pools the presence of virus was investigated but no virus was isolated. When mosquitoes were fed on viremic hamsters and mice infected with New Jersey virus, and then tested for virus infection it was possible the isolation of the virus in nine out of fifteen experiments, twenty four hours after mosquitoes had taken the infected blood meal. In three transmission experiments it was possible to transmit patogenic New Jersey virus from viremic to healthy suckling hamsters by two pools of several species of mosquitoes of the genera Aedes, Anopheles, Culex, Psorophora and Uranotaenia. AGRADECIMIENTO Los autores expresan su gratitud a los técnicos José M. Obregón, Mario Blanco y Maria W. de Agüero, por su destacada asistencia en este trabajo. También agradecen a la señora Ana Lucila R. de Labrador su trabajo secretarial, y al señor Humberto Montañez, por su asistencia en la captura y clasificación de los mosquitos. BIBLIOGRAFÍA 1. BERGOLD, G.D., O. SUAREZ y K. MUNZ. Multiplication and transmission by Aedes aegypti of vesicular stomatitis virus. J.lnvest.Panth. 11 :406-426. 1966. 2. CASTAÑEDA, J., C. BERNAL, J. DE DOMINGUEZ, M. ESPINOZA, A. DE CHAUREL y G. DE BLANCO, Desarrollo y uso de vacuna contra el virus de estomatitis vesicular. First International Conference on the Impact of Viral Diseases of the Development of Latin American Countries and the Caribbean Region. Rio de Janiero, Marzo 22-27 de 1982. 3. FERRIS, D.H., R.P. HANSON, R.J. DICKE y R.H. ROBERTS. Experimental transmission of vesicular stomatitis virus by Diptera. J.lnfect.Dis. 96:184-192. 1955. 4. HANSON, R.P. The natural history of vesicular stomatitis. Bact.Rev. 16 :179-204. 1952. 5. JONKERS, A.H., R.E. SHOPE, T.H.G. AITKEN y L. SPENCER. Cocal virus, a new agent in Trinidad related to vesicular stomatitis virus, tipe Indiana. Am.J. Vet. RBS. 25(104) :236-242. 1964. 6. MULHERN, F.J. Report of the Committe on Vesicular Diseases. Proc. 63rd Annual Metting. U.S. Livestock Sanitary ASSN p. 346-350. 1959. 7. MUSGAYY, M. y O. SUAREZ. Multiplication of vesicular stomatitis virus in Aedes aegypti (L) en mosquitoes. Virology 17:202-203. 1962. 8. REED y H. MUENCH. Simple method of stimating fifty per cent end points. Am.J.Hyg. 27 :495-497. 1938. 9. SHELOKOV, A. y P. PERALTA. Vesicular stomatitis virus Indiana tripe: An arbovirus infection of tropical sandflies and humans. Am.J.of Epidem. 86(1) 149-157. 1967. 10. SUDIA, et al. The isolation of vesicular virus (Indiana strain) and other viruses from mosquitoes in New Mexico 1965. /\m.J.Epidem. 86(3) :598-602. (1967) 11. TESH. R.B., B. CHANIDTlS, N. BYRON y K.M JOHNSON. Vesicular stomatitis virus (Indiana serotype): transovarial transmission by Phlebotomide sandfliles. Science 175: 1477-1499. 1972 12.TESH. R.B., B.N. CHANIOTIS. P.H. PERALTA y K.M JOHNSON. Ecology of viruses insolated from Panamanian phlebotomine sandflies. Am.J.Trop.Med.Hyg. 23(2): 258-269. 1974 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||