|
Veterinaria Tropical 11:
9-29. 1986
INCIDENCIA DE DETERMINANTES GENÉTICOS DE RESISTENCIA A LOS ANTIMICROBIANOS EN CEPAS DE Escherichia coli, AISLADAS EN CASOS DE DIARREA EN SUINOS DE LA REGIÓN CENTRAL DE VENEZUELA Y. Pineda de Mora* y V.
Rodríguez Lemolne**
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
RESUMEN El análisis de los determinantes de resistencia a los agentes antimicrobianos en cepas de Escherichia coli, aisladas en lechones con síndrome de diarrea aguda, permitió demostrar que en la población porcina examinada, proveniente de 27 granjas en la región central del país (estados Aragua, Carabobo y Miranda), la multiresistencia era debida fundamentalmente a la presencia de plásmidos transmisibles pertenecientes a los grupos de incompatibilidad identificados como FV (85%), FIV (8,57%) y FI (5,7%). Las cepas aisladas fueron resistentes a estreptomicina. SM (100%); tetraciclina, Tc (100%); triple sulfa,Ts (100%); ampicilina, Am (75,4%); nitrofurantoin, Nf (65,5%); kanamicina, Km (59%); neomicina, Nm (55,7%); trimetropin-sulfametoxazole, Tsx (55, 7%) ; cloranfenicol, Cn (52,4%) ; cefalotin, Cf (37,7) ; colistin, CI (19,6%); gentamicina, Gm (3%) y polimixin B, PB (1,6%). Se observó un patrón básico de multiresistencia, altamente estable, constituido por Am-Sm-Ts ligado a plásmidos transmisibles. La alta frecuencia de multiresistencia revela la existencia de fuertes presiones selectivas ejercidas por el uso indiscriminado de los agentes antimicrobianos en la cría porcina en Venezuela. INTRODUCCIÓN La diarrea en cerdos durante las primeras semanas de vida, es una de las principales causas de morbilidad y mortalidad en la población porcina mundial, especialmente en países en vías de desarrollo (6). La diarrea es un proceso complejo donde interactúan diversos agentes infecciosos, el medio ambiente, condiciones nutricionales y de manejo (1 ). Escherichia coli enteropatógena ha sido el agente infeccioso más ampliamente incriminado como una de las causas determinantes de la diarrea neonatal (14, 17, 18). Las pérdidas económicas causadas en Venezuela por esta afección no han sido adecuadamente analizadas, aunque ha sido reconocida como una de las afecciones que acarrea mayores pérdidas económicas, representando un duro golpe a la tercera industria pecuaria nacional. El tratamiento más comúnmente utilizado para el control de este proceso infeccioso es la terapia antimicrobiana, cuya efectividad se ha visto reducida por la aparición de cepas bacterianas resistentes a los antimicrobianos de uso más común en la práctica veterinaria. Esto es una consecuencia de su empleo intensivo en la cría porcina, como agentes promotores del desarrollo, preventivos de enfermedades y terapéuticos (3, 9, 15, 19, 27, 28, 29). En Venezuela no se ha establecido una normativa que regule el tipo y concentración de los antimicrobianos que podrían adicionarse a los alimentos para uso animal (comunicación personal Ministerio de Agricultura y Cría). Esto se ve agravado por la falta de información sistematizada de la multiresistencia bacteriana a los anti-microbianos en nuestro medio. Este estudio preliminar se realizó con el objeto de conocer la incidencia de la resistencia, la transmisibilidad de estos determinantes de resistencia y la epidemiología de los plásmidos de resistencia (R) en cepas de E. coli, aisladas en casos de diarrea en lechones, provenientes de granjas porcinas donde esta afección constituye un grave problema de difícil control. MATERIALES Y MÉTODOS Cepas bacterianas, plásmidos y bacteriófagos Las cepas de E. coli (61) fueron obtenidas del intestino delgado de lechones con diarrea, provenientes de granjas porcinas ubicadas en los estados Aragua, Carabobo y Miranda (Figura 1), con edades comprendidas entre 1 a 5 semanas y fueron , analizadas en el Laboratorio de Bacteriología del Instituto de Investigaciones Veterinarias (FONAIAP). Estas cepas salvajes de E. coli eran portadoras del fenotipo lactosa positiva y sensibles al ácido nalidíxico (lac+ , NaIS) .Las cepas de E. coli auxotrofas utilizadas aparecen descritas con sus características en el Cuadro 1. Los plásmidos utilizados y su origen aparecen descritos en el Cuadro 2. El bacteriófago MS2 fue obtenido del cepario del Laboratorio de Microbiología y Genética de la Facultad de Ciencias, Universidad Central de Venezuela. Aislamiento y caracterización El análisis bacteriológico se realizó por siembras directas del intestino delgado en lechones en medios diferenciales y las cepas aisladas fueron caracterizadas bioquímicamente empleando la metodología descrita por Edwards y Ewing (5) y koneman et al. (12).
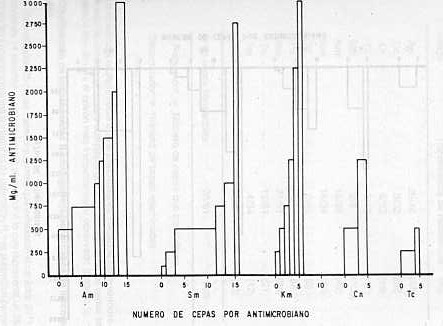
Se analizó la susceptibilidad de 61 cepas de E. coli frente a 14 agentes antimicrobianos siguiendo la metodología descrita por Bauer y Kirky (2). Los antimicrobianos utilizados y sus concentraciones fueron ácido nalidíxico, AN (30 mcg); ampicilina, Am (10 mcg) ; cefalotin, CF (30 mcg) ; colistin, CI (10 mcg) ; cloranfenicol, Cn (30 mcg); gentamicina, Gm (10 mcg); kanamicina, Km (30 mcg); neomicina, Nm (30 mcg); nitrofurantoin, Nf (300 mcg); polimixin B, PB (300 unid.); estreptomicina, Sm (10 mcg); tetraciclina, Tc (30 mcg); trimetropin-sulfametoxazole, Tsx (25 mcg) y triple sulfa, Ts (300 mcg). Se correlacionó los niveles de resistencia con la concentración mínima inhibitoria (CMI) para Am, Cn, Km, Sm y Tc mediante el método de dilución en agar con un replicador de Steers (26), utilizando concentraciones seriadas de cada antimicrobiano expresadas en mcg/ml (25-50-100-250-500- 750-1 000-1 250-1 500- 1750-2000-2250 y 3000). Transmisibilidad de los determinantes de resistencia Este proceso se realizó a través de experimentos de conjugación en medio sólido a 30°C, bajo las condiciones descritas por Rodríguez-Lemoine y Rowbury {20). Las cepas de E. coli salvajes (lac+, NaIS) fueron utilizadas como donantes y la cepa de E. coli K 12711 lactosa negativa y ácido nalidíxico resistente (lac-, NaIR) como receptora. La mezcla de conjugación fue incubada a 30°C por dos horas y la selección de transconjugantes se realizó en placas de agar medio mínimo, suplementado con los requerimientos nutricionales de la receptora, adicionado de ácido nalixídico a una concentración final de 40 mcg/ml. El antimicrobiano por cuyo determinante de resistencia se desea seleccionar, fue escogido en cada caso por cinco antimicrobianos cuya concentración final fue para Am, Cn y Km 20 mcg/ml; Sm 30 mcg/ml y Tc 15 mcg/ml. Estas placas se incubaron a 37°C por 48 horas. La frecuencia de transmisión se determinó según la relación (f = T /DV) donde T es el número de transconjugantes que desarrollan colonias en las placas de selección, después de 48 horas de incubación y DV es el número de donantes viables en la mezcla de conjugación. Las colonias transconjugantes fueron aisladas por agotamiento en ausencia de presión selectiva y posteriormente se determinó el fenotipo de los plásmido transferidos. Clasificación de los plásmidos R por incompatibilidad Se realizó una clasificación preliminar de los plásmidos de resistencia presentes en las cepas de E. coli salvajes, de acuerdo con su capacidad de expresar el carácter de inhibir la fertilidad de un factor F (Fi+). Estas pruebas de sensibilidad al fago MS2 se realizaron según las condiciones descritas por Rodríguez-Lemoine (21). Los plásmidos de resistencia (R) grupo F (expresan el carácter Fi+) fueron clasificados luego por incompatibilidad según metodología descrita por Datta (4). Las cepas transconjugantes construídas por introducción de los plásmidos R transmisibles se utilizaron como donantes con cada una de las cepas receptoras. Cepas de E. Coli portadoras de plásmidos del tipo F grupo de incompatibilidad FI, FII, FIV y FV se utilizaron como receptoras. La conjugación se realizó igualmente a 30°C por dos horas en placas de agar medio mínimo, suplementado con los requerimientos nutricionales de la receptora correspondiente en cada caso y el antimicrobiano por cuyo determinante de resistencia se desea seleccionar. La selección de transconjugantes se determinó por aislamiento de al menos 16 clones en agar deoxicolato. La coexistencia estable y hereditaria de los plásmidos entrantes y residentes fue continuamente analizada en ausencia de presión selectiva. RESULTADOS Cepas de Escherichia coli En este estudio se analizaron intestinos de lechones con diarrea cuyo diagnostico clínico fue colibacilosis porcina. Entre los microorganismos identificados E. coli fue el de mayor incidencia. Susceptibilidad a los agentes antimicrobrianos Todas las cepas (100%) mostraron resistencia múltiple exhibiendo resistencia al menos a tres antimicrobianos y máximo a once. Se determinaron 40 patrones de resistencia diferentes, los más comunes incluyen resistencia para 5(Am-Nf-Sm-Tc-Ts) y 9 (Am-Cn-Nf-Km-Nm-Sm-Tc-Tsx-Ts) marcadores de resistencia. Todas las cepas fueron resistentes a Sm- Tc y Ts; los antimicrobianos con más baja frecuencia fueron PB-Gm y CI (Cuadro 3). La concentración mínima inhibitoria (CMI) en las cepas salvajes fue alta, alcanzando valores entre 250-750 mcg/ml en la mayoría de las cepas para Am-Cn-Km-Sm y Tc; niveles más altos se observaron en menor proporción (Figura 2). La CMI en las transconjugantes alcanzó niveles más bajos entre 25 y 750 rncg/ ml; niveles más altos se observaron en menor proporción (Figura 3). Transmisibilidad de los determinantes de resistencia identificados E1 43% de las cepas mostraron determinantes de resistencia ligados a plásmidos transferibles. Los determinantes de resistencia mayormente ligados a plásmidos transferibles fueron ampicilina, neomicina y triple sulfa. Ninguna de las cepas transfirió nitrofurantoin y polimixin B (Cuadro 4). La frecuencia de estos determinantes genéticos de resistencia osciló entre 0,47 x 10-5 y 8,2 x 10-1 indicando la presencia de plásmidos con sistemas de conjugación reprimidos y dereprimidos aun cuando están en mayor proporción plásmidos con sistema de conjugación reprimidos. Las cepas transconjugantes exhibieron el 100% de resistencia múltiple frente a 14 antimicrobianos utilizados, observándose 29 patrones de resistencia, menos complejos que los observados en las cepas salvajes, siendo Am-Sm-Ts el patrón más frecuentemente observado (Cuadro 5).
Clasificación de los plásmidos R conjugativos por pruebas de incompatibilidad Se analizaron 25 cepas transconjugantes que exhibieron el carácter (Fi+), portadoras de 14 plásmidos pertenecientes al grupo FV, lo que representa un 85,7% de todas las transconjugantes portadoras de plásmidos R, tres plásmidos pertenecientes al grupo FIV y dos pertenecientes al grupo FI. El plásmido Ec 25-001 se ubicó en los grupos de incompatibilidad FIV y FV a la vez, ello sugiere la existencia de sistemas de compatibilidad compartidos en dicho plásmido (Cuadro 6)
DISCUSION La resistencia a los agentes antimicrobianos ha sido señalada en cepas de E. coli enteropatógenas y no enteropatógenas de origen humano y animal (8, 10, 11, 23, 28, 29). Los resultados obtenidos en esta investigación demuestran que la resistencia múltiple es más frecuente que la resistencia simple. Ello se debe a que los genes que codifican resistencia se encuentran en elementos genéticos translocables denominados transposones, responsables de la acumulación de genes de resistencia en los plásmidos (7, 13, 24). La alta incidencia de resistencia a estreptomicina, tetraciclina y triple sulfa podría resultar del uso ampliamente difundido de estos agentes como aditivos en los alimentos de consumo para cerdos. Los índices elevados de frecuencia de resistencia encontrada para Am, Cn, Nf, Km, Nm y Tsx se pueden igualmente asociar a su amplio uso veterinario. Estos resultados coinciden con informes de diferentes países los cuales revelan la amplia difusión de la resistencia a nivel mundial (11,16, 22, 28, 29). Los niveles altos de resistencia observados en estas cepas de E. coli evidencian la poca probabilidad de éxito en la terapia de la colibacilosis porcina, en las granjas analizadas, mediante el uso de estas drogas. Investigaciones previas (9, 25) revelan adecuada sensibilidad de las cepas de E. coli a colistin y polimixin B; los resultados obtenidos confirman este hecho para polimixin B lo que representa una alternativa para el tratamiento de esta afección; sin embargo, se señala resistencia y transmisibilidad, aunque en baja proporción, para colistin, lo cual puede asociarse al inicio de su uso como un terapéutico en la industria porcina venezolana. La mayoría de los determinantes de resistencia fueron ubicados en plásmidos conjugativos, garantizando la diseminación de estos determinantes genéticos en la población porcina. Este fenómeno se ha visto ampliamente favorecido por el uso indiscriminado de los antimicrobianos como promotores de desarrollo y terapéutico en la población porcina. En este trabajo se identificaron los plásmidos de resistencia sobre la base de pruebas de incompatibilidad. Este estudio preliminar demuestra que un plásmido identificado como perteneciente al grupo de incompatibilidad FV está ampliamente distribuido en las distintas granjas evaluadas. El plásmido es portador de diferentes determinantes de resistencia, manteniéndose en forma estable la resistencia para ampicilina, tetraciclina y triple sulfa. Ello sugiere que este plásmido mantiene un ciclo cerrado en las granjas estudiadas y probablemente en todas las granjas porcinas de la región, asegurando la prevalencia de los determinantes de resistencia en cepas de E. coli y en otras bacterias patógenas para cerdos. SUMMARY A survey of drug resistance was carried out in Escherichia coli strains isolated from diarrheic piglets. It was found that multiresistance in 27 porcine farms of the Central Region (Aragua, Carabobo and Miranda states) was produced by conjugative plasmids belonging to incompatibility groups FV (85%), FIV (8,5%) and FI (5,7%). The strains were resistant to streptomicyn, Sm (100%); tetracycline, Tc (100%); triple sulfa, Ts (100%); ampicillin, Am (75,4%); nitrafurantoin, Nf (65,5%); kanamycin, Km (59%); neomycin, Nm (55,7%); trimethoprim-sulfametoxazole, Tsx (55,7%); chloramphenicol, Cn (52,4%); cephalotin, Cf (37,7); colistin, CI (19,6%) 2 gentamicin, Gm (3%) and polimixin B, PB (1 ,6%). It was determined that a basic stable resistance pattern (AM-Sm- Ts) was linked to conjugative plasmids. The high frecuency of multiresistance suggests that a strong selective pressure is being produced by the irrational usage of antimicrobial agents in porcine farms in Venezuela. BIBLIOGRAFIA 1. ALEXANDER, J. J. L. 1981. Piglet diarrhoea: a guide to diagnosis and control. Brit. Vet. J. (G. B.) 137: 651-662. 2. BAUER, A.W.; KIRBY, W.M.M.; SHERRIS, J. C.; TRUCK, M. 1986. Antibiotic susceptibility testing by a standardized single disk method. Am. J. Clin. Pathol. (EE.UU.) 45: 493-496. 3. BINEVA, I.; KORNDZHIISKI, N.Y.; KARADZ, H.S. 1982. Drug resistance induced by R-plasmid conjugation among strains of Escherichia coli isolated from a pig farm. Veterinarnomeditsinski Nauki. (Bulgaria). 19: 18-23 (Vet. Bull. (G.B.) 1983, 53: 152 abstracts 944). 4. DATTA, N. 1975. Epidemiology and classification of plasmids.ln: Microbiology 1974. Ed. by D. Shansing. American Society of Microbiology (EE.UU).p. 8-17. 5. EDWARDS, P. R.; EWING, W. H. 1972. Identification of enterobatiaceae. 3 ed.(Minnesota, EE.UU.). Burgess Publishing. p. 67-105. 6. ELWELL, L. P.; SHIPLEY, P. L. 1980. Plasmid-mediated factors associated with virulence of bacteria to animals. Ann. Rev. Microbiol. (EE.UU.) 34: 465-490. 7. FOSTER, T. J.; KLECKNER, N. 1980. Properties of drug resistance transposons with particular reference to Tn 10.ln: Plasmids and transposons. Ed. by C. Stuttard and K. R. Rozee. London, G. B. Academic Press. p. 207-227. 8. FRANKLlN, A. 1984. Antimicrobial drug resistance in porcine enterotoxigenic Escherichia coli of a group 149 and non-enterotoxigenic Escherichia coli. Vet. Microbiol. (N. E.) 9: 467 -475 (Vet. Bull. (G. B.) 1984.54: 1015 abstracts 7678). 9. GALLARDO DE LOPEZ, A.; POLANCO, J. E.; PINEDA DE MORA, Y. C.; APONTE, F. 1986. Resistencia a los agentes antimicrobianos y plásmidos R en cepas de Escherichia coli aisladas de cerdos con diarrea en Venezuela. Rev. Fac. Ciens. Vet. (Maracay, Ven.) 33: 1-4. 10. HUBER, W. G.; KORICA, D.; NEAL, T. P.; SCHNURRENBERGER, P. R.; MARTIN, R. J. 1971. Antibiotic sensitivity patters and R factors in domestic and wild animals. Arch. Environ. Health. (EE.UU.) 22: 561-567. 11 KANAI. H. 1983. Drug resistance and distribution of conjugate R plasmids in Escherichia coli strains isolated from healthy adult animals and humans. Jpm. J. Vet. Sci. (Japón). 45: 171-178 12. KONEMAN. E. W.; ALLEN. S. D.; DOWELL, V. R.; SOMMER, H. M. 1979. The enterobacteriaceae. In: Diagnostic microbiology. Ed. by J. B. Lippincott. EE.UU. p. 55-110 13. KOPECKO, D. J. 1980. Involvement of specialized recombination in the evoIution and expression of bacterial genomes. In: Plasmids and transposons. Ed. by C. Stuttard and K. R. Rozee. Academic Press. London, G. B. p. 165-205 14. LECCE, J. G.; COLLIER. D.; CLARE, D. 1986. Effect of diet on rotavirus. Escherichia coli weanding diarrhea in pigs. In: Int. Pig. Vet. Soc. Congress, España. Charter 2. p. 138 15. LlNTON, A. H. 1977. Antibiotic resistance: the present situation reviewed. Vet. Rec. (G. B.) 1 00: 354-360 16. LlNTON, A. H. 1982. Antibiotic resistance in veterinary practice. Impractice (G. B.) 4: 13-15 17. MORIN, M.; TURGEON, D.; JOLETTE, J.; ROBINSON, Y.; PHANENF, J. B.; SAUVAGEAN, R.; BEAUREGARD, M.; TEUSCHER, E.; HIGGINS, R.; LARIVIERE, S. 1983. Neonatal diarrhea of pigs in Quebec: Infections causes of significant outbreaks. Can. J. Comp. Med. (Can). 47: 11-17 18. NABUURS, M. J. A.; VAN ZIJDERVELD. F. G.; HAAGSMA, J.; DE LEEW, P. W. 1986. Clinical and microbiological field studies on digestive tract disorders of piglets from birth to the time of weading .ln: Int. Pig. Vet. Soc. Congress. España, Charter 2. p. 157 19. PEREZ-GORRICHO. B.; BAQUERO,F. 1970. Antibiotics in feed additives in Spain. APUA. Newsletter. (Esp.) 4: 3 20. RODRIGUEZ-LEMOINE, V.; ROWBURY, R. J. 1975. Compatibility studies with the plasmid of Salmonella typhimurium L T2. Rev. Latinoamericana Microbiol. (Mex.). 17: 79-85 21. RODRIGUEZ-LEMOINE, V. 1976. Genetical and physiological studies with the pLT2 plasmid and other plasmids in strain of Salmonella typhimurium LTS. Tesis Doctoral, University of London. p. 30-80 22. ROWE, B.; THRELFALL, E. J. 1984. Drug resistance in gram-negative aerobic bacilli. Br. Med. Bull. (G. B.). 40: 68-76 23. SAlDA, K.; IKE, Y.; MITSUHASKI, S. 1981. Drug resistance and R plasmid of Escherichia coli strains isolated from pigs. slaughterers, and breeders of pigs in Japón. Antimicrob. Agents Chemother. (EE.UU.). 19: 1032-1036 24. SAUNDERS, J. R. 1984. Genetics and evolution of antibiotic resistance. Br. Med. Bull. (G. B.) 40: 54-60. 25. SOGAARD. H.; LARSEN, J. L. 1982. The susceptibili of e teropathogeni and non-enteropathogenic porcine E. coli strains to poly ixin and other antibiotic. In: Int Pig. Vet Soc. Congress. México, Charter 2, p. 1 26. STEERDS.E.;FOLTZ,E.L.;GRAVES,8.S. 1959. Anino ular plicating appratus for routine testing of bacterial susceptibility to antibi tics. Antibiotic. Chemother (EE.UU.) 4. 307 -311 27. WALTON, J. R. 1986. Antibiotics. animals and R factor in an. The Lancet (G. 8.} 11: 1300-1302 28. YANG, D. P. C.; CHANG. W. F.; CHU. R. M. 1986. Antimicrobal resistence in Escherichia coli strains isolated from scouring piglets. ln: Int Pig .Vet Soc. Congress. España. Charter 2. p. 141 29. YEOMAN. G. H. 1984. Antibiotic resistance in relation to nenonatal diarrheas of calves and piglets. Rec. Adv. Neon. Diarrhea in Farm Animals Lab.8eecha Pharmaceuticals Research Division (G. 8.). p. 29-36. (mimeo) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||