|
Veterinaria Tropical 13: 103-126.1988 REVISION BIBLIOGRAFICA ENFERMEDADES VIRALES DE CRUSTACEOS PENEIDOS CON ESPECIAL REFERENCIA AL CONTINENTE AMERICANO Julia D. Alvarez R.* *FONAIAP. Centro Nacional de Investigaciones
Agropecuarias. Recibido: octubre 4, 1988. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
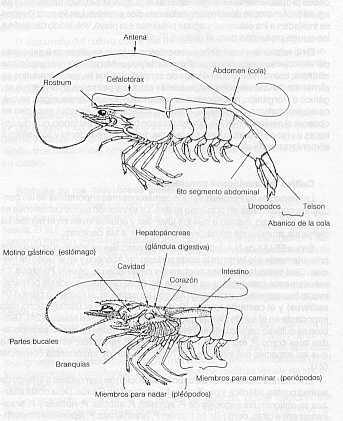
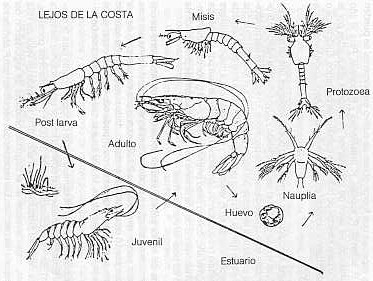
INTRODUCCIÓN Los crustáceos decápodos igualan o sobrepasan a los moluscos bivalvos en importancia como fuente alimenticia para el hombre, y los dos grupos juntos comprenden la llamada industria de los mariscos (2). El cultivo de los crustáceos peneidos se incluye en una de las dos orientaciones de la acuicultura, aquella que tiende hacia el desarrollo de especies de valor destinadas principalmente a la exportación (25). El camarón y el langostino son prioritariamente sujeto de exportación y el mercado mundial más importante de este producto radica en los EE.UU. de N.A. En vista del constante aumento de la demanda mundial de camarones peneidos, que no es abastecida por la pesca de extracción, se comenzó varias décadas atrás el cultivo de este organismo, constituyéndose Ecuador, por tener condiciones naturales ideales y por desarrollar una biotecnología adecuada y aplicable, en el primer cultivador y exportador de camarones marinos en América. Esta actividad ha podido desarrollarse por el cultivo artificial del camarón en pozas o piscinas técnicamente manejadas, con densidades de población muy elevadas (80 a 100 mil juveniles por hectárea), fertilización controlada del agua y alimentos artificiales; todo esto con el fin de incrementar la densidad/m2 de los camarones, haciendo que el cultivo sea rentable y disminuyendo el tiempo de cultivo (10, 23). En todo cultivo, y más aún en cultivos intensivos como el de los camarones marinos, un descenso en la calidad del agua y uña nutrición inadecuada son determinantes básicos en la aparición de una enfermedad. Según Sindermann (28) una enfermedad es la expresión de una interacción compleja entre el huésped, el patógeno y el ambiente; pudiendo ser el ambiente (a la vez que el hospedero) altamente anormal en muchas situaciones de cultivo. En general, una enfermedad es el reflejo de la alteración de uno o mas factores tales como: calidad del agua, niveles de oxígeno, temperatura, salinidad, presencia de contaminantes, alta densidad poblacional, nutrición inadecuada, etc. El desarrollo del cultivo comercial de camarones peneidos y langostinos ha sido acompañado por la aparición de enfermedades de etiologías tanto infecciosa como no infecciosas (D.V. Lightner, material no publicado). Muchas de las enfermedades de los peneidos son causadas, al igual que en otros organismos acuáticos, por organismos que son parte de la microflora y fauna normal de ellos, que bajo condiciones de estrés del hospedador se tornan patógenos. Considerando la creciente demanda de crustáceos peneidos, su alto valor por unidad y los esfuerzos que se hacen para producir grandes cantidades de éstos, se realizó en el presente trabajo una revisión bibliográfica de las virosis, que hasta ahora han sido reportadas a partir de crustáceos peneidos en cultivo. Biología de los crustáceos peneidos Entre los camarones marinos se encuentra un grupo de crustáceos decápodos nadadores, pertenecientes a la familia Penaeidae y al género Penaeus. Ella Figura 1 se observan caracteres anatómicos seleccionados del camarón marrón (Penaeus aztecus). Su cuerpo consta de cefalotórax y abdomen, generalmente está adaptado para nadar y tiende a estar lateralmente comprimido con un abdomen bien desarrollado. Son crustáceos con patas articuladas y un exoesqueleto duro, de un material quintinoso. Estos camarones juveniles y adultos) viven en el bentos, donde nadan intermitentemente mediante los pleópodos, que son grandes y están a menudo guarnecidos de flecos (2) Es importante hacer especial mención del hepatooáncreas (glándula digestiva), el cual es el sitio de producción de enzimas, de absorción y de almacenamiento de alimento. Esta glándula suele constar de una masa apareada muy grande y compacta que llena gran parte de la región cefalotoráxica (2). El hepatopáncreas constituye el órgano objetivo de muchas virosis de importancia para la carcinicultura. La hemolinfa, como la de los demás decápodos, posee hemocianina (cuyo elemento es el cobre) para el transporte de oxígeno; el pigmento se halla siempre disuelto en la hemolinfa, no encontrándose nunca en los tejidos (2). Todas las especies se reproducen en regiones de altas salinidades, sin embargo, cada especie se reproduce en aguas con rangos de salinidad (D. v. Lightner, material no publicado) determinada. Los camarones peneidos depositan sus huevos directamente en el agua del mar o los transportan por breves períodos. Los huevos son fecundados probablemente en el momento de la puesta. Del huevo, depositado en aguas profundas, se desarrollan varios estadios errantes. Las formas jóvenes se trasladan a los estuarios yaguas próximas a la playa, volviendo después a las aguas profundas para el desove (Figura 2). En lo referente a sus hábitos alimentarios, la larva se alimenta a expensas del vitelo; en su fase protozal se alimenta de pequeñas plantas microscópicas errantes; como misis y post-larvas de zooplancton; los juveniles y adultos se alimentan de una variedad de pequeñas plantas y animales, más detritus orgánico e inorgánico, dinoflagelados, nematodos, foraminíferos, algas, peces, caracoles, calamares, almejas, anélidos, insectos y en algunas especies se observa el canibalismo (14). Los adultos son habitantes del fondo, que duran- horas de luz se entierran para protegerse de los depredadores y sólo salen a alimentarse en la oscuridad. Cultivo de crustáceos peneidos Las especies de Penaeus son los camarones más importantes de las pesquerías comerciales en el mundo entero. La extracción de los camarones es mediante rastreo, debido a que los juveniles y adultos viven en el bentos. La demanda mundial de camarones es superior a las capturas. En los EE.UU. de N.A. los camarones comerciales se hallan concentrados primariamente a lo largo de la costa sudeste del Atlántico y en el Golfo de México. Casi, todas la especies capturadas pertenecen al género Penaeus. La valiosa pesca camaronera en el norte del Golfo de México incluye primariamente tres especies: el camarón marrón (P. aztecus), el camarón blanco (P. setiferus) y el camarón rosado (P. duorarum) siendo el último mucho más importante en el sur de Florida que en el norte del Golfo de México (24). También se cultivan camarones en Hawaii, pero basándose en especies importadas tales como P. monodon, P. stylirostris, y P. vannamei; esto es debido a que las especies naturales de esa región no son de importancia comercial (21). En América Latina se lleva a cabo la extracción de camarones a lo largo de ambas costas, atlántica y pacífica, incluyendo el Mar Caribe. De la costa atlántica se obtienen las especies de P. schmitti, P. subtilis, P. notialis y P. brasiliensis entre otras, pero sólo se cultivan P. brasiliensis, P. japonicus (importado del Japón) y P. monodon (importado de la región Indo-Pacífica). En Haití se cultiva P. monodon y en Brasil P. japonicus y P. monodon. En Venezuela se comenzó el cultivo a nivel experimental en 1974, pero a pesar de este esfuerzo y la importancia del cultivo potencial de camarones, esta actividad quedó circunscrita, hasta 1983, a la Universidad de Oriente. A pesar del éxito comercial de las granjas camaroneras en varios países latinoamericanos del área, en Venezuela los resultados obtenidos hasta ese año no lograron atraer a los inversionistas del sector estatal o privado, ya que hasta esa fecha no se podía garantizar una producción que compensara los gastos de instalaciones, materia prima, personal, alimento, etc. Una de las grandes limitaciones fue la carencia de información básica sobre la biología de las especies (6).
Entre las especies que fueron objeto de cultivo experimental se pueden mencionar P. schmitti, P. subtilis, P. brasiliensis y P. notialis. Para el año 1985, sin embargo, se sabe de importantes inversiones efectuadas por el sector privado para intentos de cultivo de camarones peneidos, autóctonos o no, esto ha sido dado a conocer en los Boletines de la Asociación Venezolana de Acuicultura. En Panamá, la acuicultura se mueve en dos direcciones, una de las cuales es la comercial la cual ejecuta el sector privado y cuyo principal rubro de producción consiste en la cría de camarones peneidos. En vista de la alta rentabilidad que ha tenido una empresa del sector público para el fomento de la cría de camarones de mar, la empresa privada también se ha interesado en este cultivo, específicamente en P. vannamei y P. stylirostris. La mayor empresa privada tiene una producción de camarones por año que está por el orden de los 1.450 kg al año, con un peso promedio de 12-18 g por cosecha; también poseen laboratorio de cría larvaria con una capacidad de producción de 35 millones de post-larvas por mes. Por parte del sector público está en construcción un laboratorio de cría larvaria que se espera llegue a producir 20 millones de post-larvas por mes. Hasta la fecha existen alrededor de 2 100 ha en la cría del camarón de mar desarrolladas por 16 criaderos. Sin embargo, dado el auge que ha cobrado esta industria, se espera una gran expansión pudiendo llegar en los próximos diez años a la incorporación de 14 000 ha a la cría de camarones peneidos (11). La producción de colas de camarón es el principal recurso para la acuicultura en el Ecuador; representa un 60% del total de exportaciones del sector pesquero (1 ). En 1983 Ecuador exportó 36.000 t de camarones peneidos, tres veces la cantidad producida en el año 1979, teniendo un valor de US$ 183 millones, convirtiéndose en el segundo producto de exportación del Ecuador después del petróleo. Las especies que se cultivan son P. stylirostris y P. vannamei. Existe una demanda estimada de post-larvas superior a los 10 billones. En la actualidad hay cuatro criaderos en operación, uno de los cuales produce 25 millones de post-larvas por mes y los otros desde 500 mil a 18 millones por mes. Para 1985 había otros seis criaderos en construcción y se planifica la construcción de muchos más ( ). Los dos grandes problemas que se presentan en este cultivo son: a) La obtención del ambiente natural requerido por hembras ovígeras, que estén fertilizadas o puedan fertilizar en el laboratorio. b) La disponibilidad de la semilla a fin de que tengan post-larvas para abastecer la constante demanda en aumento (23). Los costos de producción relativamente bajos (calculados mediante en- sayos experimentales previos) y elevado valor del producto en el mercado internacional, hicieron atractiva la producción de crustáceos penidos para los inversionistas privados en el Perú, quienes se han reunido para construir numerosas empresas langostineras (64 compañías localizadas sobre 64 km de costas con estuarios y ensenadas) en el área de Tumbes, área fronteriza con Ecuador. La producción aún está bien por debajo de la del Ecuador y Panamá, pero las compañías peruanas pueden exportar todo lo que producen. Las exportaciones anuales son de US$ 45-85 millones con un precio de US$ 10-16 por kilogramo de cola con caparazón y sin cabeza, La producción normal es de 680 kg de colas por ha/año, obteniendo algunas compañías hasta 1.360 kg al año. La tierra para los criaderos, que es salobre y de poca utilidad para la agricultura, se compra en un precio mínimo al gobierno (13). En México, el desarrollo del cultivo del camarón marino es muy prometedor, sobretodo por las miles de hectáreas disponibles para el cultivo específico de P. vannamei; esta no es la única especie susceptible de cultivo en México, también lo son P. stylirostris, P. aztecus, P. duorarum y P. setiferus, aunque estas especies prometen menos que la primera (5). Existen muchos otros países en el mundo donde se realiza el cultivo de estos crustáceos peneidos, pudiéndose mencionar Japón, donde las cantidades obtenidas por extracción son pequeñas, aun cuando la demanda es muy alta y el precio que se paga por cada camarón vivo es astronómico. Por ello, se han realizado numerosos estudios sobre la biología de la especie P. japonicus y el mejor método de cultivo para obtener gran cantidad de este producto es una menor área de desarrollo, pero las cifras de producción, obtenidas hasta 1976 (200 t de camarones comerciables) están muy por de- bajo de las expectaciones originales de una verdadera bio-industria (15). También este cultivo se realiza en la Región Indo-Pacífica: Filipinas, Taiwán, India y República Popular China, entre otros.
El gran auge que ha experimentado la industria del cultivo de camarones peneidos está acompañado por un incremento del impacto negativo que sobre el cultivo tienen las enfermedades de etiologías tanto infecciosas como no infecciosas (D. V. Lightner. material no publicado) Un organismo acuático (vertebrado o invertebrado), mantenido en condiciones de cultivo, está sujeto a variaciones de diversos factores que serán los que determinarán básicamente la aparición de las enfermedades. La importancia de éstos factores (ambientales y nutricionales, entre otros) es aún mayor en los sistemas de cultivo intensivo y semi-intensivo, debido a la naturaleza misma del sistema de cultivo, en donde se mantienen densidades muy altas por unidad de volumen de agua. Entre las enfermedades infecciosas que afectan a crustáceos peneidos se encuentran las causadas por los virus. Se han reseñado hasta ahora las siguientes virosis tres baculovirosis: (Cuadros 1 y 2) Baculovirus penaei o BP (7), necrosis baculoviral de la glándula del intestino medio (baculoviral midgut gland necrosis) o BMN (26), y baculovirosis de Penaeus monodon (P. monodon baculovirus) o MBV (20); necrosis hipodérmica y hematopoiética infecciosa causada probablemente por un picornavirus (Cuadros 1 y 3) (infectious hypodermal and matopoietic necrosis virus) o IHHNV (21); virosis hepatopancreática causada por un probable parvovirus (hepatopancreatic parvo-like virus) o HPV y dos reovirosis ambas en el hepatopáncreas de P. japonicus (4). Lightner (D.V Lightner, material no publicado) menciona tres procedimientos básicos de diagnóstico desarrollados para detectar la presencia de infecciones virales: a) Realizar exámenes directos al microscopio de preparados frescos e histopatología en infecciones severas. b) Favorecer la infección en camarones haciendo luego un examen microscópico y/o histopatología. c) Desarrollar un bioensayo con una población de camarones que se sospeche esté infectada y una especie sensible como indicador; seguido por un muestreo para la realización de un examen microscópico e histopatología. Baculovirosis Debido al desarrollo de la virología comparada ya no se considera a los virus de artrópodos como agentes diferentes de los virus que afectan otros organismos; con la notable excepción de los dos representantes de los virus incluidos: los virus de las polihedrosis nucleares y los virus de las granulosis, ahora designados juntos como Baculoviridae, tal como lo señala Wildy, citado por Kurstak et al. (16). Los dos primeras baculovirosis, BP y MBV (Cuadro 1), pertenecen a los baculovirus Tipo A debido a que producen cuerpos de inclusión; mientras que IHHNV pertenece a los baculovirus Tipo C, que no producen cuerpos de inclusión (D. v. Lightner, material no publicado). Los baculovirus están incluidos solo o en grupos en estos cuerpos de inclusión polihedrales (CIPs). Los viriones tienen forman de bastón y contienen ADN de doble banda. Las baculovirosis han atraído mucha atención en años recientes, mayormente debido a que muchos microbiólogos y entomólogos consideran que estos virus son agentes de control biológico prometedor para muchas plagas de insectos (9). En los Cuadros 1 y 2 se observan las especies de peneidos infectados por estos baculovirus y la distribución geográfica de las mismas. Baculovirus penaei (BP) Fue observado por primera vez en el camarón rosado (Penaeus duorarum) por Couch (7). Estos viriones tienen forma de bastón y se hallan libres o incluidos en CIPs. Esta nucleopolihedrosis viral es la primera en animales distintos de insectos y ácaros. Los cuerpos de inclusión polihedrales se hallan en el núcleo de las células epiteliales del acinus del hepatopáncreas (región más externa de esta glándulas y con menos frecuencia en el núcleo de las células del intestino medio en los camarones infectados. En infecciones de leves a moderadas los CIPs ocurren en focos, pero en fuertes infecciones estos se distribuyen homogéneamente. Estos CIPs son tetrahédricos o piramidales en forma tridimensional, ubicándose en la clase polihédrica con simetría cúbica. En las micrografías electronicas se observan pequeños cuerpos triangulares, debido a que seccionan sólo pequeñas esquinas de grandes CIPs, (7). Raramente más de un CIP se encuentran por núcleo, y en estos casos se han hallado cinco o seis. La estructura fina de los CIPs tiene cierta similitud con aquella de los CIPs de los insectos infectados con baculovirus. La estructura cristalina de los CIPs de los virus de camarones peneidos consiste en un vértice lineal formado por subunidades redondas, cada una de aproximadamente 11-20nm en diámetro y esparcidas en filas a 5 nm de distancia. Estas subunidades que aparecen redondas en las micrografías electrónicas son probablemente cuerpos ribonucleoproteínicos (RNP), los cuales son incorporados a los planos periféricos de ensamblaje, a partir de una gran población similar, pero de subunidades mayores (12-21 nm) en el nucleoplasma (7). Berghold, citado por Couh (7), describió subunidades similares en la polihedrosis de Bombyx mari, pero sin hacer mención de subunidades de RNP. Couch (7) presume que las subunidades de los CIPs son RNP. debido a su tamaño y forma, muy semejante a los cuerpos RNP nucleolares ya los ribosomas en el citoplasma de las células infectadas, señalando como evidencia de la naturaleza RNP de estas subunidades a la fuerte afinidad de todo el CIP por la pironina (método verde de metilo-pironina, en el cual los CIPs se tiñen de rojo brillante) y por el mercurio de bromofenol azul (donde los CIPs se tiñen de azul claro a oscuro) lo cual indica la presencia de RNA y proteina. Los viriones maduros tienen forma de bastón, con una región central densa envuelta en una nucleocápside. Ciertas micrografías electrónicas del perfil del virus revelan una estructura protruyente en el extremo de algunos viriones, dándole forma de bala. No se conoce el significado funcional de esta protrusión y puede ser solamente un artefacto de la envoltura o puede servir como un organelo de enganche en viriones maduros durante el proceso infeccioso (7).
Los camarones afectados poseen células que se encuentran en diferentes estadios del ciclo reproductivo infectivo del virus. Por lo tanto, un espectro de relaciones ultraestructurales virus-célula puede ser obtenido. Por conveniencia se describen tres niveles reconocibles de infección celular (7), estos niveles están caracterizados por los siguientes cambios morfológicos: 1. Infecciones avanzadas o evidentes, las cuales se caracterizan por lo siguiente: presencia de un CIP relativamente grande en el núcleo, deformando el perfil celular; una envoltura nuclear anormal multilaminada, entre cuyas láminas existen grandes-cisternas, y en ocasiones, en el citoplasma adyacente al núcleo, se observan vesículas que contienen viriones. 2. Infecciones intermedias donde se observa: núcleos hipertrofiados con pocos a muchos viriones no incluidos, heterocromatina ausente o marginada, nucleolos ausentes o degenerados, citoplasma lleno de ribosomas libres y el inicio de la proliferación de1as membranas de la envoltura nuclear que culmina, en infecciones más avanzadas, en un laberinto membranoso cuyo origen está en la envoltura nuclear.
El diagnóstico de esta baculovirosis puede hacerse basada en la demostración de la presencia de los CIPs en el núcleo de la células epiteliales en preparados frescos, tomados a partir del hepatopáncreas e intestino medio de los camarones y examinados al microscopio de luz. Al preparado fresco se le puede agregar verde de malaquita al 0,05-1 %, ya que al parecer los CIPs absorben este colorante más rápidamente que otros componentes celulares. Se confirma el diagnóstico con la microscopía electrónica, la cual revela la presencia de virus en forma de bastones asociados o no con Cl (17). Este virus en virtud de su tamaño, estructura, sitio de reproducción, asociación del cuerpo polihédrico y efectos citopatológicos es muy similar a los virus en género Baculovirus; sin embargo, deben hacerse mayores caracterizaciones químicas y biológicas para confirmar su relación con Baculovirus (7). Actualmente no se sabe con certeza, aunque hay cierta evidencia, de que el virus deje de causar mortalidades epizoóticas en camarones silvestres. Hay informes de pesca que indican fluctuaciones inexplicables en la abundancia del camarón rosado, las cuales ocurren regularmente en aguas del norte del Golfo de México, a partir de las cuales se han tomado camarones infectados; estas fluctuaciones podrían deberse a muchas causas, entre las que podría estar la polihedrosis (9). Se han logrado infecciones virales exitosas en el laboratorio por las siguientes vías (9) : a) Transmitiendo el virus de camarón a camarón por alimentación con hepatopáncreas infectado. b) Manteniendo camarones bajo altas condiciones de hacinamiento (con una baja incidencia viral del 0-10%) en pequeños acuarios por 40 días, 10 cual incrementa la predominancia de infecciones evidentes y probable- mente los camarones no infectados se infectan, alimentándose de despojos de camarones enfermos y por un incremento gradual de los CIPs en los sedimentos del acuario. c) Provocando el estrés químico de camarones rozados, por medio de la exposición en el laboratorio a bajos niveles de organoclorados (bifenil policlorinado), lo que puede incrementar la presencia de infecciones evidentes. Sin embargo, Couch (9), señala que la mayoría de los camarones que se encontraron infectados con CIPs y virus, en líneas generales, parecían estar saludables y es posible que bajo condiciones normales el virus sea enzoótico. Baculovirus de P. monodon (MBV) En diciembre de 1977, una población de 51 adultos (22 meses de edad, 40-90 g) de P. monodon, crecida en el laboratorio, comenzó a morir de lo que se creyó era una enfermedad causada por un protozoario con una fase secundaria bacteriana; mediante el suministro de una dieta medicada se detuvo la enfermedad temporalmente, pero en enero de 1978 solo 11 camarones habían sobrevivido. Mediante estudios histológicos, el tipo de lesión considerada como primaria se caracterizó por la presencia de múltiples Cl intranucleares conspicuos dentro de las células epiteliales del hepatopáncreas. Por microscopía electrónica se observó que los Cl estaban asociados con un baculovirus (20). Mediante microscopia de luz y microscopía electrónica puede observar- se hipertrofia de los núcleos de la célula epiteliales del hepatopáncreas y del intestino medio anterior. Estos núcleos presentan de uno a varios Cl amorfos, cuya tinción varía dependiendo de la densidad de cada uno. Estos Cl están compuestos de una matriz aparentemente amorfa y electrón densa, algunos de los cuales incluyen partículas virales y otros no. Lightner et al (21) mencionan la presencia de subunidades de 'polihedrina' que se van agregando al ensamblaje periférico de los Cl y que se observan también libres en el carioplasma. Los viriones libres o incluidos en los Cl tienen forma de bastón y poseen una envoltura relativamente delgada alrededor de una densa nucleocápside. Al igual que en Baculovirus penaei, se ha observado a partir de cortes longitudinales de muchos viriones completos, una protrusión apical y en partículas virales inmaduras o incompletas configuraciones de membrana en forma de U y C (21 ). Lightner y Redman (20) llevaron a cabo experimentos para infectar diferentes estadios de vida en distintas especies de camarones peneidos (P. monodon, P. stylirostris y P. californiensis) por exposición pero con MBV; Únicamente los P. monodon murieron. Luego de un período de 60 días de infectividad se les realizaron estudios histopatológicos a las dos especies sobrevivientes, no encontrándose patología de ningún tipo; al parecer, los estadios de vida de P. stylirostris y P. californiensis son resistentes a infecciones agudas por MBV. La fuente del virus MBV se desconoce, pero es posible que el virus se encuentre en forma latente a través de los estadios larvales, sólo para hacerse activo y causar una epizootia cuando los peneidos alcancen la etapa post-larval ( ± PL 20), etapa en la cual comienzan a aparecer señales de la enfermedad. La experiencia indica que aunque MBV sea diagnosticable a PL 20, es más seria y se diagnostica más fácil en post-larvas mayores, juveniles y adultos (21). Esta es la segunda enfermedad viral reportada en camarones peneidos y el primer informe en P. monodon. La ingestión de los virus libres o de Cl que contengan virus a partir de sedimentos de tanques o por canibalismo de los camarones muertos, parece ser, en parte, responsable junto con el estrés por hacinamiento del incremento observado en la presencia y severidad de las infecciones por MBV. El estrés causado por otras enfermedades también es un factor determinante en la patogénesis de la enfermedad MBV (21 ). Las virosis de MBV y BP se diferencian de la siguiente manera: 1. En MBV los Cl son amorfos y en BP son polihédricos. 2. El laberinto membranoso citoplasmático en MBV parece originarse del Complejo del Golgi, mientras que en BP parece que se forma con proliferación de la membrana nuclear y permanece unido a ésta en algunas áreas. 3. Los virus no incluidos de MBV no se observan proyectar de la membrana nuclear o en vesículas citoplasmáticas en cualquier estadio de desarrollo en los hepatopancreocitos, como ocurre en BP (21). El diagnóstico de la MBV se realiza de misma manera que para BP. Necrosis baculoviral de la glándula del intestino medio (BMN) En muchas granjas camaroneras en las áreas de Kuyushu y Chogoku de Japón, desde 1971 y durante de estación de crecimiento cada año, se presenta una epizootia por BMN en larvas y post-larvas de camarones Kuruma (P. japonicus). Pruebas de infectividad oral y nacida en el agua (vertical), re- velaron una alta mortalidad acumulativa en larvas saludables menores de 9 días de estadio post-larval. A pesar de que larvas mayores de 9 días también se infectaron con este virus, estas no presentaron mortalidad alguna. Los resultados histopatológicos revelaron una hipertrofia nuclear debida a una infección por baculovirus (26). Debido a que BMN es un baculovirus Tipo C, los cuales no producen cuerpos de inclusión, el diagnóstico de esta infección depende de las señales clínicas de la enfermedad, la histopatología y la demostración, por microscopía electrónica de transmisión, de este baculovirus en los hepatopancreocitos afectados ( D. V. Lightner, material no publicado), Sin embargo, Sano et al. (26) desarrollaron una técnica de tinción de anticuerpos fluorescentes, la cual es una técnica rápida de diagnóstico confirmativo para la BMN. Este virus parece ser enzoótico en poblaciones silvestres ya que sólo ha sido observado en P. japonicus en estaciones de reproducción en Japón. Picornavirosis. El virus de la necrosis hipodérmica y hematopoyética infecciosa (infectous hypodermal and hematopoietic necrosis virus) o IHHNV se observó por primera vez en Hawaii a mediados de 1981, a partir de poblaciones de P. stylirostris en cultivo; esta especie fue importada de varios establecimientos comerciales de reproducción en América (21 ). Luego de ser hallado en esta especie de peneido, IHHNV se ha encontrado infectando una variedad de otras especies (Cuadro 1 ), ya sea en forma natural o inducida experimentalmente. En esta infección se observa hipertrofia nuclear y cromatina marginada en las células de tejidos de origen ectodérmico (como epidermis, epitelio hipodérmico del intestino medio y posterior, cordón y ganglios nerviosos) y mesodérmicos (órganos hematopoyéticos, epitelio del túbulo de la glándula antenal, órgano mandibular, tejido conectivo y músculo estriado), pero no endodérmicos (como intestino medio y sus ciegos y hepatopáncreas), excepto en casos severos de infección (D.V. Lightner, meterial no publicado). Tentativamente se clasifica al IHHNV como un picornavirus por su tamaño, morfología y porque su replicación se realiza en el citoplasma (23). El IHHNV es una enfermedad de juveniles y adultos, que provoca serias epizootias en P. stylirostris y P. monodon, cultivados intensiva y semintensivamente, ocasionando mortalidades acumulativas que exceden el 90% de la población en 14 a 21 días (22). Los camarones peneidos que sobreviven a infecciones de IHHNV se convierten en portadores asintomáticos y los transmiten a su descendencia. El diagnóstico de esta infección se basa en la demostración histológica de prominentes cuerpos de inclusión intranucleares eosinofílicos y Feulgen negativos. Estas inclusiones coinciden cercanamente con las características de las inclusiones Tipo A descritas por Cowdry, citado por Lightner (D.V. Lightner, material no publicado). Como característica resaltante, se observan bandas basofílicas de cromatina en los Cl nucleares; estos cuerpos son comunes en infecciones agudas tempranas, luego su número disminuye, siguiendo la necrosis e inflamación de los tejidos. En esta infección viral el tamaño (0,05-1,0 g) parece ser un factor más importante que la edad en la determinación del inicio de la enfermedad; la primera señal de este inicio es un nado errático y no usual de individuos aguda- mente infectados: el animal lentamente nada hacia la superficie donde se mantiene o nada lentamente, se da vuelta quedando con el lado ventral hacia arriba, cesa el movimiento y se hunde hasta el fondo, allí se mantiene letárgico; esto ocurre de 4-12 horas antes de morir. Lightner (D.V. Lightner, meterial no publicado), señala que la fase aguda de la cutícula presenta parches y la musculatura es opaca. Se ha detectado la presencia de esta virosis en sistemas de cultivo geográficamente separados (Cuadro 3), esta amplia distribución quizás sea el resultado de la dificultad de detectar la infección en portadores asintomáticos, o tal vez debido a que las pérdidas por virosis en poblaciones mantenidas en lagunas sean difícil detectar (D.V. Lightner, meterial no publicado). Parvovirosis. La virosis hepatopancreática causada por un probable parvovirus (hepatopancreátic parvo-like virus) o HPV fue reconocida por primera vez en P. merguiensis en Singapur y Malasia por Lightner y Redman, citado por Lightner (D.V. Lightner, material no publicado). Adicionalmente, HPV (o un agente muy similar) fue reconocido en otras especies de Penaeus (Cuadro 1) en poblaciones silvestres cautivas o cultiva das en varios países (Cuadro 4) Los camarones con HPV mostraron señales no específicas tales como baja tasa de crecimiento, anorexia y opacidad de la musculatura de la cola. Con estas señales ocurrían altas mortalidades acumulativas de 50-100% durante los estadios juveniles (luego de un desarrollo aparentemente normal en los estadios larvales y post-larvales) en 4-8 semanas desde el inicio de la enfermedad. La lesión principal en esta enfermedad, común a todas las especies afectadas, es la necrosis y atrofia del hepatopáncreas. El diagnóstico se basa en la detección de grandes Cl intranucleares basofílicos, Feulgen positivos en los hepatopancreocitos afectados. Por microscopía electrónica se observan en las células afectadas agregaciones de partículas dentro de una sustancia base granular en los Cl. Lightner (D.V. Lightner, material no publicado), mencionó los siguientes efectos citopatológicos del HPV como similares a los señalados en parvovirosis de insectos y vertebrados: tamaño y morfología de la partícula viral, la cercana asociación del nucleolo con el Cl en desarrollo y la presencia de cuerpos intranucleares dentro de los Cl en desarrollo. Reovirosis. Tsing y Bonnami, citados por Lightner (D.V. Lightner, material no publicado).observaron en 1984 un tipo de reovirus en grandes áreas virales en el citoplasma de las células -R del hepatopáncreas de P. japonicus, enfermos y crecidos en un laboratorio de la ciudad mediterránea de Palavas, Francia. Los viriones eran partículas icosahédricas sin envoltura. Se indujo la enfermedad en P. japonicus sanos por inoculación del virus purificado y por alimentación de los animales con hepatopáncreas infectado. Esta enfermedad se desarrolló lentamente requiriendo de ± 45 días para su desarrollo. Bovo et al. (4) observaron una alta mortalidad, por 50 días, durante mayo y junio en 1983, en camarones kuruma adultos (P. japonicus) reproducidos en el laboratorio en Lesina, Italia. Entre las señales clínicas observadas en los camarones enfermos se incluyen letargia, particularmente justo antes de la muda que realizan con dificultad. La única lesión que se detectó fue una lesión tipo necrótica erosiva, localizada en los miembros toráxicos y urópodos. Se realizaron exámenes parasitológicos y bacteriológicos los cuales no revelaron ningún organismo patógeno; análisis repetidos del agua revelaron valores físicos y químicos normales. Muestras del hepatopáncreas fueron enviadas al laboratorio, en parte congeladas y en parte preservadas en glicerol al 50%, donde se usaron procedimientos estandar de rutina para detectar un posible virus. Simultánea- mente se inocularon cultivos celulares de RTG-2 y PG con extracto de material hepatopancreático homogenizado (1 :10) previamente filtrado y se incubaron a 15°C. Al cabo de 72 horas se observó un efecto citopatológico en ambas líneas celulares (ECP), muy similar al producido por el virus de la necrosis pancreática infecciosa (NPI). Mediante pruebas de inmunofluorescencia se confirmó que el virus estaba relacionado antigénicamente con el virus de la NPI. Basados en esta información, Bovo et al. (4) opinan que no se puede concluir que este virus es el responsable de las mortalidades ocurridas en P. japonicus o si causó algún efecto patológico realmente, concluyendo que es necesario realizar pruebas de patogenicidad. Otros virus (Cuadro 5) Brock, citado por
Lightner,(D.V. Lightner, meterial no publicado).
observó inclusiones virales de tipo IHHNV en P. japonicus
en el
intestino posterior y en otra región, pero estas inclusiones no estaban
asociadas con enfermedad alguna. Se ha reseñado la presencia de
partículas virales, probablemente un picarnavirus a un parvovirus, a
partir del corazón de P. aztecus (12) y de todo el cuerpo en P. japonicus
(Bonnami, citado por Lightner (D.V. Lightner, meterial no
publicado)). Ha sido aislado del hepatopáncreas de P. duorarum
un
togavirus, pero la presencia de este virus no estuvo relacionada con
enfermedad alguna (D.V. Lightner, meterial no publicado). DISCUSIÓN La virosis de los crustáceos peneidos constituyen un campo de investigación relativamente nuevo y sobre el cual queda aún mucho por entender. Los camarones infectados con cualquiera de los virus señalados hasta ahora, no presentan señales clínicas características asociadas a una dada virosis, por lo que el diagnóstico de estas infecciones se basa en la demostración microscópica e histológica de efecto citopatológicos característicos a cada virosis.
Una manera de combatir las virosis en crustáceos peneidos es previniéndolas; en el caso de las baculovirosis se debe evitar la diseminación del virus a nuevas localidades geográficas fuera del rango normal de su especie de peneido hospedera. Bajo condiciones normales, es posible que las baculovirosis de crustáceos peneidos sean enzoóticas en poblaciones locales silvestres y que tiendan a hacerse epizoóticas cuando el camarón es sujeto a cultivo (sobre todo en forma intensiva o semi-intensiva), donde factores inherentes al tipo de cultivo son, al parecer, los que crean las condiciones de estrés en las que se inician una o más enfermedades. Las
enfermedades infecto-contagiosas, especialmente las virosis y
bacteriosis, son problemas patológicos de singular importancia para la
incipiente industria de la carcinicultura a nivel mundial. Compete al
patobiólogo acuático iniciar los correspondientes programas de
investigación a fin de determinar los aspectos más importantes de la
etiología, epizootología y patología de las enfermedades virales de
los crustáceos peneidos; esto con el fin de poner a disposición del
sector productivo técnicas de diagnóstico, prevención y control, que
permitan el máximo aprovechamiento de estos recursos marinos. Este
cultivo está adquiriendo cada vez mayor importancia a nivel mundial y
por ende está atrayendo significativas inversiones financieras,
especialmente en algunos de los países en vías de desarrollo, cuyas
condiciones ecológicas son las más adecuadas para esta clase de
acuicultura. CONCLUSIONES 1. Dada la importancia de las enfermedades, sobretodo las infecto-contagiosas (de etiología viral o bacteriana) en el cultivo de camarones peneidos, el estudio de estas debe ocupar un lugar preferencial en los programas de investigación. 2. Las virosis reportadas en crustáceos peneidos no presentan señales clínicas características, por lo que su diagnóstico debe basarse en la demostración microscópica e histopatológica de la citología particular de cada virosis. 3. Las baculovirosis (y quizás otras virosis) en crustáceos peneidos, al parecer, son enzoóticas en poblaciones silvestres autóctonas; estos virus pueden causar epizootias cuando los camarones se hallan en condiciones de estrés (cosa que puede ocurrir en sistemas de cultivo). 4. Estos virus enzoóticos se hallan a densidades muy bajas en poblaciones silvestres, por lo que deben realizarse técnicas de diagnóstico adecuadas para la detección del virus en una población, y así evitar que un dado baculovirus (mediante el traslado de camarones infectados) se disemine fuera del rango original de su especie hospedera. 5. La acuicultura está estrechamente unida a la Patobiología Acuática, ya que es en los sistemas de cultivo (debido a factores inherentes en los mismo) donde se favorece la aparición de las enfermedades; siendo el patobiólogo acuático el más preparado para estudiar todo lo referente a procesos patológicos en organismos acuáticos y para recomendar y hacer cumplir normas de prevención y control de los mismos.
1. ALVAREZ, M. Informe sobre el desarrollo de la acuicultura en el Ecuador. ln: FAO. Informe de Pesca (294) supl.: 23-33. 1984. 2. BARNES. R. D. Zoología de los invertebrados. México, D. F. 3ra ed. Nueva Editorial Interamericana 1977. 826 pp. 3. BELL. T. A. and D. V. LlGHTNER. IHHN virus: infectivity and pathogenicity studies in Penaeus stylirostris and Penaeus vannamei. Aquaculture 38:185-194. 1984. 4. BOVO, G., G. CESCHIA, G. GIORGET and M. VANELLI. Isolation of an IPN-Iike virus from adult kuruma shrimp (Penaeus japonicus). Bull. Eur. Ass. Fish Pathol. 4:21. 1984. 5. CABRERA, J. A. and J. L. GARCIA. El estado de la acuicultura en México al término de 1982. In: FAO. Informe de pesca (294) supl.:42-65. 1984. 6. CERVIGON, F. (Editor) La acuicultura en Venezuela. Estado actual y perspectivas. Caracas, Venezuela. 1983. 121 pp. 7. COUCH, J. A. An enzootic nuclear polyhedrosis virus of pink shrimp: ultraestructure, prevalence, and enhacement. J. Invertebr. Pathol. 24:311-331. 1974. 8. COUCH, J. A. Viral diseases of invertebrates other than insects. In: Pathogenesis of invertebrates microbial diseases. Editor E. W. Davidson. Allanheld. Osmun Publ., Totowa, N. J. 1981. 127-1.60. 9. COUCH, J. A., M. D. SUMMERS and L. COURTNEY. Enviromental significance of Baculovirus infections in estuarine and marine shrimp. Ann. N. Y. Acad. Sci. 266:528-536. 1975. 10. DAQUI, L. E. Alimentación artificial en acuacultura. Cultivo del camarón. Revista Protinal. Agosto 1985. 11. DINMC-MIDA. La acuicultura en Panamá. In: FAO. Informe de pesca (294) supl.:96-109. 1984. 12. FOSTER, C. A., C. A. FARLEY and P. T. JOHNSON. Virus like particles in cardiac cells of the brown shrimp Penaeus aztecus Ives. J. Submicrosc. Cytol. 13:723-726. 1981. 13. GILESPIE, D. After the devasting effects of El Nino Perú restores raindamaged northern ponds. Fish Farming International. 12:4. 1985. 14. IVERSEN, E. S. Cultivos marinos: Peces, moluscos, crustáceos. Zaragoza, España. Acribia. 2da. Edc. 1982. 415 pp. 15. KORRINGA, P. Farming marine fishes and shrimps. Amsterdam. Eisevier Scientific Publishing Company. 1976. 208 pp. 16. KURSTAK, E., P. TIPSEN and K. MARAMOROSCH. Safety considerations and development problems make an ecological approach of biocontrol by viral insecticides imperative. In: Virus and environment. Proceedings 3th International Conference of Comparative Virology. Mont Gabriel, Quebec, Canada. 1977. p.571-592. 17. LlGHTNER, D. V. Virus disease of shrimps. In: Disease diagnosis and control in North American marine aquaculture. Editor C. J. Sindermann. Amsterdam. Eisevier Scientific Publishing Company. 1977. p. 14-18. 18. LlGHTNER, D. V. Diseases of cultured penaeid shrimp.ln: Mariculture. Editor J. P. McVey. Boca Raton, Florida. CRC Press. 1983. p. 289-320. Press. 1983. p.289-320. 19. LlGHTNER, D. V. A review of the diseases of cultured penaeid shrimps and prawns with emphasis on recent discoveries and development. Thesis MS (sin publicar). 56 pp. 20. LlGHTNER, D. V. and R. M., REDMAN. A baculovirus-caused disease of the penaeid shrimp, Penaeus monodon. J. Invertebr. Pathol. 38:299-302. 1981. 21. LlGHTNER, D. V., R. M. REDMAN and T. A. BELL. Infectious hypodermal and hematopoietic necrosis, a newly recognized virus disease of penaeid shrimp. J. Invertebr. Pathol. 42:62-70. 1983. 22. LlGHTNER, D. V., R. M. REDMAN and T. A. BELL. Observations on the geographic distribution, pathogenesis and morphology of the baculovirus from Penaeus monodon Fabricius. Aquaculture 32:209-233. 1983. 23. MacPADDEN, C. Ecuador develops hatcheries to supply shrimp. Fish Farming International. 12:5. 1985. 24. OVERSTREET, R. M. Marine Maladies. Worms, Germs and other Symbionts from the northern Gulf of México. Mississippi-Alabama. Sea Grant Consortium MASGC. 78-021. 1978. 140 pp. 25. PEDINI, M. (Editor). Informes nacionales sobre el desarrollo de la acui- cultura en América Latina. FAO. Informe de Pesca (294) supl. 1984. 138 pp. 26. SANO, T., T. NISHIMURA, H. FUKUDA, T. HAYASHIDA and K. MOMOY AMA. Baculoviral infection of kuruma shrimp Penaeus japonicus in the intensive culture system of Japan. First International Conference, European Association of Fish Pathologists. Plymouth, Gran Bretaña. 1983. 27. SANO, T., T. NISHIMURA, H. FUKUDA, T. HAYASHIDA, K. MOMOYA- MA. Baculoviral infectivity trails on kuruma shrimp larvae Penaeus japonicus of different ages. In: Fish and Shellfish Pathology (Editado por A. Ellis). Academic Press. Londres, Gran Bretaña. 1985. 403 pp. 28. SINDERMANN, C. J. (Editor). Disease diagnosis and control in North American marine aquaculture. Eisevier Scientific Publishing Company. Amsterdam, Países Bajos. 1977. 329 pp. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||