|
SEROTIPIFICACION DE Haemophilus (Actinobacillus) pleuropneumoniae Vitelio
Utrera*, Aura Gallardo de López**, Luis Mariño*** *Universidad
Central de Venezuela. Facultad de Ciencias Veterinarias. Recibido: abril 21, 1989. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
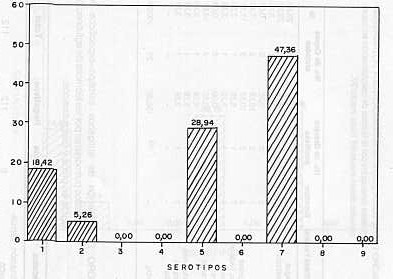
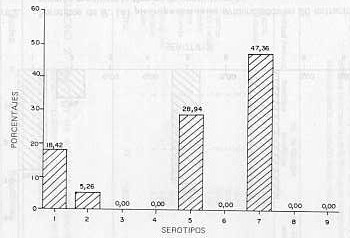
RESUMEN Se tipificaron 27 cepas de H. (A.) pleuropneumoniae mediante las técnicas de aglutinación rápida en placa y coaglutinación. En 112 extracto pulmonares examinados por la técnica de coaglutinación se evidenciaron antígenos específicos en 23,03%, obteniéndose resultados negativos cuando fueron analizados por aglutinación rápida en placa. El total de extractos di pulmón positivos y cepas tipificas fue de 38, observándose que el 47,360% perteneció al serotipo 7;28,94% al serotipo 5;18,42% al serotipo 1 y 5,26% a serotipo 2. Se estableció la distribución de los serotipos por entidades federa les.
El Haemophilus (Actnobacillus) pleuropneumoniae es un patógeno primario del tracto respiratorio del cerdo, especie en la que produce la pleuroneumonía. Esta enfermedad es de amplia distribución mundial y desde de 197 (su importancia se evidencia en numerosos informes (1,2,3,4,5,7,8,10,12,14,15,16). Para el diagnóstico definitivo de la infección originada por este agente es fundamental el aislamiento de la bacteria y su posterior serotipificación, par. que los programas de control y prevención de la pleuroneumonía porcina se apliquen racionalmente y este garantizada su efectividad, ya que la inmunidad por efecto de la vacunación es específica contra el serotipo contenido el el producto a aplicar. El conocimiento de la distribución de los distintos serotipos debe estar basado en la utilización de una técnica de tipificación rápida, económica y confiable que permita la obtención de resultados en el menor tiempo posible. En nuestro país, Gallardo de López et al. (2), aislaron 30 cepas de H. (A.) pleuropneumoniae las cuales fueron tipificadas en laboratorios de referencia internacional, lo que permitió conocer la existencia de algunos serotipos. En consecuencia, el presente trabajo se orientó hacia la caracterización antigénica de cepas H. (A.) pleuropneumoniae mediante las técnicas de aglutinación rápida en placa y coaglutinación; la detección de antígenos específicos directamente en extractos de tejido pulmonar, así como establecer la distribución de los distintos serotipos de H. (A.) pleuropneumoniae en el país, a partir de marzo de 1986 hasta 1987.
Caracterización antigénica. Veintisiete cepas de H. (A.) pleuropneumoniae aisladas en trabajo anterior (17) fueron conservadas para su serotipificación en agar cerebro-corazón (BH) (DIFCO, Lab. Machigan), adicionado de 5% de sangre de conejo. Producción de anticuerpos. Sueros hiperinmunes a las cepas de referencia de los serotipos 1 al 9 fueron producidos en conejos, según el método descrito por Mittal et al. (6). El antígeno para la inmunización de los conejos fue preparado a partir de cultivos de H. (A.) pleuropneumoniae de 5 a 7 horas en agar PPLO enriquecido. El crecimiento fue removido con una solución de NaCI 0,5 M; una alicuota fue tomada para determinación de pureza al sembrar en placas de agar BH con 5% de sangre de conejo, agar Triptosa y agar MacConkey (DIFCO, Lab. Michigan), mientras la otra fue inactivada con una solución de formaldehido al 0,3% y se mantuvo a 4°C por 72 horas. Posteriormente se inocularon dos conejos por cada uno de los nueve serotipos; comenzando con una dosis de 0,5 ml de antígeno por vía subcutánea; las subsiguientes siete inyecciones fueron administradas por vía intravenosa a razón de dos veces por semana, con dosis crecientes de 1,2 y 3 ml, siendo las últimas cuatro inoculaciones de 3 ml. Los conejos fueron sangrados siete días después de la última inyección de antígeno. Los sueros obtenidos fueron conservados a -20°C hasta su uso. Sueros hiperinmunes controles y las cepas de referencia serotipos 1 al 9 fueron gentilmente cedidos por el Dr. C. Pijoan, Universidad de Minnesota. Procedimiento de serotipificación Aglutinación rápida en placa. Se siguió el método descrito por Rapp et al. (13). Cultivos de 24 horas de desarrollo fueron inoculados en Agar PPLO enriquecido; después de incubación (4 a 6 horas) a 37°C, el cultivo fue removido con 2 ml de una solución de NaCI 0, 15M, mezclada en un vortex para obtener suspensiones homogéneas y usadas directamente para la prueba de aglutinación rápida en placa. La prueba de aglutinación en placa fue realizada mezclando cantidades equivalentes de suspensión bacteriana y anticuerpo no diluido. La rapidez y calidad de la aglutinación fue chequeada a los 4 minutos y clasificada de acuerdo con una escala de O a 4 cruces. Reacciones sospechosas, clasificadas como + fueron consideradas positivas en caso de ser las únicas observadas con el cultivo. Para las pruebas serológicas, todos los aislamientos fueron evaluados inicialmente con anticuerpos a los serotipos 1 al 7. Aquellos que no reaccionaron fueron probados con anticuerpos a serotipos 8 y 9. Prueba de coaglutinación. La cepa Staphylococcus aureus COWAN I (NCTC, 8530), donada por el laboratorio del Dr. C. Pijoan (Universidad de Minnesota), fue tratada de acuerdo con el método descrito por Mittal et al. (6). Primeramente fue sembrada en agar BH, cultivada por 24 horas a 37°C, recolectada y lavada dos veces en PBS, pH 7,4. La bacteria fue suspendida en formalina a15% en PBS, mantenida a temperatura ambiente por 3 horas, lavada una vez en PBS y ajustada a una concentración de 10% (VN). Posteriormente, la suspensión fue tratada a 80°C en baño de maría por 5 minutos, luego se le señaló 0,1 ml del anticuerpos serotipo específico a 1,0 ml de la suspensión de Staphylococcus; después de mezclar la suspensión, ésta se mantuvo a temperatura ambiente por 30 minutos y luego se lavó dos veces en PBS. Posteriormente las bacterias fueron suspendidas a una concentración óptima (10% VN) en PBS, conteniendo 0,5% de ácida sódica y 0,1% de albúmina de suero bovino. El reactivo así elaborado se conservó a 4°C. Para la ejecución de la prueba se mezcló una gota (0,05 ml) del reactivo de coaglutinación en una lámina de vidrio con un volumen equivalente de suspensión bacteriana o su extracto salino, para la detección del antígeno. La mezcla se homogenizó a fondo con un palillo, rotada manualmente y examinada contra un fondo oscuro. Una reacción positiva fue aquella que presentaba una clara aglutinación que por lo general se evidenció a los pocos segundos. El grado de aglutinación y el tamaño del agregado formado permitió clasificar el resultado obtenido de acuerdo con la escala siguiente: 0; +; ++; +++. Fue considerado como positivo un resultado de ++. Se utilizaron como controles suspensiones de Staphyloccocus no marcados, así como también suspensiones de la bacteria cubierta con suero normal de conejo. Detección
de antígenos serotipo específicos de H. (A.) pleuropneumoniae
en
extracto pulmonar.
Un trozo de pulmón de 2 g de peso se homogenizó en 3 ml
de solución salina. La suspensión salina del tejido
pulmonar fue llevada a baño de maría por 5 minutos y luego
centrifugada a 3000 x g por 15 minutos, siguiendo la metodología de
Mittal et al. (6). El sobrenadante se examinó de acuerdo con las
técnicas ya descritas para la serotipificación de cepas
aisladas. RESULTADOS DISCUSIÓN Serotipificación de cepas aisladas La caracterización serológica de 27 cepas aisladas, en el período comprendido entre marzo/86 y marzo/87 (Figura 1) demostró que el serotipo 7 fue el más frecuente (48,14%), seguido por los serotipos 5 (25,29%), 1 (22,22%), y un aislamiento perteneció al serotipo 2 (3,70%). Hubo completa concordancia en los resultados obtenidos con las técnicas de aglutinación rápida en placa y la de coaglutinación. En relación con la distribución geográfica de los serotipos, se diagnóstico el 1 y 2 en Carabobo, el 5 en Cojedes y Miranda y el 7 en Aragua, Carabobo, Distrito Federal, Falcón, Miranda, Portuguesa y Yaracuy (Cuadro 1). Detección de antígenos serotipos específicos de H. (A.) pleuropneumoniae en extracto pulmonar En 112 pulmones examinados mediante la técnica de aglutinación rápida en placa no fue posible evidenciar la presencia de H. (A.) pleuropneumoniae en los extractos de tejido pulmonar examinados (Cuadro 2). Se evidenciaron antígenos específicos de H. (A.) pleuropneumoniae en 23,03% de las muestras de pulmón por la técnica de coaglutinación. La distribución de los serotipos detectados en dichas muestras aparece en la Figura 2. El total de especímenes (extractos de pulmón y cepas) que arrojaron resultados positivos a la prueba de coaglutinación fue de 38 siendo el serotipo 7 el más común (Figura 3). Veintiséis granjas porcinas de un total de 62 resultaron positivas mediante la evaluación de los extractos de pulmón y las cepas aisladas. La distribución de los distintos serotipos de acuerdo con estos resultados se presenta en el Cuadro 3. Sin embargo, en una granja porcina del estado Aragua, con todas las evidencias clínicas y epidemiológicas, no fue posible confirmar el diagnóstico I tanto por bacteriología como por detección de antígenos específicos en extractos de pulmón. Igualmente, cuando fueron evaluadas cinco granjas del Edo. Zulia, con diagnóstico clínico de pleuroneumonía porcina, no fue posible evidenciar antígenos serotipo específicos del H. (A.) pleuropneumoniae en extractos pulmonares provenientes de cerdos sospechosos de presentar la infección.
Durante la investigación sólo en un caso se evidenció infección mixta de serotipos 5 y 7. a partir de un pulmón proveniente de un cerdo con neumonía en forma crónica.
La pleuroneumonía porcina constituye una enfermedad de indudable repercusión en la industria relacionada con este sector en nuestro país. El hecho de que el problema haya sido diagnosticado en nueve de diez estados en donde se concentra más de1 80% de la población porcina nacional, confirma tal aseveración. La distribución de serotipos de H. (A.) pleuropneumoniae en Venezuela no parece haber sufrido modificaciones sensibles de acuerdo con lo señalado por Gallardo de López et al. (2), en 1986. El serotipo 7 continúa siendo el más frecuente en nuestro país, seguido del serotipo 1. Los aislamientos de cepas pertenecientes a los serotipos 2 y 5 constituyen los primeros en Venezuela. Si se considera en forma conjunta la información inicial de Gallardo de López et al. (2) y los resultados de esta investigación, de un total de 57 cepas aisladas en el país, han sido tipificadas oficialmente 52, veinticuatro pertenecen al serotipo 7; dieciséis pertenecen al serotipo 1 , siete corresponden al serotipo 5, cuatro al serotipo 4 y 1 cepa es del serotipo 2. Los cinco aislamientos no tipificados correspondieron a cepas que no mantuvieron su viabilidad. A nivel mundial, los serotipos de más frecuencia son el 1 (Argentina, Australia, Canadá y Estados Unidos), el 5 (Bélgica, Canadá, Alemania, Holanda y Estados Unidos) mientras que el serotipo 2 es el más frecuente en Dinamarca, Italia, Japón, Suecia, Suiza y Yugoslavia (9). Francia y Venezuela, parecen ser los dos únicos países en donde el serotipo 7 es el más común (9). A diferencia de los señalado por Gallardo de López et al. (2), en el sentido que el serotipo 4 fue evidenciado en el 13,33% de los casos, en este trabajo no fue posible obtener ningún aislamiento perteneciente a dicho serotipo, lo cual se explica por el hecho de que no fue evaluada ninguna de las granjas analizadas por dichos investigadores. Aún cuando Mittal et al. (6) encontraron un 12% de infecciones mixtas de H. (A.) pleuropneumoniae (más de un serotipo en la misma muestra), en donde los serotipos predominantes fueron 1 y 5, en esta investigación tal hallazgo sólo fue evidente en el 2, 70% de los casos, en donde estaban presentes los serotipos 5 y 7 que coincidencialmente representan los serotipos con mayor frecuencia detectados en el lapso de tiempo durante el cual se realizó el estudio. En la única ocasión en que la prueba de coaglutinación no fue efectiva en evidenciar antígenos a nivel de extracto pulmonar, fue en una muestra con lesiones leves compatibles con pleuroneumonía porcina y en donde es probable que la concentración de antígeno haya sido determinante en el resultado obtenido. No obstante, Mittal et al. (6) señalan que la falta de correlación que en ocasiones puede observarse entre la técnica de aislamiento y la coaglutinación es debida a la elección de sitios diferentes para la toma de muestra en una y otra prueba. El caso en el cual el diagnóstico clínico no fue confirmado por aislamiento o detección de antígenos en extracto de pulmón, puede ser atribuido a una terapia masiva aplicada sobre dicha población, que permitió una erradicación precoz del problema, debido a que no hubo reportes de recrudecimiento posterior de la enfermedad. En tal sentido, una evaluación serológica (p.e. fijación de complemento) hubiera sido la alternativa para confirmar el diagnóstico inicial Nielsen (11 ). Con base en estas observaciones se puede afirmar la existencia de 26 granjas con diagnóstico positivo de la pleuroneumonía porcina, aun cuando en sólo 19 de ellas se logró el aislamiento bacteriano, considerando las recomendaciones de Mittal et al. (6) en el sentido de utilizar en forma conjunta los resultados obtenidos por ambos procedimientos para la puesta en práctica de las medidas de control y prevención. Es oportuno señalar que con el montaje de estas dos técnicas se puede obtener en el país la tipificación serológica del agente causal de la pleuroneumonía porcina en menos de 24 horas, lo cual contrasta con e/lapso de tiempo que conlleva la obtención de un resultado a partir de cualquier laboratorio internacional de referencia, debido a que los trámites legales pertinentes toman de 2 a 3 meses para obtener una respuesta oficial; (Luis Mariño, Wimco S.A., Maracay, Ven., comunicación personal). El alcance de este trabajo adquiere mayor trascendencia, si se considera que a nivel mundial sólo ocho laboratorios realizan serotipificación de H. (A.) pleuropneumoniae en forma rutinaria (C. Pijoan. Universily 01 Minnesota, USA, comunicación personal). Es importante señalar que con ninguna de las dos técnicas fue posible evidenciar reacciones cruzadas entre las cepas de referencia o las cepas de campo y sueros heterólogos de H. (A.) pleuropneumoniae (serotipos 1 al 9), lo cual complementa observaciones de Rapp, et al. (13), cuando evaluaron la técnica de aglutinación rápida en placa y obtuvieron resultados similares.
Twenty seven H. (A.) pleuropneumoniae were typitied by means of slide agglutination and coagglutination tests. Specific antigens were found by coagglutination technique in 26 26 out of 112 (23.03%) lung extracts whlle negative results were obtanied when tested by slide agglutination. Positive lung extracts along with typified strains exhibited antigens belonging to serotype 7 (47.36%), serotype 5 (28.94%), serotype 1 (18.42%) and serotype 2 (5.26). Serotype distribution by states was determined.
1. CHANG, G.; K., YAMAMOTO; S., KONISHI and M., AGATA. Isolation and antigenic characterization of Haemophilus parahaemolyticus from porcine pneumonia. Jap. J. Vet. Sci., 40:103-107. 1978. 2. GALLARDO de LOPEZ, A.; J., POLANCO; Y., PINEDA de MORA y F., MENDEZ de APONTE. Haemophilus (Actinobacillus) pleuropneumoniae en cerdos. Primeros reportes en Venezuela. Rev. Fac. Ciens. Vet. 33:39-48. 1986. 3. GUNNARSSON, A. Haemophilus pleuropneumoniae syn, parahaemolyticus. An antigenic and diagnostic. Thesis. Uppsala. 1980. 4. HARRINSSON, L. R.; R., Haemophilus (Actinobacillus) associated pleuropneumonia in Pennsylvania swine: A review of bateriological and pathological findings from 55 cases presented to the. Pa. Bureau of Animal Industy Lab. Vet. Diag. Buffalo, New York. 1978. 21:209-215. 5. HSU, FS.; C. N., WEING; NY. COU. and JM., KING. Pathogenecity of Haemophylus parahaemolyticus for swine. Proc. Int. Pig. Vet. Soc Cong. 4:20. 1976. 6. MITT AL, K. R.; R., HIGGINS and S., LARIVIERE. Identification and serotyping of Haemophylus pleuropneumoniae by coaglutination test. J. Clin. Microbiol. 18:1351-13354. 1983. 7. MYRLEA, P. J.; G., FRASER; P. MaC QUEEN and D. A., LAMBOURNE. Pleuropneumonia in pigs caused by Haemophilus parahaemolyticus. Aust. Vet. J. 50:225-259. 1974. 8. NICOLET, J. Sur I' hemophilose du por. I. Identification d' un agent frequent: Haemophilus parahaemolyticus. Path. Microbiol. (Brasil) 31 :215-225. 1968. 9. NICOLET, J. Haemophilus pleuropneumoniae. Bacteriology and Epidemiology. H. pleuropneumoniae Compendium. Annual Meeting ofthe American Association of swine Practitioners. Des Moines, lowa. 1985. p. 7 -11. 10. NIELSEN, R. Pleuropneumoni hos svin, fremkaldt of Haemophilus parahaemolyticus. 1. Kliniske, patologisk, anatomiske og epidemiologiske undersogeleser. Nor. Vet. Med. 22:240-245. 1970. 11. NIELSEN, R. Haemophilus pleuropneumoniae. Infection in pig. PhD Thesis. Copenhagen. 1982. 12. OLANDER. A epticemic disease swine and its causative agent: Haemophilus parahaemolyticus. PhD Thesis. University of California, Davis. 1963. 13. RAPP, V. J.; RF, ROSS and B, ZIMMERMANN. Serotyping of Haemophilus pleuropneumoniae by rapid slide agglutination and indirect fluorescent antibody tests in swine. Am. J. Vet. Res. 45:185-192. 1985. 14. SANFORD, S. E. and G. K., JOSEPHSON. Porcine Haemophilus pleuropneumoniae, epizootic in south western Ontario: Clinical, microbiological, pathological and some epidemiological findings. Can. J. Comp. Med.45:2-7. 1981. 15. SHIEFER, B.; R. E., MOFFA T; J., GREENFIELD; J. L., AGAR and J. A., MAJ- KA. Porcine Haemophilus parahaemolyticus pneumoniae in Saskatchewan. I. Natural occurrence and findings. Can J. Comp. Med. 38:94-104. 1974. 16. SHOPE, R.
E. Porcine contagious pleuropneumoniae. I. Experimental transmission,
etiology and pathology. J. Ex. Med. 119:357-368. 1964. 17. UTRERA, V.; A. GALLARDO de LOPEZ y L. MARINO. Pleuroneumonía porcina en Venezuela: Estudio clínico post-mortem y bacteriológico. Vet. Trop. 13:3-14. 1988. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||