|
Veterinaria Tropical. 15: 109-125. 1990 COMPORTAMIENTO
DE UNA VACUNA A VIRUS VIVUS MODIFICADO E. Campos*, C. Obando* y C. Pedrique* *FONAIAP.
Centro Nacional de Investigaciones Agropecuarias. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
RESUMEN La necesidad de elegir el tipo de vacuna más adecuado para el control de la rinotraqueitis infecciosa bovina condujo a la realización de un estudio comparativo de inocuidad, inmunogenicidad y excreción viral en una vacuna de virus vivo modificado (V-VVM), de uso intranasal, y una vacuna inactivada (V-VI), de uso intramuscular. El estudio de inocuidad se realizó en mautas susceptibles y vacas gestantes de alto mestizaje Hoistein. Las mautas vacunadas con V-VVM no mostraron reacciones indeseables de significación ni diferencias significativas entre las temperaturas promedio. De manera similar, las mautas vacunadas con V-VI no mostraron reacciones adversas. Por otra parte, la vacunación con V-VVM ocasionó excreción de virus vacunal e inducción de anticuerpos humorales en mautas no vacunadas. La excreción del virus vacunal se mantuvo hasta los 15 días post-vacunación. En relación con la gestación, ambas vacunas resultaron ser completamente inocuas. La inmunogenicidad se determinó con la respuesta humoral en mautas vacunadas y revacunadas con 30 días de intervalo. Se observó que la V-VVM indujo un mayor número de animales con anticuerpos, a la post-vacunación, que la V-VI, aunque estadísticamente no hubo diferencias significativas (P<0,05). Se encontraron diferencias significativas (P>0.05) en los títulos de anticuerpos a los 30 días post-vacunación, siendo mayores en las mautas vacunadas con V-VVM. Después de la revacunación, la respuesta humoral para las dos vacunas alcanzó su máxima expresión a los 7 y 15 días. La disminución de los niveles de anticuerpos fue más marcada en el grupo vacunado con V-VI. Los resultados sugieren mayor persistencia de los anticuerpos generados por la V-VVM, lo cual garantiza una mayor inmunidad humoral para el control de esta enfermedad, en especial en animales sometidos a un alto riesgo de exposición. Sin embargo, la V-VI indujo niveles de anticuerpos más altos a la revacunación. La rinotraqueitis infecciosa bovina (RIB) es una enfermedad infecto contagiosa de etiología viral, que afecta principalmente a los bovinos. Se encuentra distribuida ampliamente en el mundo y se caracteriza por una variedad de manifestaciones clínicas que incluyen afecciones de tipo respiratorio, reproductivo, nervioso y digestivo (2). En Venezuela la observación de casos clínicos compatibles con esta enfermedad y la detección de anticuerpos neutralizantes hicieron sospechar de su existencia, hipótesis que fue confirmada con el aislamiento del agente causal (18). El incremento de la importación de animales provenientes de países donde la enfermedad está presente y el de las explotaciones lecheras con manejo intensivo, ha traído como resultado un aumento en la aparición de casos clínicos, cuya sintomatología se corresponde con RIB. La prevención y el control de la RIB es un problema difícil de enfrentar en razón de su amplia distribución mundial, de la característica del agente etiológico de permanecer en estado de latencia en animales infectados ya la presencia de reservorios naturales en zonas enzooticas (13). El control de la RIB está orientado al mantenimiento de una población inmune para garantizar la ausencia de la enfermedad. Sin embargo, estos programas deben estar acompañados por medidas de higiene, manejo y aislamiento de animales infectados, las cuales contribuyen a limitar la exacerbación y la diseminación del agente etiológico (6). La inmunización de las poblaciones es obtenida por medio de la aplicación de vacunas en diferentes formas y combinaciones, no obstante, las infecciones con virus herpes no pueden ser controladas con programas clásicos de vacunación (25). Entre las vacunas contra esta enfermedad se encuentran las de virus vivo modificado para aplicación intramuscular e intranasal y las vacunas inactivadas. La vacuna a virus vivo modificado, de uso intramuscular, fue la primera en utilizarse. Estudios realizados para establecer la duración de la respuesta humoral revelaron presencia de anticuerpos hasta tres y seis años post- vacunación (1, 20). Su uso, en animales preñados, fue asociado con abortos, y en becerros susceptibles, privados de calostro, indujo la aparición de signos clínicos de la enfermedad (6). La vacuna a virus vivo de uso intranasal confiere una rápida protección, atribuible a la aparición de anticuerpos locales y a la producción de interferon( 26,28). sin embargo, los niveles de anticuerpos inducidos por esta vacuna , medidos por seroneutralizacion, son mas bajos en comparación con los de la vacuna de uso intramuscular (12). se ha comprobado la presencia del virus vacunal en las secreciones nasal es una semana después de la vacunación, lo cual hace que al animal vacunado se le considere portador y excretor del virus (12). La vacuna inactivada no ocasiona reacciones post-vacunales, a excepción de las anafilácticas; evita el establecimiento de la latencia por virus vacunal y por ende de su excreción posterior (6). Una de las principales objeciones para el uso de esta vacuna es que al no haber replicación viral no hay una estimulación adecuada del sistema inmune celular. No obstante, una mayor cantidad de antígeno y una mejor presentación de los antígenos inactivados con adyuvantes apropiados, pueden conducir a vacunas inactivadas suficientemente eficaces (13). En vista de la controversia que existe en Venezuela en cuanto al tipo de vacuna que debe ser utilizada para el control de la R18, se realizó el presente trabajo, el cual contempla un estudio comparativo de la respuesta inmunitaria y de los efectos post-vacunales conferidos por una vacuna a virus vivo y una vacuna inactivada. MATERIALES Y MÉTODOS Se utilizaron dos vacunas comerciales importadas, Una vacuna de virus vivo modificado (Aeromune-IBR/PI3R )* y una vacuna de virus inactivado (Triangle-3R)**. Se realizaron pruebas de inocuidad, inmunogenicidad y excreción viral en animales Holstein, de alto mestizaje, a los que nunca se les había vacunado contra la RIB. El ganado pertenecía a dos fincas ubicadas en el municipio Acarigua, distrito Páez del estado Portuguesa, con iguales condiciones ambiente, manejo y alimentación del rebaño. En cada una se estudió un tipo de vacuna. La finalidad de utilizar dos fincas fue la de evitar que los animales inoculados con la vacuna inactivada tuviesen contacto con los animales inoculados con la vacuna a virus vivo modificado. Prueba de Inocuidad Vacuna a virus vivo modificado Se utilizaron 20 mautas sanas de 6 a 8 meses de edad, libres de anticuerpos seroneutralizantes contra el virus herpes bovino tipo-1 (VHB-1) y 108 vacas preñadas entre 2 y 9 meses de gestación, las cuales fueron inoculadas con 2 ml de vacuna a virus vivo modificado (V-VVM) por vía intranasal, 1 ml en cada fosa nasal. El grupo de mautas se observó diariamente para considerar su estado general, temperatura corporal y secreción nasal, antes y durante seis días después de la inoculación. Las vacas, antes de la inoculación, fueron sometidas a exámenes ginecológicos para garantizar la condición y tiempo de la preñez. Además se observaron periódicamente durante seis meses para el registro de partos y/o abortos. Al final, se realizó un examen en aquellas vacas sin registro de parto o aborto. Vacuna inactivada Previo a la vacunación de mautas y vacas con vacuna a virus inactivado (V-VI), se determinó la inactivación del virus inoculando muestras de la vacuna (0, 1 ml) en 20 tubos con monocapas preformadas de línea celular Madin-Darby Bovine Kidney (MDBK), permaneciendo 5 tubos sin inocular, como control. Todas las muestras fueron objeto de cuatro pasajes antes de ser consideradas libres de virus activo. Comprobada la ausencia de virus activo en la vacuna, se inocularon 15 mautas de 6 a 8 meses de edad y 104 vacas entre 2 y 9 meses de preñez, con 5 mi de la vacuna por vía intramuscular. Las mautas fueron observadas durante los primeros siete días después de la vacunación y las vacas gestantes se evaluaron siguiendo el mismo procedimiento descrito para la vacuna a virus vivo modificado (V-WM). Prueba de Inmunogenicidad Vacuna de virus vivo modificado Se utilizó un grupo de treinta mautas sanas, seronegativas, con edades entre seis y ocho meses. Veinte de ellas fueron vacunadas y revacunadas por vía intranasal, con 30 días de intervalo, y las diez mautas restantes permanecieron sin vacunar, como controles. Antes de la vacunación los animales fueron sangrados para determinar la presencia y niveles de anticuerpos contra el VHB-1. Se realizaron sangrías a los 15 y 30 días post-vacunación. Después de la revacunación fueron realizadas sangrías durante los días 7, 15, 30, 60 y 90. Los niveles de anticuerpos se determinaron mediante la prueba de seroneutralización referida por Obando et al. (16, 17). Vacuna inactivada Se utilizaron veinte mautas sanas, seronegativas, con edades entre 6 y 8 meses de edad; quince fueron vacunadas y revacunadas con intervalos de 30 días, con 5 mi de V-VI por vía intramuscular y cinco permanecieron sin vacunar como grupo control. Las mautas fueron sangradas antes de la vacunación ya los 15 y 30 días post-vacunación. Después de la revacunación, se realizaron sangrías a los 7, 15, 30, 60 y 90 días. Prueba de Excreción Viral Esta prueba se realizó en las mautas vacunadas con la V-VVM, escogiéndose al azar ocho de ellas. La recolección de las muestras de secreciones nasales se hizo mediante el uso de hisopos estériles, inmediatamente antes de la vacunación ya los 5, 7, 15 y 21 días post-vacunación. Los hisopos se colocaron en viales de 2 dracmas con 4 ml de solución de Hank's estéril, pH 7,2, adicionada de 500 m g/ml de penicilina y 500 mg/ml de estreptomicina. Se almacenaron a -70°C. Para el aislamiento se utilizaron tubos de cultivo con monocapas preformadas, de 48 horas, de la línea celular MDBK. Se inoculó, previa filtración, 0, 1 ml de cada muestra en cuatro tubos, permaneciendo dos tubos sin inocular como controles. Las monocapas fueron observadas diariamente a través del microscopio invertido, para visual izar efecto citopático (ECP). Las muestras que no indujeron ECP fueron objeto de cuatro pasajes antes de ser consideradas negativas, y las que ocasionaron ECP, característico de los virus herpes, fueron consideradas sospechosas de contener el VHB-1. La comprobación de las cepas aisladas se realizó mediante la prueba directa de anticuerpos fluorescentes referida por Obando et al. (18). Pruebas Estadísticas Para el análisis de los resultados se utilizó la Prueba d Student y de Chi cuadrado con una probabilidad de 95%. RESULTADOS Prueba de Inocuidad En la prueba de inocuidad de la V-VVM se observó la aparición de secreciones nasales al quinto día de inoculación, alcanzando aproximadamente el 75% de las mautas. Las secreciones fueron transitorias, moderadas y de aspecto cristalino. No hubo aumentos de consideración en la temperatura corporal. El análisis estadístico no reveló diferencias significativas entre las temperaturas promedio de las mautas al día cero y durante los días subsiguientes (Cuadro 1). En la mayoría de las mautas no se observó cuadro clínico de enfermedad respiratoria; sin embargo, dos de las mautas fueron objeto de terapia con antibióticos por presentar, además de las secreciones, inapetencia y aumento de la temperatura corporal. Las observaciones realizadas en las mautas inoculadas con V-VI, no revelaron reacciones de tipo local o general. En relación con la gestación, de las 108 vacas vacunadas con V-VVM, ninguna de las 22 y 42 que se encontraban en el primero y segundo tercio de gestación, respectivamente, sufrió aborto. Sólo 1 de las 44 que se encontraban en el último tercio de gestación abortó. La V-VI, tampoco indujo aborto en las 24 y 38 vacas ubicadas en el primero y segundo tercio de gestación, respectivamente. Aunque, en 1 de las 42 comprendidas en el último tercio hubo muerte y expulsión de feto (Cuadro 2).
Prueba de Inmunogenicidad En las mautas inoculadas con la V-WM se encontró que 18 (90 %) y 20 (100%) de los animales habían desarrollado anticuerpos contra el VHB-1 , a los 15 y 30 días post-vacunación, respectivamente De igual manera se detectó, en las 10 mautas no vacunadas, que 1 (10%) y 4 (40%), desarrollaron anticuerposalos15y30dias,respectivamente, después de haberse realizado la vacunación . En relación con las mautas inoculadas con la V-VI, el resultado fue que 9 (60%) y 12 (80%) de los animales presentaban anticuerpos contra el VHB-1, alos15 y 30días post-vacunación, respectivamente Las 5 mautas utilizadas como control no desarrollaron anticuerpos con el VHB-1 durante el periodo de observación (Cuadro 3) El seguimiento de los niveles de anticuerpos en las 20 mautas inoculadas con la V-VVM, a los 15 días post-vacunación, mostró que 3 (6 %) y 5 (25 %) tenían niveles seroneutralizantes de 1/2y 1/4, respectivamente A los 30dias, 5 (25%) tenían títulos serológicos de 1/2 y 15 (75%) presentaban títulos de 1/4, mientras que las mautas vacunadas con V-VI no presentaron variación en los títulos serológicos, manteniendo valores de 1/2, a pesar de que hubo un incremento en el número de mautas que desarrollaron anticuerpo , 9 (60%) y 12 (80%) a los 15 y 30 días, respectivamente (Cuadro 4) El Análisis estadístico, mediante la prueba de Chi cuadrado, no mostró diferencias significativas entre las proporciones de animales vacunados con V-VVM y con V-VI que desarrollaron anticuerpos a los 15 y3 0 días post- vacunación, para un nivel de significancia de 0,05. Sin embargo, a los 30 días post-vacunación hubo diferencias significativas entre los títulos serológicos detectados en las mautas vacunadas encontrándose que las vacunadas con V-VVM, 15 (75%) tenían títulos de 1/4 mientras que en el grupo de !as vacunadas con V-VI ninguna superó el título de 1/2 (P 0,05).
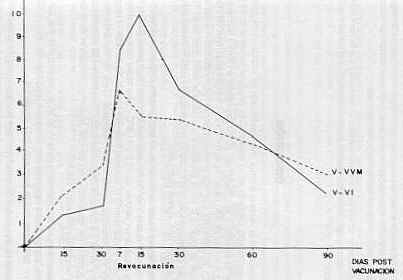
Después de la revacunación, las pruebas serológicas realizadas para medir la respuesta humoral, en las mautas inoculadas vacunadas con la V-VVM los resultados fueron los siguientes: a los siete días, en todos los animales, se detectaron títulos serológicos mayores de 1/2, encontrándose 11 (55%) 16 (30%) y 3 (15%) animales con títulos de 1/4; 1/8 y 1 /16, respectivamente. A los quince días, la distribución de los animales con títulos de 1/4, 1/8 y 1/16 fue de 15 (75%), 4 (20%) y 1(5%), respectivamente. A los 30 días se encontró que 5 de los animales (25%) disminuyeron sus títulos a 1/2, 10 (50%) tenían títulos de 1/4 y 3 (15%) títulos de 1/8. Para este mismo período 2 (10%) Presentaron títulos de 1/16. A los sesenta días se observó una disminución en los niveles de anticuerpos de las mautas, encontrándose 18 de ellas (90%) con títulos entre 1/2 y 1/4, 1 con título de 1/8 y 1 con título de 1/16. Finalmente, a los 90 días se incrementó a 19 (95%) el número de mautas con títulos menores o iguales a 1/4 y 1 (5%) con títulos de 1/8. No se encontró ningún animal con títulos mayores de 1/8. En las mautas inoculadas con la V-VI, la respuesta serológica a la revacunación fue a los siete días, de 1 (6,6%), 6 (40%), 4 (26%) y 4 (26%) animales con niveles de 1/2, 1/4, 1/8 y 1/16, respectivamente. A los quince días, 5 (33%), 6 (40%) y 3 (20%) animales tenían títulos de 1/4, 1/8y 1/16, respectivamente, sólo 1 animal presentó títulos serológicos de 1/32. Para los treinta días, igual cantidad de mautas, 7 animales (46%) mostró títulos de 1/4 y 1/8 y 1 título de 1/16. La distribución de los animales a los 60 días fue de 1 (6,6%), 2 (13%) y 10 (67%) con títulos de 1/2, 1/4 y 1/8, respectivamente. A los 90 días se incrementó a 9 (60%) el número de mautas con títulos de 1/2 y disminuyó a 6 (40%) las que presentaban títulos de 1/4 (Cuadro 5). Las pruebas serológicas efectuadas en las 10 mautas que permanecieron sin vacunar como control de la prueba de inmunogenicidad, de la vacuna de virus vivo modificado, indicaron que cuatro de ellas desarrollaron anticuerpos contra el VHB-1 después de la vacunación del lote vacunado. A los 15 días, 1 (10%) de los animales presentó título serológico de 1/2. Posteriormente, a los 30 días, 2 (20%) de las mautas tenían títulos de 1/2 y las otras 2 (20%) títulos de 1/4. A los 45 días estos animales incrementaron sus niveles de anticuerpos, encontrándose 2 (20%) con títulos de 1/4 y 2 (20%) con 1/8. A los 60 días se observó que los niveles de anticuerpos disminuyeron, alcanzando valores iguales a los encontrados a los 30 días. A los 90 días, sólo 3 mautas presentaron títulos de 1/4. Finalmente, a los 120 días, 1 de las 3 mautas disminuyó su título a 1/2 y las demás mantuvieron niveles de 1/4 (Cuadro 6). La Figura 1 muestra la evaluación de la respuesta humoral con ambas vacunas. En ella se observa que la V-VVM desarrolló mejor respuesta post-vacunación. Sin embargo, a los 7 y 15 días post-revacunación, la V-VI indujo mejor respuesta que la V-VVM. Posteriormente. se produjo un descenso en los niveles de anticuerpos para ambas vacunas, siendo mucho más marcado para la V-VI. La respuesta se igualó a los 70 días y posteriormente se observó una mayor persistencia en los anticuerpos generados por la V-VVM. Prueba de Excreción Viral En el Cuadro 6 se observan los resultados de la prueba de excreción viral realizada en las 8 mautas seleccionadas al azar, del lote vacunado con vacuna a virus vivo modificado.
No se encontró en ninguna de las secreciones nasales, recolectadas inmediatamente antes de la vacunación, presencia de VHB-1. Por el contrario, a los cinco días después de la vacunación se evidenció excreción del VHB-1 en las secreciones nasales de 6 mautas. Para el día siete, 5 de esas mautas presentaron nuevamente excreción viral, así como también una de las que anteriormente había resultado negativa. A los quince días se mantuvo la excreción viral sólo en una de las 7 mautas que habían tenido virus en sus secreciones nasales. Los resultados de las secreciones nasales procesadas a la tercera semana, post-vacunación, indicaron que no hubo excreción viral en las mautas vacunadas. DISCUSIÓN La prueba de la vacuna a virus vivo modificado es indicativa de que el VHB-1 modificado, utilizado en su elaboración, produce incremento de las secreciones nasales y lagrimales así como depresión en forma moderada. Resultados similares, con otras cepas de VHB-1 modificadas, han sido descritas (22). El hecho de que dos animales hayan requerido tratamiento con antibióticos al igual que en la experiencia realizada por Lucas et al. (12), pudiera ser consecuencia de la condición individual de esos animales o de la acción de algún otro agente patógeno. Los resultados de las mediciones de temperatura corporal indicaron, de manera general, que la V-VVM no ocasiona hipertermía, a pesar de que dos animales alcanzaron valores de 4 ,5 y 41,6°C. Estas observaciones difieren de las Sheffy y Rodmann (21), quienes utilizando una cepa de VHB-1 modificada, por vía intranasal, encontraron respuesta febril en los animales al segundo y tercer día después de la vacunación. Esta diferencia de comportamiento pudiera ser consecuencia de una menor modificación de la cepa vacunal empleada por estos autores. En relación al comportamiento de la V-VVM, en vacas gestantes, por vía intrasanal, la experiencia realizada corrobora que las cepas de VHB- 1 modificadas no interfieren con la fisiología de la gestación. Kahrs et al. (4) y Kahrs (5) concluyen que las cepas modificadas de virus de RIB, aplicadas por vía intranasal, no presentan reversión a la virulencia y en consecuencia no ocasionan enfermedades neonatales en la prole, ya sea en forma monovalente o combinadas con otros virus como el de la PI-3. La poca probabilidad de la reversión a la patogenicidad del VHB-1 modificado fue comprobada por cepa de VHB-1 modificado en bovinos, por vía intranasal. Después la inoculó en vacas preñadas susceptibles al virus de la RIB sin que se produjeran abortos. Más recientemente, Smith (23) vacunó vacas entre 5 y 8 meses de gestación y las confrontó con virus patógeno de RIB. Todas las vacas llevaron su gestación a término y parieron becerros normales, a diferencia de las vacas no vacunadas las cuales presentaron abortos, momificación de fetos, partos prematuros y/o muerte de becerros en período neonatal. En once de los doce productos de gestación afectados, se demostró presencia del virus de RIB. Heuschele (3) recomienda la aplicación de vacuna de virus vivo modificado de uso intranasal, en cualquier momento de la etapa de productividad del animal, en razón de su comprobada inocuidad. En este trabajo las mautas inoculadas con la V-VI no mostraron reacciones indeseables de tipo local o general. De igual manera, en ninguna de las vacas gestantes inoculadas con esta vacuna se determinó interrupción de la gestación, resultados estos que coinciden con otras observaciones (14, 22, 10). En relación con la inmunogenicidad, las evaluaciones realizadas para ambos tipos de vacuna, a los quince días post-vacunación, no revelaron diferencias significativas en cuanto al número de animales que desarrollaron anticuerpos contra el VHB-1, mediante la prueba de Chi cuadrado, lo que probablemente se debió a la cantidad de animales utilizados. Sin embargo, la respuesta humoral fue indicativa de que la V-VVM indujo a un mayor número de animales seropositivos, en comparación con la vacuna inactivada (90% v s 60%), lo que constituye un factor importante cuando se necesita una protección temprana, por existir alto riesgo de infección. El análisis de los niveles de anticuerpos inducidos por ambos tipos de vacuna a los 30 días post-vacunación mostró diferencias significativas con la prueba de Chi cuadrado (P 0,05), observándose que el7 4% de los animales vacunados con V-VVM alcanzaron niveles seroneutralizantes de 1/4, mientras que en los vacunados con V-VI los niveles llegaron a 1/2, lo cual sugiere que la V-VVM genera una mejor respuesta humoral. Sheffy y Rodmann (21) no consiguieron títulos serológicos a la primera inoculación con vacuna inactivada, mientras que Schipper y Kelling (22) obtuvieron títulos de 1/32 a los treinta días post-vacunación con V-VVM. Otros investigadores (7, 8, 9, 22) reconocieron que las vacunas elaboradas con las cepas de VHB-1 modificadas confieren una respuesta humoral a más corto plazo que las vacunas elaboradas con virus inactivado. De otra manera, es importante tener presente que las vacunas de virus vivo modificado de uso intranasal estimulan, además de la inmunidad humoral, la inmunidad local y celular. Steves y Heuschele (24) encontraron anticuerpos locales IgA, contra el virus de la RIB en las secreciones nasales de terneros vacunados intranasalmente, no así cuando se vacunaron por vía intramuscular. Otro aspecto a considerar es que las vacunas de virus vivo modificado inducen la producción de interferon, garantizando una protección inicial a las 40- 72 horas después de la vacunación. El interferon se detecta en las secreciones nasales del tracto respiratorio a las 40- 48 horas post-vacunación, alcanzado su máximo nivel a las 60- 72 horas y se mantiene hasta los seis u ocho días (7). Kucera (11) señala que el interferon suprime la replicación del virus de RIB, en caso de una infección de campo. La respuesta humoral a la revacunación presentó un incremento paralelo para las dos vacunas, no obstante, la vacuna inactivada exhibió un pico más elevado en comparación con la V-VVM, comportamiento que ratifica el fenómeno inmunológico caracterizado por la elevación de la respuesta inmunogénica cuando se administra un refuerzo antigénico. El descenso de los niveles de anticuerpos, después de los 15 días, fue más brusco para la V-VI que para la V-VVM llegando estos valores a igualarse después de los 60 días. A los 90 días los animales vacunados con V-VVM mostraron mayores niveles de anticuerpos que aquellos vacunados con V-VI, lo que sugiere que hay una mayor persistencia de los anticuerpos circulantes cuando se emplea la V-VVM. Otro aspecto importante a considerar es que inmunidad humoral, por si sola, no previene la infección por virus de campo y por ende el establecimiento de la condición de una infección latente. Así tampoco, que el virus infectante pueda, a través de los macrófagos; atravesar la barrera placentaria y ocasionar aborto. La presencia de animales controles que desarrollaron anticuerpos contra la RIB, en el lote vacunado con V-VVM, confirma la actividad del virus vacunal y su posterior diseminación. Aunque el porcentaje de mautas que presentó esta respuesta fue de 40%, se puede inferir que bovinos vacunados con V-VVM, por vía intranasal, establecen cierto grado de inmunización por contacto a bovinos no vacunados. La excreción del VHB-1 se detectó en la mayoría de las mautas durante la primera semana post-vacunación, de igual manera a lo reportado por Sheffy y Rodmann (21) y Lucas et al. (12). El hecho de que en una de las mautas se detectara excreción del virus a la segunda semana pareciera indicar que el período de excreción pudiera ser mayor en nuestras condiciones ambientales. Por otra parte, ha sido demostrado que los bovinos vacunados con V-VVM diseminan el virus en las secreciones nasales, orina, semen y leche, y que este fenómeno puede ocurrir en presencia de anticuerpos humorales. El virus vacunal, al igual que el virus de campo, puede persistir en los bovinos por tiempo indefinido y ser excretado (15, 21' 19). SUMMARY A comparative study between two vaccines against infectious bovine rhinotracheitis (IBR) was carried out in regard to in nocuousness. immunogenicity and viral excretion in order to determine the vaccine type to be used in control programs. A live modified virus vaccine (LMW) and an inactivated vaccine (IV) were used by intranasal and intramuscular routes, respectively. Innocuousness was performed in susceptible Holstein high breeding heifers and non pregnant cows. Non adverse effects were seen for both vaccines in heifers. Although. vaccination by LMW showed excretion of vaccinal virus and induction of humoral antibodies in non vaccinated heifers. Viral excretion was kept until 15 days post-vaccination in LMW vaccinated animals. Concerning to pregnancy, both vaccines were absolutely innocuous. Immunogenicity was evaluated by humoral response in vaccinated and revaccinated heifers 30 days after. There was shown that LMW induced a higher number of animals with antibodies in the post-vaccination period than IV did. However, non significant difference was found (P > 0,05). There were significant differences (P <: 0,05) in antibody levels 30 days post-vaccination being higher in the LMW vaccinated animals. After revaccination a humoral response for both vaccines reach the highest level at 7 and 15 days. Decrease antibody levels were stronger for IV. This study provided evidence that LMW isured a better humoral immunity for disease control specially for animals with a high risk of exposition althogh IV induced higher antibody levels at revaccination. BIBLIOGRAFÍA 1. CHOW T. L. Duration of inmunity in heifers inoculated with infectious bovine rhinotracheitis virus. J.A.V.M.A. 160: 51-54. 1972. 2. GRAN DEL, R. A. In current veterinary therapy: Food Animal Practice. W. S. Saunders Company. London. 1981. pp.543-546. 3. HEUSCHELE, W. P. Enfermedades respiratorias en los bovinos. Centro de Reproducción de Especies en Peligro de Extinción. Sociedad Zoológica de San Diego. 1988. (Mimeo). 4. KAHRS, R. F., R. S. HILMAN and J. O. TODD. Observations on the intranasal vaccination of pregnant cattle against infections bovine rhinotracheitis and parainfluenza-3 virus infection. J.A.V.M.A. 163: 437-441. 1973. 5. KAHRS, R. F. Rational basis for an inmunization program against the common diseases of the bovine respiratory tract. Can. Vet. Jour. 15: 252-256. 1974. 6. KAHRS, R. Infectious bovine rhinotracheitis: A review and update. J.A.V.M.A. 171: 1055-1064. 1977. 7. KELLING, C. L..I. A. SHIPPER and G. E. STRUM. Infectious bovine rhinotracheitis (IBR) abortion observations on ncidence in vaccinated and non-vaccinated and exposed cattle. Cornell Vet. 63: 383-390. 1973. 8. KELLING, C. L.. I. A. SHIPPER and C. N. HOUGSE. Vaccination of calves with modified line infections bovine rhinotracheitis IBR virus vaccines. North Dakota Farm Research 30: 17-19. 1974. 9. KOLAR,J. R. I. L. SCHECHMEISTER and W. G. KAMMLADE. Use in cattle of formalin-killed polyvalent vaccine with adyuvant against infections rhinotracheitis bovine viral diarrhea and parainfluenza-3 viruses. Am. J. Vet. Res. 33: 1415-1420. 1972. 10. KOONSE, H. J. and R. L. OVERPECK. Immunologic response to an adjuvanted inactivated infectious bovine rhinotracheitis parainflueza-3 vaccine with pasteurella bacterin. Fort. Dodge. Biochen. Rev. 36: 8-9. 1977. 11. KUCERA, G. J. Evaluation of the safety and efficacy of an intrasanal vaccine containing a temperatura sensitive strain of infectious bovine rhinotracheitis virus. Am. J. Vet. Res. 39: 607-610. 1978. 12. LUCAS, M. H., D. H. ROBERTS, J. H. SNAD and G. E. WESTCOTT. The use of infections bovine rhinotracheitis vacine in a commercial veal unit: Antibody response and spread of virus. Br. Vet. J. 138: 23-28. 1982. 13. LUDWIG, H. y J. P. GREGERSEN. Rinotraqueitis infecciosa bovina/vulvovaginitis pustular infecciosa: infecciones provocadas por BHV-1. Rev. Sci. Tech. off int. Epiz 5. (4): 887-895. 1986. 14. MATSUOKA,T.,T. M. FOLKERSTS and G. GALE. Evaluation in calves of an inactivated bovine rhinotracheitis and parainfluenza-3. Vaccine combined with pasteurella bacterin. J.A.V.M.A. 160: 333-337. 1976. 15. McKERCHER, D. G. and G. L. CRESHAN. Comparative efficacy of intrasanally and parenterally administered infectiones bovine rhinotracheitis vaccine. J. Am. Vet. Med. Ass. 159: 1362-1369. 1971. 16. OBANDO, C., C. PEDRIQUE y M. HIDALGO. Estudio Serol6gico de la rinotraqueitis infecciosa bovina en el Estado portuguesa-Venezuela. Veterinaria Tropical. 8: 5-20. 1983. 17. OSANDO, R. C., R. VEGAS y C. MARÍN. Reporte preliminar de la presencia del virus de la rinotraqueitis infecciosa en Venezuela. Rev. Fac. Ciens. Vets. U.C.V. (Venezuela) 31(1-4): 85-90. 1984. 18. OBANDO, A. C., N. BLANCO y C. PEDAIQUE. Primer aislamiento del virus de la rinotraqueitis infecciosa bovina en Venezuela. Rev. Fac. Ciencs. Vets. U.C.V. (Venezuela) 33(1-4). 1986. 19. ROBERTS, A., A. WAYNE, G. A. CARTEA and F. A. CARTER. Infections bovine rhinotracheitis virus recoverd from the milk of a cow with mastitis. J.A.V.M.A. 164: 413. 1974. 20. ROSMER, S. F. and STEPHEN. Infections bovine rhinotracheitis: Clinical review, inmunity and control. J. Am. Vet. Med. Assoc. 153: 1631-1638. 1968. 21. SHEFFY, B. E. and S. RODMAN. Activation of latent infections bovine rhinotracheitis infection. J. Am. Vet. Med. Ass. 163: 850-851. 1973. 22. SHIPPER, I. A. and C. L. KELLING. Evaluations of inactivated infections bovine rhinotracheitis vaccine. Can. J. Camp. Med. 39: 402-405. 1975. 23. SMITH, M. N. Efficacy of intranasal infections bovine rhinotracheitis vaccine for the prevention of abortion in cattle. Can. Vet. J. 19: 63-71. 1978. 24. STEVES, F. E. and w. P. HEUSCHELE. IBR. Abortion and its control veterinary medicine Small Animal Clinican. 161-166. 1973. 25. THIELSCHER, H. and F. HUTH. IBR/IPV: Vaccination of erradication. Animal Research and Development. 25:96-108. 1987. 26. TOOD, J. D., F. VOLONEC and I. M. PATON. Interferon in nasal secretions and sera of calves after intranasal administration of avivulent infections bovine rhinotracheitis virus: Association of interferon in nasal secretions with early resistance to challenge with virulent virus. Infect. Imm. 699-706. 1972. 27. TOOD, J. D. Development of intranasal vaccination for the immunization of cattle against infections bovine rhinotracheitis. Cam. Vet. Jour. 15: 257-259. 1974. 28. TOOD, J. D. Intranasal vaccination of cattle against IBR and PI-3: Field and laboratory observation in dairy beef and neonatal dalf populations. Cong. Internatl. Assoc. Biological Standarization 33: 391-395. 1976. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||