|
Veterinaria Tropical. 15: 57-76. 1990 INDUCCIÓN
DE INMUNIDAD PROTECTIVA CONTRA S. Montenegro-James*, M. Toro Benítez**, E. León Arenas**, B. K. Baek*, A. T. Guillén y A. López B.** *Universidad
de lllinois. College of Veterinary Medicine. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
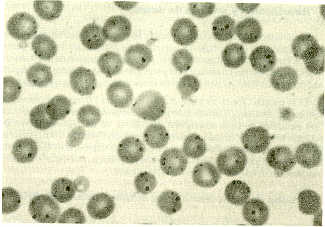
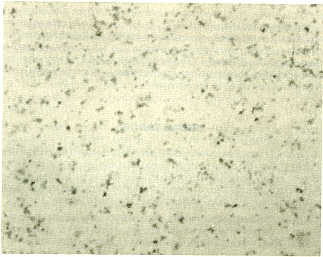
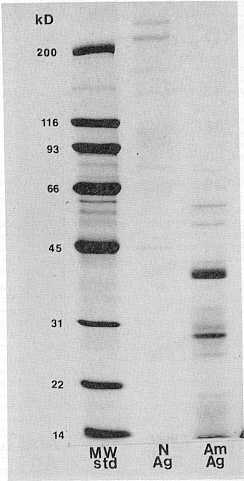
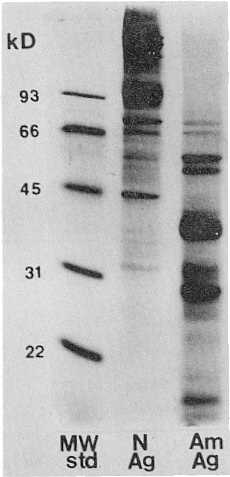
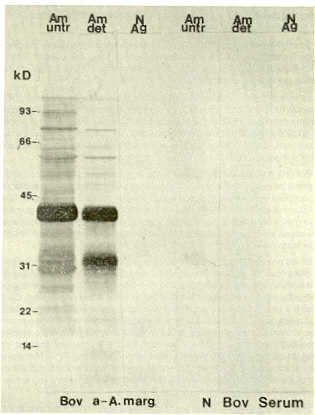
RESUMEN Se evaluó, en bovinos susceptibles, la capacidad protectiva de un inmunógeno constituído por cuerpos iniciales de Anaplasma marginale, obteni,dos de eritrocitos infectados y purificados por ultrasonicación y centrifugación diferencial. El antígeno purificado, analizado mediante la técnica SDSPAGE, mostró mínima contaminación eritrocitaria y reveló un mínimo de 12 bandas proteícas con rango de peso molecular entre 81 y15 kd. Su pureza se confirmó por la casi inexistente sensibilidad a antígenos de grupos sanguíneos en los animales vacunados. Un total de 16 bovinos mestizos se vacunaron con varias dosificaciones del inmunógeno suplementadas con Saponina Quil-A como adyuvante. El régimen de vacunación consistió de dos inoculaciones subcutáneas con cuatro semanas de intervalo. Un número similar de bovinos sin vacunar sirvieron como controles. Las respuestas de anticuerpos se midieron mediante las pruebas IFA, CA y LA. Tres meses post-vacunación, todos los animales se desafiaron con 1 X 109 organismos virulentos de A. marginale ( cepa Yaracuy , aislada en Venezuela) .Los animales vacunados mostraron una sólida protección después del reto parasitario, caracterizada por rápida eliminación de los parásitos circulantes y réducción mínima del hematocrito. Los animales controles, en cambio, sufrieron un cuadro clínico agudo con diferencias significativas en todos los parámetros clínicos-fisiopatológicos analizados. Además, el análisis secuencial por WIB de sueros de animales vacunados permitió la identificación de los antígenos más relevantes en la inducción de inmunidad protectiva. El inmunógeno bajo estudio mostró un eficiente grado de protección cruzada y, en tanto no se logre el desarrollo de una vacuna de sub-unidad contra la anaplasmosis bovina, el inmunógeno purificado (=cuerpos iniciales) de A. marginale ofrece ser una alternativa válida y promisoria a corto plazo. INTRODUCCIÓN La anaplasmosis es una enfermedad hemoparasitaria de los bovinos, transmitida por artrópodos y causada por Anaplasma marginale, miembro del orden Rickettsiales (22). La enfermedad, de amplia distribución mundial, constituye un severo escollo para el desarrollo ganadero en regiones tropicales y sub-tropicales (23). Luego de la transmisión biológica o mecánica, sigue un período latente de 3 a 6 semanas que culmina en una severa anemia asociada con eritrofagocitosis de eritrocitos infectados y no infectados (22). Durante la fase aguda de la infección puede ocurrir marcada pérdida de peso, aborto y muerte (22). Los animales que se recuperan permanecen como portadores, sirven de reservorios para la transmisión del parásito y son, en general, resistentes a manifestaciones clínicas severas en caso de re. infección (7). Sin embargo, ocasionalmente, pueden presentarse casos clínicos recurrentes de anaplasmosis (26). Estudios de ultraestructura de eritrocitos infectados con Anaplasma marginale han mostrado que la unidad infectiva (de aproximadamente 0,2 m de diámetro) se reproduce por fisión binaria, resultando en 8 a 10 cuerpos iniciales encerrados por una doble membrana que constituye el cuerpo de inclusión o cuerpo marginal, separado del citoplasma del eritrocito por una membrana limitante de origen eritrocitario (6). La incorporación metabólica de aminoácidos marcados en cultivos in vitro, de corta duración, de A. marginale ha permitido revelar, mediante análisis en gel de poliacrilamida (SDS-PAGE),la composición proteica del parásito, la cual, mostró bandas de pesos moleculares relativos entre 14 y 200 kilodalton (kd), en su mayoría insolubles en ausencia de detergentes (1 ). Además de los antígenos de Anaplasma, proteínas de la superficie del eritrocito infectado aparentemente se convierten en autoantígenos durante el proceso de la infección (15). Los métodos inmunoprofilácticos usados para la vacunación contra la anaplasmosis bovina incluyen: a) Premunición con A. marginale o A. centrale (especie menos virulenta). Con este método se puede presentar la enfermedad clínica y ocasionalmente mortalidad a consecuencia del inóculo premunizante (23). Además, la premunición establece un estado de portador perpetuando el organismo en el ambiente. b) Vacunación con una preparación inactivada de A. marginale (ANAPLAZ, Fort Dodge Laboratories, Fort Dodge, lowa, EUA), vacuna que contiene restos de estroma eritrocitario y puede inducir isoeritrólisis en becerros que reciben calostro de madres vacunadas (4). c) Uso de una cepa atenuada desarrollada por Ristic et al. (25), la cual ha sido aplicada en varios países latinoamericanos donde su utilización ha proporcionado una adaptación eficaz de ganado joven a los trópicos (23). Sin embargo, puede causar severos cuadros clínicos o muerte en toros y vacas preñadas o en lactación (16), siendo además su manejo poco práctico, por cuanto debe mantenerse en nitrógeno líquido para preservar la viabilidad del inóculo vacunal. Los problemas que la anaplasmosis causa al desarrollo ganadero y la falta de un método inmunoprofiláctico enteramente satisfactorio, indican que debe darse una alta prioridad al desarrollo de una vacuna efectiva contra dicha enfermedad (3). En el presente estudio se informa sobre la eficacia protectiva contra la anaplasmosis, en bovinos susceptibles, de un inmunógeno elaborado con cuerpos de inclusión purificados de A. marginale frente al desafío heterólogo con una cepa venezolana. MATERIALES Y MÉTODOS Obtención y purificación del inmunógeno De un bovino infectado (becerro esplenectomizado) con la cepa Florida (23) de A. marginale se recolectó en forma aséptica, al pico de parasitemia (% máximo de eritrocitos parasitados), sangre infectada usando EDTA (2,0 mg/ml) como anticoagulante. Luego de remover el plasma, los eritrocitos se lavaron en solución buffer de glicina 0, 1 M, pH = 3,0, a fin de remover los anticuerpos adheridos a la superficie de los glóbulos rojos (17). En seguida, el paquete de eritrocitos infectados se lavó tres veces en solución buffer salina fosfatada (PBS, pH = 7,4) en presencia de inhibidores de proteasas (3,5 m M tetrationato de sodio, Sigma Chemical Co., St. Louis, EUA) y timerosal al 0,01%. La capa de glóbulos blancos se eliminó completamente luego de cada lavado. El paquete celular se diluyó 1:5 en PBS y se sonicó dos veces a 20 kilociclos, a un flujo de 40 ml por minuto. El material sonicado se congeló y descongeló tres veces para asegurar una completa lisis celular; se sonicó nuevamente, se mezcló a partes iguales con PBS adicionado de 1% de nonidet-40 (detergente no iónico) y se incubó durante 3 minutosa temperatura ambiente. La separación de los cuerpos iniciales de Anaplasma se efectuó mediante centrifugación diferencial siguiendo el método descrito por McHardy y Gilson (13). La suspensión final se diluyó en solución salina balanceada de Hank (HBSS) y la concentración de proteínas se determinó por el método de Lowry (10), modificado solamente por la adición de 3,5 mM de dodecil sulfato de sodio (SDS) al buffer alcalino, lo cual permite la determinación de proteínas en una suspensión particulada. Con la finalidad de determinar su pureza, el inmunógeno corpuscular, constituido por cuerpos de inclusión de Anaplasma, fue analizado mediante los siguientes métodos: 1. Examen microscópico de frotis teñidos por Giemsa y/o Acridina Naranja. 2. Análisis comparativo en gel de poliacrilaamida (9) frente a un antígeno control, preparado en forma similar, utilizando eritrocitos no infectados. 3. Producción de isoanticuerpos o reactividad inmunológica frente a antígenos de grupos sanguíneos de bovinos*.(*Análisis realizado en el Laboratorio de Tipificación de Grupos Sanguíneos Bovinos de la Universidad de Ohio, con sueros recolectados después de la segunda dosis vacunal.) Análisis antigénico Todas las preparaciones antigénicas se analizaron mediante el método de electroforesis en gel de poliacrilamida con dodecil-sulfato de sodio (SOS-PAGE) en condiciones de reducción (9), utilizando geles que contenían 10% de poliacrilamida o concentraciones gradientes de 7 ,5% a 17 ,5% de poliacrilamida. La transferencia de las proteínas, separadas mediante electroforesis a nitrocelulosa de 0,45m (Bio-rad) para la identificación de los antígenos de mayor relevancia, fue realizada de acuerdo con la técnica de Western Immunoblotting (WIB) recomendada por Tsang et al. (27), empleándose varias preparaciones antigénicas que fueron reveladas con sueros patrones recolectados de los animales experimentales. Pruebas de vacunación Se realizaron dos experiencias vacunales consecutivas. En el experimento No.1 se utilizaron 12 animales adultos mestizos, susceptibles a anaplasmosis, divididos en 3 grupos de 4 animales cada uno. El grupo I recibió 1 ,5 mg de proteínas de cuerpos de inclusión no viables/dosis. El grupo II recibió 1,0 mg de proteínas/dosis y el grupo III permaneció como control no vacunado. El inmunógeno se suplementó con 3,0 mg de Saponina Ouil A- como adyuvante/dosis y se administró por vía sub-cutánea, en dos dosis con 30 días de intervalo. Tres meses después de la vacunación, todos los animales se desafiaron con sangre fresca que contenía 1 x 109 eritrocitos parasitados (EP) de un "aislado" virulento de A. marginale (cepa Yaracuy). En el experimento No.2, 12 bovinos mestizos jóvenes, se dividieron en 3 grupos de 4 animales cada uno, los cuales recibieron 1,0 mg de proteína/dosis (grupo 1), 0,1 mg de proteína/dosis (grupo II) y controles sin vacunar (gru- po III). El desafío o reto parasitario se efectuó a los 31/2 meses post-vacuna- ción con 1 x 109 EP de u na cepa venezolana de A. marginale ( cepa Yaracuy) . Recolección y análisis de datos Durante todo el curso de las pruebas se analizaron los siguientes parámetros: parasitemia (porcentaje de eritrocitos parasitados en frotis delgados teñidos por Giemsa), hematrocito, peso corporal y respuesta de anticuerpos, medida mediante las pruebas de inmunofluorescencia indirecta (IFA), Aglutinación Capilar (CA) y Aglutinación en Latex (LA). En la prueba LA se utilizó una concentración de 1,0 mg de proteínas de suspensión de cuerpos de inclusión purificados de Anaplasma, para sensibilizar partículas de latex polystyrene de 0,86m m de diámetro, libres de surfactantes y modificadas por carboxyl (Interfacia Dynamic Corp., Portland, OR) de acuerdo con el método descrito por Montenegro et al. (14). La significancia estadística de la diferencia entre los promedios de los grupos experimentales se determinó por la prueba "t" student. Prueba de hipersensibilidad cutánea retardada (HCR) Como indicativo de la inmunidad celular inducida, en relación con los componentes parasitarios y eritrocitarios del inmunógeno, se estableció una prueba de reacción intradérmica en un grupo de 16 animales mestizos vacunados, utilizando las siguientes mezclas antigénicas: a) Cuerpos de inclusión purificados (n = 4) b) Cuerpos de inclusión purificados adicionados de Saponina (n = 4) c) Saponina (n = 4) d) Antígeno de eritrocitos no infectados (n = 4) Los antígenos se inocularon en volúmenes de 0,1 ml por vía intradérmica, a los 4 meses post-vacunación. Las reacciones dérmicas se examinaron a las 6, 24, 48 y 72 horas post-inoculación y el engrosamiento cutáneo se midió con un vernier, registrándose la diferencia con el grosor normal de la piel, medido previamente. RESULTADOS La sangre infectada se recolectó cuando la parasitemia alcanzó un 87% (Figura 1) y un 16% de hematocrito. Luego de la lisis celular y centrifugación diferencial, se obtuvo una suspensión de cuerpos de inclusión que al examen microscópico, mediante coloraciones de Giemsa o Acridina Naranja, reveló estar relativamente libre de contaminación eritrocitaria (Figura 2). Las Figuras 3 y 4 representan el análisis proteico en gel es de poliacrilamida de los cuerpos de inclusión purificados y antígeno control, gel gradiente (7,5% a 17,5%) y gel al1 0%, respectivamente, mediante la técnica SDSPAGE. El perfil antigénico del antígeno de Anaplasma purificado mostró proteínas con rango de peso molecular entre 81 y 16 kilodalton (kd).
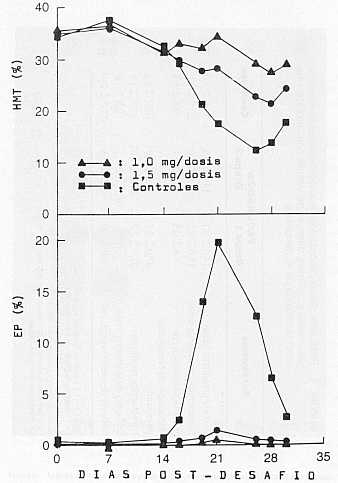
En contraste, el antígeno eritrocítico control mostró polipéptidos que flucturaron entre 200 y 14 kd. Escasas proteínas de glóbulo rojo co-emigraron con proteínas de la preparación antigénica de Anaplasma, correspondiendo la mayoría de las proteínas observadas en los cuerpos de inclusión a proteínas del parásito. Se identificaron, por lo menos, 12 proteínas en gel gradiente con cinco bandas predominantes con pesos moleculares de 65 kd, 58 kd, 44 kd, 38 kd y 28 kd (Figura 3). Un perfil similar se observó en gel de 10% de poliacrilamida con las principales bandas a 38 kd, 28 kd y 15 kd (Figura 4). La pureza de los cuerpos de inclusión de Anaplasma se confirmó por la ausencia de reactividad (prueba WIB) del suero vacuna! frente al antígeno de estroma eritrocitario (control), en la cual los antígenos presentes en la preparación de cuerpos de inclusión purificados son fuertemente reconocidos por el suero anti A. marginale post-vacunal, no presentándose ninguna reacción con el antígeno control ni con el suero bovino normal (Figura 5). Por otra parte, los títulos de isoanticuerpos (anticuerpos medidos contra un panel de antígenos de grupos sanguíneos bovinos) de sueros recolectados después de la segunda dosis vacunal resultaron poco significativos (títulos máximos de 1:16 a 1:32 y 1:32 a 1:64 para factores de grupos sanguíneos A4 y V, respectivamente). Tampoco se observó reacción de hipersensibilidad cutánea en animales vacunados frente a la inoculación intradérmica de antígeno eritrocitario. En las pruebas de vacunación, la protección se determinó basándose en las diferencias en período pre-patente, duración y máximo porcentaje de parasitemia, reducción del hematrocito, duración de la anemia y ganancia de peso entre los grupos experimentales (vacunados versus controles). En el Cuadro 1 se muestran los resultados del experimento No.1. Los animales vacunados manifestaron una fuerte protección al desafío heterólogo con una cepa virulenta de A. margina/e, en tanto que todos los animales controles presentaron enfermedad clínica severa con diferencias significativas en todos los parámetros clínico-fisiopatológicos analizados. Sin embargo, el mejor grado de protección se observó en bovinos vacunados con dosis de 1,0 mg, siendo lo más notable el eficiente control de las parasitemias y la mínima reducción del hematocrito (Figura 6). En el experimento No.2 se analizó la eficacia de los cuerpos de inclusión purificados de Anaplasma en dosis de 1,0 y 0,1 mg de proteína, en animales jóvenes mestizos desafiados, al igual que en la experiencia anterior, con cepa heteróloga (A. marginale/Yaracuy). Todos los animales vacunados mostraron diferencias significativas respecto a los valores registrados en el grupo control, con un período prepatente prolongado y rápida eliminación de los parásitos circulantes (Cuadro 2). Más aún, 2 animales (uno en cada grupo vacunal) no presentaron eritrocitos parasitados en todo el período de observación post-desafío. No hubo diferencias significativas en la capacidad protectiva de las dosis utilizadas (1,0 mg versus 0, 1 mg).
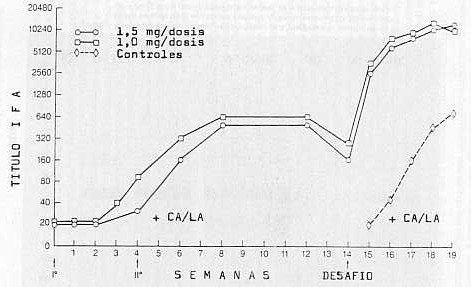
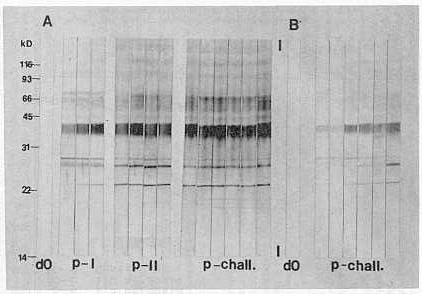
En la Figura 7 se muestra la respuesta de anticuerpos durante los períodos post-vacunal y post-desafío en bovinos del experimento No.1. A las tres semanas post-primovacunación se observó una respuesta específica de anticuerpos a la prueba IFA en todos los animales vacunados, en tanto que la respuesta a las pruebas CA y LA se hizo patente solamente después de la segunda dosis vacunal. El pico de anticuerpos IFA se observó entre tres y cuatro semanas después de la segunda dosis vacunal (1 :640). No se observaron diferencias en los niveles de anticuerpos en respuesta a las diversas dosis vacunales. Después del desafío, se notó una evidente respuesta humoral de tipo anamnésico con un pico de anticuerpos a las cuatro semanas post-desafío (1 :10240). En la Figura 8 se muestra una típica reacción WIB con anti-suero recolectado secuencialmente de un animal vacunado. Alrededor de 14 bandas proteicas son reconocidas por el suéro solo 12 días post-primovacunación. El número de bandas y su intensidad aumentaron con el refuerzo vacunal, haciéndose aun más intensas después del desafío. En contraste, solamente cinco bandas de escasa intensidad se observaron en sueros obtenidos de un animal control. La reacción de hipersensibilidad cutánea (RHC) como una manifestación in vivo de la respuesta inmuno-celular fue evidente en bovinos que recibieron inyecciones intradérmicas del inmunógeno completo (antígeno corpuscular de A. marginale más adyuvante) con un promedio de engrosamiento dérmico de 29 m m y 32 m m a las 24 y 48 horas, respectivamente. El grupo de bovinos vacunados que recibió sólo saponina mostró un pequeño engrosamiento de 12 y 14 m m a las 24 y 48 horas, mientras que no hubo reacción en el grupo vacunal inoculado con estroma eritrocitario y reacción mínima en bovinos que recibieron cuerpos de inclusión de Anaplasma solamente (2 m m a las 24 y 48 horas). DISCUSIÓN El desarrollo de un método inmunoprofiláctico eficaz, práctico y seguro contra la anaplasmosis ha sido durante años la meta de muchas investigaciones. Sin embargo. las vacunas logradas hasta la fecha presentan serios inconvenientes y/o desventajas (4, 16.23). En nuestras experiencias se evidenció una fuerte protección en bovinos susceptibles frente al desafío con organismos virulentos de A. marginale, inducida mediante cuerpos de inclusión purificados de Anaplasma adicionados de un potente adyuvante (Saponina Ouil-A). Los resultados obtenidos confirman hallazgos previos en relación con la capacidad protectiva de los cuerpos de inclusión contra la anaplasmosis bovina (5. 17).
Por otra parte, la casi inexistente producción de isoanticuerpos y las diferencias significativas observadas entre vacunados y controles, hacen pensar que es posible desarrollar en este sentido una vacuna eficaz y segura. Una importante consideración para el uso efectivo de cuerpos iniciales de A. marginale como inmunógeno sería su capacidad de protección cruzada ya que es sabido que existen diferencias entre cepas (12, 21 ),Sin embargo, también se ha demostrado que existen epítopes comunes (20). El desarrollo de un grado eficiente de protección cruzada, mostrado cuando bovinos vacunados con inmunógeno proveniente de la cepa Florida de A. marginale se desafiaron con una cepa virulenta heteróloga (cepa Yaracuy), indicó la existencia de antígenos protectivos comunes entre las cepas utilizadas. La cepa Florida de A. marginale, seleccionada como fuente de antígeno en este trabajo, mostró poseer proteínas de membrana comunes, como mínimo, a otros 12 aislamientos del parásito (12, 18), incluyendo tipos morfológicos diferentes de Anaplasma (P. caudata) (21) y ser, además, la cepa de mayor capacidad protectiva cruzada entre todos los "aislados" de A. marginale estudiados (8, 21, 23, 28). Aparentemente no hubo protección adicional al incrementar la dosis vacunal y los niveles de anticuerpos IFA, indicativos de la respuesta inmune, resultaron esencialmente los mismos en los diferentes grupos vacunados. Se concluye, en consecuencia, que la dosis mínima necesaria para inducir una inmunidad protectiva eficiente pudiera ser aún menor que 0,1 mg de proteínas de cuerpos iniciales de A. marginale. El uso de Saponina Ouil-A como adyuvante para la estimulación de la respuesta inmune, tanto humoral como celular, fue también un instrumento esencial en la eficiencia del inmunógeno de A. marginale. Su eficacia como potenciador de la respuesta humoral y celular con antígenos de superficie ha sido probada en una variedad de vacunas parasíticas (2, 11, 24, 29). Para controlar y/o prevenir la anaplasmosis bovina, lo más eficiente sería la utilización de una técnica inmunoprofiláctica, siempre y cuando se disponga de un inmunógeno seguro y eficiente. Aunque ya se han identificado antígenos de superficie, comunes y con capacidad protectiva (18, 19,20, 21)con miras al desarrollo de una vacuna de sub-unidad, aún es necesario un largo período de investigación antes de que su aplicación práctica pueda hacerse efectiva, y hasta tanto no se logre dicho objetivo, el uso de inmunógenos purificados (cuerpos iniciales) de Anaplasma ofrece una prometedora alternativa a corto plazo. SUMMARY Protective capacity of an Anaplasma margínale initial bodies immunogen, obtained from infected erythrocytes and purified by ultrasonic disruption and differential centrifugation, was evaluated in susceptible cattle, SDS-PAGE analysis demostrated minimal erythrocytic contamination and revealed at least 12 proteins in the molecular weight range of 81 to 15 kd. Further confirmation of antigen purity was indicated by the negligibe reactivity to bovine blood groupantigens post-vaccination. Sixteen crossbred cattle were vaccinated with several dosages of immunogen supplemented with Quil-A saponin adjuvant in a regime of two subcutaneous injections given at a four week interval. A similar number of unvaccinated cattle remained as controls. Antibody responses were measured by the IFA, CA and LA tests. Three months after vaccination, all cattle were needle-challenged with 1 x 109 virulent A. marginale organisms of a Venezuelan isolate (Yaracuy strain). All vaccinated animals showed solid protection after challenge exposure, characterized by parasite clearance and minimal PCV reductions, whereas control animals suffered acute clinical disease with significant differences in all the clinico-pathophysiologic parameters analyzed. Moreover, western blotts of sequential serum samples identified the antigens most relevant for the induction of protective immunity. Anaplasma immunogen showed an efficient degree of cross-protection and, until optimal sub-unit vaccines against bovine anaplasmosis are developed, the use of an immunogen of purified initial bodies offers a promising and valid alternative to short term. BIBLIOGRAFÍA 1. BARBET, A. F. et al. Comparison of proteins synthesized by two different isolates of Anaplasma marginale. Infection and Immunity 40: 1068-1074. 1983. 2. BOMFORD, R. Adjuvants for anti-parasite vaccines. Parasitology Today 5: 41-46. 1989. 3. BOSTID. Priorities in biotechnology research for international development (Board on Science and Technology for International Development, National Research Council), National Academic Press, Washington, D.C. 1982. 4. DENNIS, R. A. et al. Neonatal immunohemolytic anemia and icterus of calves. Journal of the American Veterinary Medical Association 156: 1861-1863. 1970. 5. HART, L. T. et al. Use of Anaplasma marginale devoid of host cell antigen as a vaccine for anaplasmosis. In: Proceedings of the 7th National Anaplasmosis Conference. Eds. Hidalgo R. J. and Jones E. W. Mississippi State University Press, Mississippi. 1981. p. 491-504. 6. KOCAN, K. et al. Ultrastructural localization of Anaplasma antigens (Pawhuska isolate) with ferritin-conjugated antibody. American Journal of Veterinary Research 39: 1131-1135. 1978. 7. KUnLER, K. L;and R. A. TODOOROVIC. Techniques of premunization for the control of anaplasmosis. In: Proccedings of the 6th National Anaplasmosis Conference, Stilwater, Oklahoma. 1973. p. 106-125. 8. KunLER, K. L., J. I. ZAUGG and L. W. JOHNSON. Serologic and clinical response of premunized, vaccinated and previously infected cattle to challenge exposure by two different A. marginale isolates. American Journal of Veterinary Research 45: 2220-2223. 1984. 9. LAEMMLI, V. Cleavage of structural proteins during the assembly of the head of bacteriophage T 4. Nature 227: 680-685. 1979. 10. LOWRY, O. et al. Protein measurements with the folin-phenol reagent. Journal of Biology and Chemestry 193: 256-261. 1951. 11. McCOJM, A. A., R. BOMFORD and L. DAL TON. A comparison of saponin with other adjuvants for the potentiation of protective immunity by a killed plasmodium voe1ii vaccine in the mouse. Parasite Immunology 4: 337-347. 1982. 12. McGUIRE, T. C. et al. Detection of common and isolate restricted anti- gens of Anaplasma marginale using monoclonal antibodies. Infection and Immunity 45: 647-700. 1984. 13. McHARDY, N. and C. GILSON. An electron microscopic study of diagnostic antigens antigens prepared from Anaplasma marginale. Tropical Parasitology 25: 11-14. 1974. 14. MONTENEGRO-JAMES. S. et al. Utilization of culture-derived soluble antigen in the latex agglutination test for bovine babesiosis and anaplasmosis. Veterinary Parasitology +: 291-297. 1981. 15. NORDELO, M. A. and MISER-CALDENTEY. Abnormal bovine erythrocyte membrane proteins and glycoproteins during and after infection with Anaplasma margínale. Biochem. Biophys. Res. Comp. 104: 664-672. 1982. 16. NORMAN, B. Treatment and control of anaplasmosis: An overwiew. In: Proceedings of the7th National Anaplasmosis Conference. Eds. Hidalgo, R. and E. W. Jones. Mississippi State Universjty Press, Mississippi. 1981. p. 543-555. 17. PALMER, G. H, and T. C. McGUIRE. Immune serun against Anaplasma marginale initial bodies neutralizes infectivity for cattle. Journal of Immunology 133: 1010-1015. 1984. 18. PALMER, G. H. et al. Immunization with an isolate-common suface protein, protects cattle against anaplasmosis. Science 231 : 1299-1302. 1986. 19. PALMER, G. H. et al. Detection of an Anaplasma margínale common surface protein present in all stages of infection. Journal of Clinical Microbiology 23: 1078-1083. 1986. 20. PALMER, G. H. et al. Recognition of conserved surface protein epitopes on Anaplasma margínale and Anaplasma margínale isolates from Israel, Kenya and the United States. International Journal of Parasitology 18: 33-38. 1988. 21. PALMER, G. H. et al. Immunization of cattle with a 36-kilodalton suface protein induces protection against homologous and heterologous Anaplasma margínale challenge. Infection and Immunity 56: 1520-1531. 1988. 22. RISTIC, M. Bovine anaplasmosis . In: Parasitic Protozoa. Ed. J. P. Kreier Academic Press, Inc., New York, 1977. p. 235-249. 23. RISTIC, M. and C. A. CARSON". Methods of immunoprophylaxis against bovine anaplasmosis with emphasis on use of the attenuated Anaplasma margínale vaccine.In: Immunity to Blood Parasites of Animals and Man. Eds. L. H. Miller J. A. Pino and J. J. McKelvey. Plenum Publishing Corp., NewYork. 1973. p.151-188. 24. RISTIC, M. and S. MONTENEGRO-JAMES. Immunization against Babesía. In: Babesiosis of Domestic Animals and Man. Ed. Ristic, M. CRC Press, Inc. Boca Ratón, Florida. 1988. p. 163-169. 25. RISTIC, M., S. SIBINOVIC and C. J. WEL TER. An attenuated Anaplasma margínale vaccine. Proceedings ofthe US Livestock Sanitary Association 72: 56-69. 1968. 26. SWIFT, B. L. and G. M. THOMAS. Bovine anaplasmosis: Elimination of the carrier statewith injectable long-acting oxytetracycline. Journal of the Veterinary Medical Association 183: 63-65. 1983. 27. TSANG, V. C. W., J. M. PERALTA and A. R. SIMONS. Enzyme-linked immunoelectrotransfer blott techniques (EITB) forstudying the specificities of antigens and antibodies separated by gel electrophoresis. Methods in Enzymology 92: 377-391. 1983. 28. VIZCAINO, O. et al. Comparison of three methods of immunization against bovine anaplasmosis: evaluation of protection affored against field challenge exposure. American Journal of Veterinary Research 41 : 1060 - 1068. 1980. 29. WELLS, P. W. et al. Immunization of cattle with a variant specific surface antigen of Trypanosoma brucel: Influence of different adjuvants. lnfection and Immunity 36: 1-10. 1982. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||