Veterinaria Tropical 16: 43-54. 1991 LEPTOSPIROSIS EN UN REBAÑO DE BOVINOS LECHEROS EN EL ESTADO ARAGUA. II. AISLAMIENTO, CARACTERIZACIÓN DE LINFOCITOS B y MACRÓFAGOS L. Aidorevich* y A. Soyano** *FONAIAP |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
RESUMEN Se determinó la proporción de linfocitos B y macrófagos en sangre periférica de bovinos serológicamente positivos a leptospirosis, mediante gradiente de centrifugación con Ficoll-paque, y el rendimiento se determinó en cámara de Newbauer y coloración con cristal violeta. Se identificaron como linfocitos B todas aquellas células con inmunoglobulinas de superficie (lgs), empleando un conjugado anticadenas livianas elaborado en conejo y marcado con isotiocianato de fluoresceina y como macrófagos todas aquellas células fagocíticas con capacidad de ingerir perlas de latex. Se seleccionó un grupo de 34 mestizos de Hoistein los cuales fueron agrupados por edades jóvenes y adultos) y según el examen serológico de leptospirosis (negativos y positivos). En los dos grupos de edad se obtuvieron las siguientes proporciones, para jóvenes y adultos, respectivamente: linfocitos aislados mediante te Ficoll-paque, 73,3 y 78,5%; linfocitos B, 28,2 y 23,9% y células fagocíticas, 6,5y 7,7%. El grupo de bovinos con serología positiva a leptospirosis también fue agrupado por edad y los resultados para jóvenes y adultos, respectivamente; fueron: linfocitos aislados mediante Ficoll-paque, 82,2 y 66,6%; linfocitos B, 30,8 y 26,6% y células fagocíticas, 5,8 y 7,8%. El análisis estadístico resultó significativo (P<0,05) para la proporción de linfocitos B de los jóvenes, superior a la de adultos. En los bovinos positivos a leptospirosis no se obtuvieron diferencias significativas entre ambos grupos etarios. INTRODUCCIÓN La defensa del organismo se establece mediante la interacción coordinada de diversos sistemas y mecanismos tanto específicos (el sistema linfoide y sus productos) como no específicos (el sistema fagocitario y diversos elementos de la respuesta inflamatoria, etc.), que tienen como función primordial la protección del individuo contra agresiones provenientes del medio ambiente externo, en especial las inducidas por microrganismos patógenos o del ambiente interno, representadas fundamentalmente por proliferaciones neoplásitas malignas. La respuesta inmunitaria contra un antígeno se produce por influencia de varias subpoblaciones celulares, entre las cuales se encuentran los linfocitos y los monocitos; estos reconocen el antígeno y responden a un determinante antigénico específico y la respuesta de esta célula antígeno sensitiva puede resultar en la producción de anticuerpos o en la producción de células que participan en la respuesta inmunitaria mediada por células. El desarrollo de inmunidad mediada por células o de inmunidad humoral es regulada por una serie de interacciones esenciales entre macrófagos, células T y B. Las interacciones reguladoras entre los constituyentes del sistema inmunitario pueden manifestarse por amplios límites que van desde la intensificación hasta la supresión de las respuestas inmunitarias (16,18). Los métodos utilizados para identificar poblaciones de linfocitos son diferentes, uno de ellos es la determinación de inmunoglobulina en su membrana plasmática, de los linfocitos, la cual se detecta empleando el marcador anti-lg. Sin embargo, un gran rango de valores han sido reportados por los diferentes investigadores debido a diferencias en los procedimientos de marcaje con anti-lg (7, 13). Muller caracterizó linfocitos B mediante la técnica de formación de rosetas con eritrocitos cubiertos con anticuerpos y complemento (9). Nakanishi et al. identificaron linfocitos B bovinos en sangre periférica, nódulos linfáticos y bazo mediante la técnica de inmunofluorescencia directa con anti-inmunoglobulina. marcada con isotiocianato de fluorescencia (12). Los macrófagos tienen diferentes funciones en la respuesta inmunitaria, en especial la de presentar los antígenos a los linfocitos; además, secretan varios mediadores biológicamente activos capaces de actuar sobre los linfocitos T y B mediante el incremento o la supresión de la división celular o de su diferenciación. Más aun, el macrófago juega un papel en el procesamiento del antígeno, ya que es la principal célula fagocítica del sistema monocitos-macrófagos (6). En el presente trabajo se caracterizaron linfocitos B, en bovinos con títulos de anticuerpos contra la leptospirosis superiores a 1/100, empleando un suero hiperinmune anticadenas livianas de lgG, marcado con isotiocinato de fluoresceina, y como macrófagos se identificaron todas aquellas células fagocíticas con capacidad de ingerir perlas de látex. MATERIALES Y MÉTODOS Población Analizada Se utilizaron mestizos Holsteins pertenecientes al Instituto de Investigaciones Zootécnicas, dependencia del Fondo Nacional de Investigaciones Agropecuarias. Se seleccionaron 34 animales, los cuales fueron agrupados por edad. Grupo I. Jóvenes Fueron considerados como animales jóvenes todos aquellos cuyas edades estaban comprendidas entre 1 a 18 meses. Grupo II. Adultos
Fueron considerados como animales
adultos aquellos mayores de 18 meses y hasta 4 meses de edad.
Mediante la prueba diagnóstica de la leptospirosis, aglutinación
microscópica (AM) , se hizo la preselección de animales,
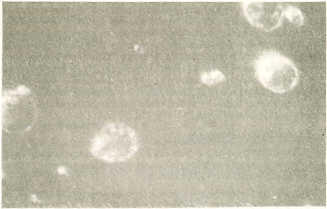
clasificándolos en dos categorías: Grupo I. Jóvenes a. Sanos (controles) Se consideraron como animales sanos todos aquellos que resultaron negativos a la prueba de leptospirosis (13 animales). b. Positivos a leptospirosis Se obtuvo un total de 5 animales. Grupo II. Adultos a. Sanos (controles) Fueron obtenidos 6 animales. b. Positivos a leptospirosis Resultaron positivos 10 animales. Muestras Recolectadas 1. Sangre sin anticoagulante para medir títulos de anticuerpos contra la leptospirosis. 2. Sangre con anticoagulante (EDTA disódico) para las pruebas inmunológicas. Análisis Inmunológicos a. Evaluación de inmunidad humoral Determinación de títulos de anticuerpos contra la leptospirosis. Se utilizó la prueba de aglutinación microscópica (AM) con cultivos vivos de leptospira como antígeno; se emplearon los siguientes serovars: icterohaemorrigiae, canicola, castellonis, pomona, grippotyphosa y hardjo y hardjo, los cuales se mantienen viables en medio liquido. La concentración utilizada fue de 1 x 1 06/ml de cada Serovar como antigeno, la cual se determina por contaje directo en microscopio de campo oscuro. Se emplearon volúmenes iguales de antígeno y diluciones de suero. El material se incubó entre 30 minutos y 1 hora, a temperatura ambiente, y se hizo la lectura en microscopio de campo oscuro (1). b. Evaluación de inmunidad celular Aislamiento de Linfocitos El aislamiento de linfocitos de sangre periférica se re centrifugación con Ficoll-Paque (d = 1087 g/m) según el método de Boyum (2), modificado para linfocitos bovinos (8). Se utilizó sangre periférica tomada de la vena yugular con anticoagulante (EDTA disódico), diluida 1 en 3 de PBS, pH 7,2. A cada tubo de centrifuga de 15 ml se le añadió 4 ml de Ficoll-paque, sobre el cual se colocaron suavemente 8 ml de sangre diluida con PBS en una relación de 2 a 1 v/v. Los tubos se centrifugaron a 1800 rpm durante 30 minutos. Los linfocitos se obtuvieron, de la interfase Ficoll-paque-plasma con una pipeta Pasteur con sumo cuidado y se colocaron en tubos Fischer. Se añadió PBS y se centrifugó a 500 g por 5 minutos para eliminar el exceso de Ficoll-paque. Se lavaron 3 veces con PBS y de nuevo se centrifugaron a 500 g por 2 minutos. Una vez separadas las células, se procedió al contaje de los linfocitos aislados para determinar el rendimiento celular. Para esto último fue utilizada la cámara de Neubauer y coloración con cristal. Detección de Linfocitos B Se identificaron como linfocitos B, aquellas células que poseían lgs de superficie (Figura 1). Se empleó la técnica de anticuerpos marcados con fluoroocromo (isotiocianato de fluorescencia). Se utilizaron 1 x 106 células mononucleares obtenidas por separación en gradiente de Ficoll-paque, transferidas a un tubo Fisher y se añadieron 100 µ| de conjugado anti-cadenas livianas de lgG bovina, preparadas en conejo y marcadas con FITC, dil 1:3. Se llevaron a incubación a 4°C durante 30 min. Se lavaron las células dos veces con PBS, pH 7 ,2 y luego se centrifugaron en una microcentrífuga Fisher a 500 g por 2 minutos. Seguidamente fueron resuspendidas en 100 µ| de PBS con formaldehido al 1,8% y se hizo la lectura en microscopio de fluorescencia con objetivo 40x. Se contaron 100 células y determinó el porcentaje de células fluorescentes que eran linfocitos B (3) (Figura 1) .Durante todo el proceso las células fueron mantenidas en frío. El conjugado anti-cadenas livianas de lgG bovina en conejos se elaboró con el fin de ser utilizado en la detección de linfocitos con lgs de superficie. Los pasos seguidos fueron: 1. Separación de lg del suero sanguíneo de bovino. La separación de lgG del suero sanguíneo se realizo en columna de DEAE celulosa, previa precipitación de Ig con (NH4)2S04 (5). 2. Disociación de las cadenas de lgG. La disociación de cadenas de lgG se realizó mediante un método químico, empleando agentes reductores y alcalinizante. La separación de cadenas se realizó por columna de Sefadex G-1 00 según el método de Fleisthman (5). 3. Hiperinmunización de conejos. Las cadenas livianas disociadas, fueron suspendidas en adjuvante completo de Freund en una relación 1:1 (v/v) e inoculadas en los conejos, en los pliegues de las axilas y cuello, por tres dosis, para obtener el suero hiperinmune anti-cadenas livianas de lgG bovina.
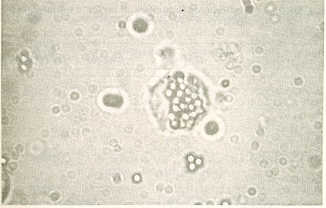
4. Marcaje del suero hiperinmune. El Suero hiperinmune obtenido se marcó con isotiocianato de fluorescencia, en una relación de 0,05 mg/mg de proteina; e incubación a 4°C toda la noche (5). Prueba de Fagocitosis Mediante la fagocitosis se determinó la cantidad de células mónoculares con capacidad de ingerir partículas extrañas (perlas de látex). Se utilizaron 1 x 106célúlas monoculares aisladas de sangre periférica por gradiente de densidad con Ficoll-paque. Se les añadió 5 µ| de perlas de1átex y se llevaron a incubacióna 37°C por una hora. Luego se lavaron tres veces con PBS pH 7.2 y se centrifugaron por 2 minutos a 500g en una microcentrifuga Fisher. Se hizo la lectura en un microscopio de luz blanca directa, calculando por cada 100 células contadas el número de células con partículas de látex en su interior y el número de células que no ingirieron el látex. Se consideraron células positivas todos aquellas células que tenían más de tres partículas de látex en su interior (Figura 2). Análisis Estadísticos Los resultados obtenidos con las diferentes variables estudiadas por animal fueron agrupados e interpretados mediante un análisis de varianza (14) y la prueba de "F" para conocer la existencia o no de diferencias significativas entre los diferentes grupos.
Se empleó la prueba de Tukey para la comparación de medias obtenidas con las diferentes variables. RESULTADOS Y DISCUSIÓN Efecto de la Edad En el Cuadro 1 se muestran los diferentes valores promedios obtenidos en los dos grupos etarios, jóvenes y adultos, respectivamente: total de linfocitos y monocitos 7700 y 7675 µ|; número linfocitos aislados mediante Ficoll-paque, 5650 y 6025µ|, lo cual dio un rendimiento de 73,3 y 78,5%, de los cuales se identificaron como linfocitos B 28,2 y 23,9% y los valores absolutos obtenidos fueron 2150 y 1850 µ|. En el análisis estadístico se obtuvieron diferencias significativas en el número de linfocitos B del grupo de bovinos jóvenes (28,2%), el cual resultó significativamente superior (P < 0,05) al valor obtenido en el grupo de bovinos adultos (23,9%). Los resultados obtenidos en el porcentaje de linfocitos B en los bovinos adultos (23,9%) se encuentran entre los límites normales (22,65 27,65%) señalados por Sulochas (17), y son inferiores o superiores a otros resultados señalados en la literatura, empleando diferentes técnicas (4, 12, 15, 17, 25, 24).
El porcentaje de linfocitos B en los bovinos jóvenes es similar al encontrado por Reeves (15) en bovinos normales (27,65%). Sin embargo, es superior al de otros autores consultados. Estas diferencias son atribuibles a las técnicas de marcaje empleadas. En el Cuadro 2 se muestran los resultados obtenidos en el número de fagocitos de los dos grupos etarios (jóvenes y adultos), respectivamente: 6,5 y 7,7%. No se obtuvieron diferencias estadísticamente significativas entre ambas edades. Los resultados obtenidos en el número de células fagocíticas coincide con los valores obtenidos como normales por los autores consultados (3, 10, 17). Efecto de la Positividad a Leptospirosis En el Cuadro 3 se presentan los diferentes valores promedios obtenidos en los dos grupos etarios, jóvenes y adultos, respectivamente: total de linfocitos y monocitos contados 7300 y 3600/µ|; linfocitos aislados mediante Ficoll-paque 6000 y 5200/µ|, lo cual dio un rendimiento de 82,2 y 66,6%; número de linfocitos identificados como S 30,8 y 26,6%, cuyos valores absolutos 2200 y 2 100/ µ|.
En el número de linfocitos no se obtuvieron diferencias significativas en ambos grupos de edad de los bovinos positivos a leptospirosis; los valores obtenidos corresponden a cifras normales, según los autores consultados (4,11,12). En el Cuadro 4 se muestran los resultados obtenidos con respecto al número de células fagocíticas obtenidas en los bovinos positivos a leptospirosis, agrupados por edad, jóvenes y adultos, respectivamente, cuyos valores fueron 5,8 y 7,8%. En el análisis estadístico no se obtuvieron diferencias significativas.
CONCLUSIONES
SUMMARY The proportion of macrophages and lymphocytes was determinated in bovine's peripheral blood seropositive to leptospirosis; the isolation technique used was centrifugation gradiente with Ficoll-Paque and the efficiency was determined with crystal violet in Newbauer chamber. It was identified as B lymphocytes all those cells with surtace inmunoglobulins using an antilight chain produced in rabbits and labeled with fluoresceina isotiocianate; as macrophages were identify all the cells with capacity to íngest latex pears. It was selected 34 bovine mestizos Holsteins with different ages (young and adult) and grouped according to leptospires serology (negative and positive). In two age groups (young and adult) we obtained, respectively, the following proportion:isolated lymphocytes by Ficoll-Paque, 73,3 and 78,5% B lymphocytes 28,2 and 23,9% and phagocytic cells 6,5 and 7,7%. The seropositive was also grouped by age (young and adult) and we obtained, respectively: isolated lymphocytes by Ficoll-Paque, 82,2 and 66,6%, B lymphocytes, 30,8 and 26,6%) and phagocytic cells, 5,8 and 7,8%. For the age variable there were significant difference (P < 0,05) in the isolation of B lymphocytes, with the higher proportion in the young animals grather than in the adults ones. There were no differences in relation to serology positiviness in the two age groups studied. BIBLIOGRAFÍA
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||