|
Veterinaria tropical. Vol. 18. 23-37. 1993. USO
DE UNA V ACUNA POLIVALENTE INACTIVADA EN LA INMUNIZACIÓN DE BOVINOS M.
Toro Benítez*, S. Montenegro-James**, E. León Arenas*,
1Investigaciones auspiciadas por Convenio FONAIAP-Universidad
de Illinois, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
RESUMEN Se evaluó, en condiciones controladas de laboratorio, la eficacia protectiva de un inmunógeno inactivado combinado (cuerpos iniciales de Anaplasma marginale más exoantígenos de cultivo de Babesia bovis y B. bigemina), usando bovinos susceptibles adultos raza Holstein. La vacuna polivalente se aplicó por vía subcutánea en dos dosis con un intervalo de 30 días entre dosis y tres meses post-vacunación, todos los animales (vacunados y controles) fueron desafiados con organismos virulentos de cepas heterólogas de A. Marginale, B. bovis y B. bigemina. La capacidad protectiva se estimó con base en una comparación, entre vacunados y testigos, de las variaciones de parámetros clínicos y fisiopatológicos post -desafío. El grado de protección inducido hizo posible que los animales vacunados sobrevivieran, sin tratamiento, a un desafío triple con parásitos de reconocida virulencia; en tanto que, los animales controles mostraron signos clínicos agudos de enfer- medad, requiriendo tratamiento después del reto parasitario. El análisis inmunoquímico (SDS-PAGEy WIB) de antígenos de A. marginale (cuerpos iniciales) y de Babesia bovis y B. bigemina (antígenos merozoíticos) mostró tanto bandas proteicas únicas como comunes, reconocidas por sueros in- munes post-vacunación y desafío. Dado que la presencia de antígenos protectivos comunes es esencial para el desarrollo de vacunas efectivas, este hallazgo es de particular importancia. La vacuna inactivada polivalente ofrece, en tanto no se logren vacunas de sub-unidad, una halagadora perspectiva en la prevención simultánea de la anaplasmosis y babesiosis de los bovinos. INTRODUCCIÓN En la mayoría de los países de América Latina, tres especies de hemoparásitos son consideradas como los agentes patógenos de mayor importancia para los bovinos: La rickettsia Anaplasma marginale (Theiler, 1910) y los protozoarios Babesia bovis (Babes, 1888) y Babesia bigemina (Smith y Kilbourne, 1893), (27). Tanto el Anaplasma como las Babesia son transmitidas por garrapatas del género Boophilus, las cuales, en los climas tropicales y sub tropicales evolucionan en condiciones favorables, resultando muchas veces la aparición de infecciones mixtas en los bovinos (4,14). En Venezuela, el control de la anaplasmosis y babesiosis se basa fundamentalmente en el uso terapéutico o profiláctico de drogas anti parasitarias específicas (31), lo cual, generalmente resulta muy costoso o parcialmente efectivo (21). De aquí que el desarrollo de vacunas eficaces, seguras y de fácil aplicación contra estas enfermedades constituya una necesidad actual ya que con ello se lograría un control y/o prevención a un costo menor, se disminuirían las pérdidas ocasionadas y se obtendría una mejor y mayor expansión de la industria ganadera en las áreas endémicas. Los métodos inmunoprofilácticos actualmente en uso para prevenir la anaplasmosis y la babesiosis incluyen: 1. Premunición con sangre de animales portadores u organismos atenuados en forma natural. Con este método, sin embargo, existe el riesgo de producir la enfermedad clínica y, ocasional- mente, la muerte de los animales (1, 11,25).2. Vacunación con organismos vivos atenuados en laboratorio. Vacunas de este tipo han sido utilizadas con éxito en Australia (5,8, 9, 29) en la prevención de la babesiosis causada por B. bovis y B. bigemina y una vacuna atenuada ovinizada de A. marginale ha mostrado proveer una adecuada protección y adaptación de bovinos jóvenes en condiciones tropicales (7, 26). Sin embargo, factores tales como la limitada viabilidad, la estricta dependencia de una cadena fría para su mantenimiento y la variable infectividad, además del riesgo de contaminación con otros agentes patógenos (6, 8, 29) han limitado la aplicación práctica de vacunas vivas en la mayoría de los países tropicales (2,12 17). El severo obstáculo representado por la anaplasmosis y la babesiosis para el desarrollo y la producción ganadera, así como la carencia actual de un método inmunoprofiláctico enteramente satisfactorio para su control, dan una alta prioridad a la búsqueda de vacunas inocuas y efectivas. Estas metas se han tratado de alcanzar a través de dos líneas fundamentales de investigación: 1. El desarrollo y/o mejoramiento de vacunas inactivadas convencionales (13,18) y 2. La aplicación de tecnología DNA recombinante para la obtención de antígenos seleccionados (24, 30). El logro de estos últimos objetivos, no obstante, está aún supeditado a investigaciones básicas considerables, especialmente en la definición de epítopes antigénicos protectivos y la selección de adyuvantes y vías de aplicación eficientes. Recientemente, se ha descrito la eficacia protectiva de una vacuna corpuscular purificada ( cuerpos iniciales de A. marginale) contra la anaplasmosis (20) y estudiado extensivamente, el efecto protector tanto en condiciones de laboratorio como de campo, de una vacuna inactivada contra la babesiosis bovina elaborada basándose en exoantígenos de cultivo (18, 19, 32). En el presente trabajo se informan los resultados de un estudio diseñado con el objeto de determinar la eficacia protectora de una vacuna inactivada combinada,A. marginale, E. bovis, E. bigemina, frente a un reto parasitario con organismos heterólogos virulentos en condiciones controladas de laboratorio. MATERIALES Y MÉTODOS Animales Experimentales Se utilizaron bovinos puros raza Holstein, serológicamente negativos a la prueba de inmunofluorescencia indirecta (IFA) para Anaplasma y Babesia spp., de aproximadamente 14 meses de edad, los cuales se mantuvieron en estricto aislamiento en galpones cerrados a prueba de vectores y se alimentaron a base de concentrado, heno yagua ad libitum. Adicionalmente, se esplenectomizaron becerros de 3 a 4 meses de edad para ser usados como reactivadores de las cepa de exposición Cepas de Hemoparásitos Se utilizaron cepas de A. marginale, B. bovis y B. bigemina aisladas durante brotes de anaplasmosis y babesiosis en diferentes regiones de Venezuela, las cuales fueron mantenidas como "estabilizados criopreservados" en el Cepario del Instituto de Investigaciones Veterinarias. En la elaboración de la vacuna corpuscular purificada ( cuerpos iniciales de Anaplasma) se utilizó la cepa Florida de A. marginale. De las cepas de A. marginale aisladas en Venezuela, la cepa Cojedes había mostrado, al examen mediante coloración de nuevo azul de metileno, la presencia de apéndice caudal; en tanto que, la otra cepa venezolana (Atacoso, Edo. Zulia) y la cepa Florida no presentan dicho apéndice (Figura 1). Producción de Inmunógenos Los cuerpos iniciales de A. marginale fueron obtenidos y purificados mediante una combinación de disrupción ultrasónica, tratamiento con detergentes no iónicos y centrifugación diferencial, según método descrito (20). De un bovino esplenectomizado infectado con A. marginale ( cepa Florida) se recolectó, al pico de parasitemia y en forma aséptica, sangre parasitada usando EDTA (2,0 mg/ml como anticoagulante). A fin de remover anticuerpos adherentes, los eritocitos se separaron y lavaron con solución buffer de glicina (0,lM, pH = 3,0) y, seguidamente, con solución salina buffer fosfatada (PBS, pH = 7,4) en presencia de inhibidores de proteasas (3,5 m M tetrationato de sodio (Sigma Chemical Co., St. Louis, M. O, EUA) y timerosal al 0,01 %. El paquete celular, diluido 1:5 en PBS, se sonicó dos veces a 20 kilociclos, a un flujo de 40 mI por minuto. El material sonicado se congeló y descongeló tres veces para asegurar una completa lisis celular. Se sonicó nuevamente y se diluyó en partes iguales con PBS adicionado de 1% de Nonidet-40 (detergente no iónico). Los cuerpos iniciales de A. marginale se separaron mediante centrifugación y se suspendieron en solución salina balanceada de Han k (HBSS). La concentración de proteínas se determinó mediante el método de Lowry modificado (20). Los inmunógenos (exoantígenos) de B. bigemina y B. bovis, derivados de cultivo y libres de contaminación eritrocítica, se prepararon según procedimientos descritos por Montenegro-James et al (18,19). Los cultivos se iniciaron con sangre infectada de bovinos inoculados individualmente con cada una de las especies de Babesia. El medio de cultivo consistía de Medio 199 (Sigma Chemical Co., St. Louis, M. O, EVA) suplementado con 40 y 20% de suero bovino normal para B. bovis y B. bigemina, respectivamente y antibióticos (penicilina, 100 VI/mI yestreptomicina, 100 mg/ml). Los cultivos se incubaron a 37°C en una atmósfera de 3% de CO2 y ambiente humidificado. Los sobrenadantes de cultivo, recolectados diariamente durante un lapso de tres días, se centrifugaron, mezclaron, filtraron (flltro Millipore 0,45 .μ) y se liofilizaron.
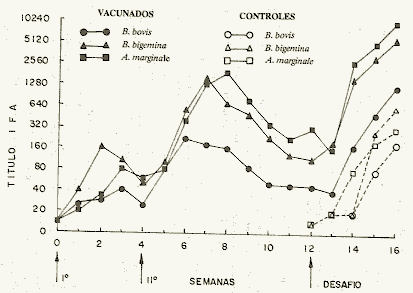
La vacuna polivalente consistió de una mezcla de exoantígenos de B. bovis (2,0 ml/eq.) y B. bigemina (3,0 ml/eq), liofilizada y reconstituida con 3,0 ml de agua destilada estéril, pH = 7,0, que contenía 0,1 mg de proteínas de A. marginale (cuerpos iniciales purificados) y 3,0 mg de Saponina Quil-A (Superfos Biosector a/s, Denmark) como adyuvante. Análisis Antigénico Mediante las técnicas de inmunoelectrofóresis (SDS-P AGE) y Western Inmunoblott (WIB) se analizaron preparaciones antigénicas, en geles gradientes (6-12%) de poliacrilamida, en condiciones reducidas, para luego ser transferidas a papel de nitrocelulosa (0,45 μ); como antígenos de Anaplasma se utilizaron cuerpos iniciales de las cepas Florida, Atacoso y Cojedes. A partir de la sangre de becerros esplenectomizados infectados con B. bigemina o B. bovis se prepararon antígenos merozoíticos para análisis por inmunoblott (22). Los antígenos se pusieron de manifiesto mediante el desarrollo inmunoblotts con sueros de bovinos vacunados y no vacunados, de acuerdo con las recomendaciones de TSANG et al (33). Diseño Experimental Nueve bovinos raza Holstein, susceptibles a Anaplasma y Babesia se dividieron en dos grupos de cinco y cuatro cada uno. El grupo 1 (n = 5) recibió la vacuna polivalente inactivada, la cual consistía de 0,1 mg de proteínas de cuerpos iniciales de A. marginale adicionadas de 5,0 m1Ieq de exoantígenos combinados de B. bovis y B. bigemina, suplementados con 5,0 mg de Saponina Quil-A/dosis como adyuvante. Los animales fueron vacunados por vía subcutánea con dos dosis e intervalo de un mes entre dosis (días: 0 y 30). El grupo 2 (n = 4) permaneció como controles no vacunados. Tres meses post-vacunación, todos los animales fueron desafiados mediante inoculación intravenosa de sangre fresca que contenía 1 x 109 eritrocitos infectados con organismos heterólogos de A. marginale ( cepa Cojedes) y tres días después, con 1 x 108 eritrocitos parasitados con cepas heterólogas de B. bovis y B. bigemina. A través de todo el experimento, se obtuvieron datos en relación con la temperatura corporal, hematocrito, niveles de plaquetas y fibrinógeno, parasitemia (en frotis de sangre teñidos por Giemsa), peso corporal y respuesta de anticuerpos (prueba IFA). Los niveles de fibrinógeno plasinático se determinaron mediante la prueba de inmunodifusión radial (3). La significancia estadística de las diferencias entre los promedios de losgrupos experimentales (vacunados y no vacunados) se calculó mediante la prueba "t". RESULTADOS Y DISCUSIÓN En la Figura 2 se muestran los niveles de anticuerpos IF A obtenidos en respuesta a la vacunación con el inmunógeno polivalente multiparásito (cuerpos iniciales de A. marginale y exoantígenos de B. bovis y B.. bigemina) y después del reto parasitario con cepas heterólogas virulentas. Los máximos niveles de anticuerpos séricos post-vacunación se observaron a las 2, 3 y 5 semanas después de la segunda dosis vacunal para B. bovis (1:211), B. bigemina (1:1689) y A. marginale (1:1940), respectivamente. La re actividad serológica cruzada entre antígenos de B. bovis y B. bigemina ha sido ya señalada por otros autores (16, 20); señalándose, además, que los antisueros de B. bovis reaccionan fuertemente con el antígeno de B. bigemina (34). En un estudio previo, se observaron altos y persitentes títulos de anticuerpos frente al antígeno de B. bigemina en sueros inmunes de B. bovis (19). De aquí, que los altos títulos IFA para B. bigemina (1:1689) observados en la presente investigación, podrían ser atribuidos a la afinidad que presentan los anticuerpos de B. bovis por el antígeno de B. bigemina. Los presentes resultados confirman los hallazgos anteriores. Los niveles de anticuerpos declinaron gradualmente hasta títulos de 1:160 (B. bigemina), 1:40 (B. bovis) y 1:40 (A. marginale) para el momento del desafío con cepas virulentas (3 meses post-vacunación). Después del reto parasitario, se observó una rápida y fuerte respuesta anamnésica, con títulos que aumentaron consistentemente por un período de tres semanas (Figura 1). En el Cuadro 1 se hace una comparación de las variaciones fisiopatológicas en bovinos vacunados y controles, como índices de la protección clínica inducida por la vacuna inactivada polivalente. La vacuna combinada ( cuerpos iniciales de A. marginale más exoantígenos de B. bovis y B. bigemina) indujo una protección moderada frente al desafío con cepas virulentas. Sin embargo, las alteraciones fisiopatológicas en los animales vacunados fueron de corta duración, en comparación con los animales controles. El grado de protección conferido por la vacuna hizo posible que los animales vacunados sobrevivieran a un desafío triple con parásitos de reconocida virulencia, mostrando trastornos clínicos relativamente menos intenso que los observados en los testigos. Por otra parte, el retorno a valores normales de hematocrito se produjo en menor tiempo y los hemoparásitos circulantes fueron eliminados rápidamente.
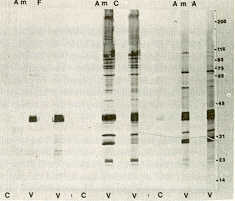
Todos los bovinos controles mostraron signos agudos de enfermedad con diferencias significativas en todas las variables clínicas y fisiopatológicas analizadas, requiriendo, además, tratamiento específico y de soporte después del desafío parasitario (Cuadro 1). En la Figura 3 se muestran los resultados del análisis inmunoquímico mediante la técnica de Western Inmunoblotting (WIB) de sueros in- dividuales de animales vacunados, recolectados dos semanas después del desafío y de sueros controles (bovinos no vacunados), los cuales se hicieron reaccionar con proteínas de cuerpos iniciales de A. marginale, cepas Florida, Atacoso y Cojedes. Una banda proteica principal de 38 kilo Daltons (kDa) fue reconocida en los sueros de animales vacunados en todas las cepas de A. Marginale analizadas. Los sueros inmunes de los bovinos vacunados reaccionaron fuertemente con un mínimo de 12 polipéptidos de la cepa Cojedes de A. matginale (cepa de exposición, con apéndice caudal), identificándose polipéptidos únicos de 89, 84, 42, 40 y 35 KDa. Bandas proteicas únicas de 27 y 24 kDa fueron constatadas en la cepa Florida de A. marginale. Un mínimo de seis antígenos comunes (110,73,65,38,34 y kDa) a las tres cepas de A. marginale fueron reconocidos en los sueros de bovinos inmunes (Figura 3). Este hallazgo es particularmente importante ya que la presencia de antígenos comunes protectivos es indispensable para el desarrollo de vacunas eficientes y de amplio espectro de protección contra la anaplasmosis (23, 24). En estudio reciente (20), se observó un buen grado de protección cruzada cuando bovinos vacunados con cuerpos iniciales de la cepa Florida fueron desafiados con una cepa virulenta de A. marginale de Venezuela (cepa Yaracuy, sin apéndice caudal). En el presente estudio, se seleccionó la cepa Cojedes para el desafío heterólogo por ser una cepa de campo que había mostrado, en inoculaciones previas, una alta virulencia y con la característica morfológica del apéndice caudal, en contraste con la cepa Florida, la cual, carece de dicho apéndice. La protección de los bovinos vacunados frente a la exposición heteróloga indicó la presencia de epítopes protectivos comunes en dos cepas de A. marginale, antigénica y estructuralmente diferentes (Florida no caudada y Cojedes con apéndice caudal). Protección cruzada similar entre la cepa Florida y la cepa caudada Washington-O, ha sido señalada por PALMER el al (23).
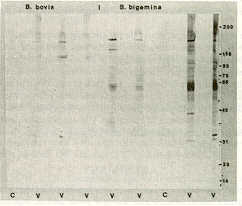
En la Figura 4 se muestran los resultados del análisis por Western Inmunoblotting (WIB) de sueros individuales de animales vacunados, recolectados dos semanas después de la exposición y de animales controles (bovinos no vacunados) los cuales, fueron re activados con antígenos merozoíticos heterólogos de B. bovis y B. bigemina. El análisis mostró que los sueros de animales vacunados reaccionaron fuertemente en un rango que osciló entre 179 y 21 kDa, resultando la mayoría de los antígenos comunes a ambas especies de Babesia. Las principales bandas proteicas comunes en las especies fueron identificadas a 163, 64 y 33 k Da. Sin embargo, también fueron identificadas tres antígenos especie-específicos (153, 113 y 42 k Da) en B. bovis y polipéptidos únicos de B. bigemina (104, 72 y 45 kDa). La similitud antigénica y la posible relevancia de epítopes de protección cruzada entre B. bovis y B. bigemina no ha sido aún conclusivamente correlacionadas con una protección significativa (28, 34). Otros autores han encontrado que la glicoproteína especie-específica 42 kDa de B. bovis es la proteína de superficie inmunodominante en bovinos protegidos (10) y que el antígeno específico 45 kDa de B. bigemina es capaz de inducir protección parcial contra el desafío virulento homólogo (15). Dado estos hallazgos, el uso de un inmunógeno combinado B. bovis/B. bigemina es aún estrictamente necesario para garantizar una adecuada protección contra los efectos patógenos de las babesiosis en los bovinos. Finalmente, se podría concluir que mientras no estén completamente desarrolladas las vacunas de sub-unidad, una vacuna inactivada polivalente compuesta de exo-antígenos de cultivo de Eabesia y de cuerpos iniciales purificados de A. marginale puede ofrecer la mejor combinación de seguridad y eficacia contra la babesiosis y la anaplasmosis, enfermedades hemoparasitarias que causan cuantiosas pérdidas en la ganadería bovina de trópicos y sub-trópicos. SUMMARY The protective efficacy of an inactivated combined immunogen (Anaplasma marginale initial bodies plus Babesia bovis and B. bigemina culturederived exoantigens) was evaluated, under laboratory control conditions, using Holstein-bred susceptible adult cattle. Polyvalent vaccine was applied by subcutaneous route in 2 doses at 30 daysintervals and 3 months after vaccination, all animals (vaccinated and controls) were challenged with heterologous virulent organisms of A. marginale, B. bovis and B. bigemina strains. Protective capacity was estimated on the basia of variations of clinical and pathophysiological parameters in vaccinated and controls animals after challenge. The degree of protection conferred by the polyvalent vaccine enabled the immunized animals to survive. without treatment, a triple challenge with parasites of known virulence: whereas, control animals showed acute clinical signs and required treatment. SDS-P AGE and WIB analysis of A. marginale (initial bodies) and merozoitic B. bovis and B. bigemina antigens showed both unique and common protein bands, recognized by immune post-vaccination and challenge serum samples. Since the presence of common protective antigens is essential for development of effective vaccines, this finding is of particular importance. Until subunit vaccines are fu11y developed, a polyvalent inactivated vaccine offer the best perspective for simultaneous prevention of anaplasmosis and babesiosis in cattle. BIBLIOGRAFÍA
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||