|
Veterinaria Tropical 19: 41-52. 1994 TRANSMISIÓN TRANSPLACENTARIA DEL Trypanosoma vivax Y SU EFECTO SOBRE LA DESCENDENCIA DE HEMBRAS GESTANTES INFECTADAS EXPERIMENTALMENTE Nersa González y Emir Espinoza*
* Universidad Simón Rodríguez
Laboratorio de Investigación Animal |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
RESUMEN Se estudió la transmisión transplacentaria y el efecto del Trypanosoma vivax sobre la descendencia de vacas infectadas experimentalmente. Se utilizaron cuatro becerros nacidos de madres inoculadas experimentalmente con un aislado de T. vivax y dos becerros hijos de hembras controles no infectadas. El valor promedio de los pesos al nacer de los becerros, hijos de las madres infectadas y de los controles fue de 25,5± 3,8 y 29 ± 1,4 kg, respectivamente. Dos becerros hijos de madres infectadas desarrollaron tripanosomiasis clínica. La parasiteria fue detectada a partir del día 13 y 15 post-nacimiento. Sólo un becerro presentó bajo peso al nacer, inflamación de las articulaciones y caquexia. La media de los valores del hematócrito en los becerros infectados fue de 35,5 ± 6,5% y en los controles de 32,6± 6,2%. Todos los becerros hijos de madres infectadas evidenciaron anticuerpos anti T. vivax a partir del día 15 y 20 post-nacimiento. Sin embargo, en los animales que no presentaron tripanoson-úasis clínica, los anticuerpos se diagnosticaron a partir del día 30 y 35 postnacimiento. El desarrollo de tripanosomiasis clinica en dos becerros y la detección de anticuerpos anti T. vivax en todos los animales hijos de las vacas infectadas experimentalmente evidencian la transmisión transplacentaria del hemoparásito. INTRODUCCIÓN Las tripanosomiasis son enfermedades causadas por parásitos protozoarios los cuales infectan a bovinos, ovinos, caprinos, suinos, equinos, dromedarios, muchas especies de animales salvajes y al hombre (6,12). En África, las especies de Trypanosoma más importantes en términos económicos son aquellas que infectan a los rumiantes domésticos: Trypanosoma congolense, T. vivax y T. brucei. En América (Centro y Sur América), el T. vivax es identificado como el agente etiológico de la enfermedad en bovinos, ovinos y caprinos, pero la epidemiología y las implicaciones sobre la productividad ganadera ha recibido una atención limitada (2, 10, 16, 17, 19, 20). En la especie humana parasitada por T. rhodesiense o T. gambiense, se han observado altas ratas de abortos, nacimientos débiles y/o prematuros (9). Con relación a los rumiantes, los tripanosomas pueden causar transmisión transplacentaria, reabsorción embrionario, aborto, nacimientos débiles y muerte prematura (5, 12, 13, 14, 15, 16). La enfermedad clínica sólo es confirmada ocasionalmente en los establecimientos ganaderos y sobre los becerros se indica que el T. vivax causa efectos subclinicos (8). En este trabajo se estudió la transmisión transplacentaria y el posterior comportamiento de los becerros hijos de vacas infectadas experimentalmente con un aislado venezolano de T. vivax. MATERIALES Y MÉTODOS La experiencia fue realizada en la Estación Experimental Río Negro de la Universidad Simón Rodríguez, ubicada en el estado Miranda, municipio Capaya, Asentamiento Campesino Río Negro, a 42 msmn y, con una vegetación de bosque trópico húmedo, temperatura promedio de 27 °C, y una pluviosidad total anual de 1.913 mm. El ensayo se desarrollo en dos etapas: una que comprendió el período prenatal (90 días) y la otra, el período postnatal (50 días). Animales experimentales. Los animales utilizados en este trabajo fueron seis hembras Holstein-Cebú, todas en el último tercio de la gestación. Estas fueron sometidas a pruebas parasicológicas y serológicas, para descartar presencia de hemoparásitos y/o título reaccionante a brucelosis y anticuerpos anti T.vivax. El rebaño hembra, como programa rutinario de salud animal, es vacunado anualmente contra leptopirosis. Material parasitológico e infección experimental. Los animales se dividieron en dos grupos, uno experimental de cuatro hembras inoculadas IV con un estabilizado de T. vivax en DMSO al 5% (3), identificado como aislado Guárico procedente del Instituto de Investigaciones Veterinarias, conteniendo una dosis total de 104 tripanosomas por milímetro, y otro grupo control formado por dos hembras no infectadas. Variables clínicas en las madres. Cada 10 días se determinó el peso corporal, temperatura, parasitemia, hematocrito, y se realizó palpación rectal a través de los métodos convencionales. Los datos morfométricos fueron obtenidos mediante la utilización de una romana de 5.000 kg. La determinación de la temperatura se realizó en las primeras horas de la mañana, abarcando el período prepatente y postpatente. Para la determinación de la parasitemia se utilizaron los métodos parasitológicos directos; frotis teñidos con Giemsa al 10 % y la técnica de la microcentifugación (22). El hematócrito (Ht) se determinó a través de una microcentrifuga emea (Clay Adams, Autocrit Ultra 3). La titulación de anticuerpos anti T. vivax se realizó mediante el uso de la técnica de inmunofluorescencia indirecta (lFl) (4). Estudio parasitológico, clínico e inmunológico de los becerros. Inmediatamente después del parto, los becerros fueron pesados en una romana, examinados clínicamente y les fueron tomadas muestras sanguíneas para las determinaciones parasitológicas, hematócritas y serológicas (títulos IFI anti T. vivax), las cuales fueron procesadas siguiendo los mismos criterios utilizados para las madres. Los becerros permanecieron con sus respectivas madres de acuerdo con el grupo infectado o control en ambiente separado y protegido de vectores. Análisis estadísticos: Los resultados obtenidos fueron graficados mediante la comparación del grupo infectado y control. Se usaron porcentajes, medias y su desviación estándar, e intervalos de confianzas al 95%. RESULTADOS El valor promedio de los pesos al nacer de los becerros
hijos de las madres infectadas con la cepa de T. vivax y los controles fue de
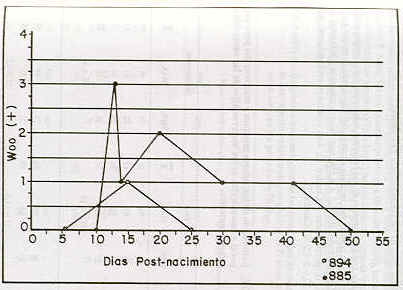
No todos los becerros de las madres infectadas desarrollaron tripanosomiasis clínica. El becerro 885 mostró, a través de la técnica de Woo y frotis teñido con Giemsa al 10%, parásitos en sangre a partir del día 13 postnacimiento; su parasitemia fue ondulante con tres ondas parasitarias (ver Figura), no manifestando signos clínicos evidentes de la enfermedad. El becerro 894 presentó tripanosomas circulantes para el día 15 postnacimiento (ver Figura). La parasitemia fue estimada o clasificada como baja (1 +) y posteriormente no se pudo evidenciar T .vivax hasta el final del muestreo (día 55 postnacimiento). Sin embargo, éste fue el becerro que presentó mayor deterioro en su aspecto clínico (bajo peso al nacer, hematócrito crítico, inflamación de las articulaciones y caquexia).
El posible cuadro anémico de los becerros infectados y su comparación con los del grupo control fue medido a través del Ht, siendo la media para los animales infectados de 35,5 ± 6,5%, con valores mínimos y máximos de 20 y 44%, respectivamente (Cuadro 2). Los controles evidenciaron una media de 32,6 -4- 6,2% (Cuadro 2).
Los datos presentados en el Cuadro 3 muestran los resultados de la respuesta inmunológica (títulos IFI) de los becerros hijos de las vacas infectadas con el aislado de T. vivax. Del análisis se desprende que hubo una relación entre la presencia de tripanosomas en la sangre de los becerros hijos de las vacas infectadas (885, 886, 894 y 897) y la detección de anticuerpos contra T. vivax. En los becerros positivos a Woo (885 y 894), los anticuerpos se evidenciaron a partir del día 20 y 15 postnacimiento, respectivamente. Con relación a los becerros 886 y 897 los títulos a la infección fueron detectados a partir de los días 35 y 20 postnacimiento, respectivamente. Los becerros del grupo control permanecieron negativos durante el período experimental (Cuadro 3).
DISCUSIÓN Los becerros nacidos de las hembras inoculadas y controles nacieron a término, y sólo el 894 (hijo de una vaca infectada) presentó bajo peso y condiciones físicas críticas. Los nacimientos débiles en hembras infectadas con T. vivax también fueron encontrados por Betancourt (1) y Ogwu et al (13). Con relación a los pesos al nacer hubo diferencia de ensayo con lo encontrado por Ogwu et al. (13) quienes detectaron que los becerros nacidos de novillas infectadas en el primer trimestre de la gestación fueron más débiles al nacimiento. En este experimente, de un total de cuatro animales, tres aparentemente nacieron normales y uno en un estado de total debilidad. En los becerros infectados se observó una disminución del peso que oscilé entre un 18 y 21%, en comparación con el peso de los animales controles. Sobre este aspecto, Otte (16) señala que los becerros infectados con T. vivax tienen una reducción en la tasa de crecimiento, lo cual puede significar de 20 a 25% menos de peso. En los becerros 885, 886 y 897 el hematócrito fluctuó entre 30 y 40%. El becerro 894 mostró un valor al inicio de la infección de 20%. Uno de los objetivos de este estudio fue demostrar la posible transmisión intrauterino del T. vivax por las hembras infectadas experimentalmente. Los resultados indicaron la presencia del T. vivax en sangre circulante de dos becerros. El 885 fue positivo por el método de Woo para el día 13 postnacimiento. La morfología del Trypanosoma fue confirmada por medio del frotis teñido con la solución de Giemsa al 10%. El becerro 894 presentó tripanosomas en sangre para el día 15 postnacimiento. Recientemente, Meléndez et al (11) señalaron la infección perinatal (5 horas de nacido) de un becerro con T. vivax, sugiriendo que la infección intrauterino con el parásito, puede ser responsable de la estabilidad endémica a la tripaiiosomiasis bovina, observada en algunas regiones ganaderas de Venezuela. El curso de la parasitemia fue diferente en los dos animales; el becerro 894 desarrollo un estado clínico severo al inicio de la infección , pero a partir del día 25 postnacimiento no se pudo evidenciar la presencia de los parásitos y el animal tendió gradualmente a mejorar su aspecto físico. El becerro 885, a pesar de mostrar la mayor parasitemia, presento una condición corporal poco afectada. Uzoigwe (21) encontró, en becerros cebú infectados con T.vivax, una mayor resistencia a la parasitosis y una tendencia hacia la autocura o recuperación espontánea, cuando los becerros se infectan dentro de las dos primeras semanas después del nacimiento. Estas observaciones y la de Ogwu y Njoku (15), Ogwu et a (14) y Meléndez et al (11) podrían expücar la resistencia de los animales jóvenes a la infección con T. vivax; la cual se ha atribuido a una posible transferencia de factores inmunes o a una inmunidad parcial de las madres a sus becerros. Los títulos IFI de anticuerpos anti T. vivax en los becerros fueron detectados posteriormente a la patencia de los hemoparásitos en sangre, situación que corroboró la transnúsi6n transpiacentaria de la infección. Los anticuerpos fueron evidenciados en todos los becerros descendientes de las hembras inoculadas, sin distingo del diagnóstico parasitológico. En forma siniflar a los resultados de Platt y Adams (18) y Katende et al (7) los títulos se detectaron a partir del día 15 postnacinúento. En los becerros, negativos por la técnica de Woo, los anticuerpos auti T. vivax se hicieron presentes a partir del día 20 (894) y día 35 (886), respectivamente. Los animales controles fueron negativos durante todo el período experimental. Esta información preliminar abre un abanico de interrogantes sobre la epidemiología y las repercusiones financieras que tiene la tripanosomiasis bovina en áreas de estabilidad endémica, al afectar las ganancias de pesos en animales de reemplazo en las diferentes ganaderías del país. SUMMARY Four calves born from eows experimentauy infected with a Trypanosoma vivax strain and two control calves horn from uninfected females were used to study the transplacentary transmision and its effect on the progeny form experimentally infected females. The average weights at birth of calves horn from the infected cows and controls were 25.5 ± 3.8 and 29 ± 1.4 kg, respectively. Two of the calves, from the infected females, developed clinical tripanosomiasis. A moderate parasitemia was detected from 13 and 15 days post birth. Only one calf showcd a low weight birth and its physical conditions were critical. The average hematocrite values of infected calves and control were 35.5 ± 6.5 and 32.6 ± 6.2, respectively. AU progeny form infected cows, showed anti T. vivax antibody between 15 and 35 days post birth. Development of clinical tripanosomiasis in two infected calves, and the detection of Trypanosoma vivax antibody in aU progeny from the infected cows showed a trnsplacentary transmission of the hemoparasite. BIBLIOGRAFÍA BETANCOURT, A. Transraisión prenatal del Trypanosoma vivax de bovinos de Colombia. Revista Instituto Colombiano Agropecuario 3(1):127-129.1978. DUNO, F. Prevalencia de la tripanosoniiasis bovina en la Región Nor-Oriental del Edo. Falcón. Tesis MSc. Universidad Central de Venezuela. Maracay. Venezuela. 1992. ESPINOZA, E. y E. TORTOLERO. Un método simple de conservación de TWanosoma vivar para su uso en infecciones experimentales. In: Hemoparásitos: Biología y Diagnóstico. Universidad Simón Bolívar. pp 147-154.1990. (Serie Biología). ESPINOZA, E. Técnicas de inmunofluorescencia indirecta (IFI) en el diagnóstico de la tripanosomiasis bovina. In: Hemoparásitos: Biología y Diagnóstico. Universidad Simón Bolívar. pp 155-167.1990. (Serie Biología). GONZÁLEZ, N. Infección experimental con Trypanosoma vivax en vacas mestizas Hoistein-Cebú, durante el último tercio de la gestación y el post-parto. Trabajo de ascenso. Universidad Simón Rodríguez. Caracas. Venezuela. 1991. ILRAD. Trypanosomiasis. Annual Report of the International Laboratory for Research on Aniínal Diseases. Nairohi. Kenya. 1985. pp 33-61. KATENDE, J., MUSOKE, A., NANTULYA, V. and B. GOOLDEERIS. A new metbod for fixation and preservation of trypanosomal antigens for use in the indirect inmunofluorescence antibody test for diagnosis of bovine trypanosomiasis. Tropenmedizen und Parasitology 38:41-44.1987. LOSOS, G. Infectious tropical diseases of domestie animal. Canadá. Longman pp 182-318.1986. LUCKINS, A., C. LLEWELYN, C. MUNRO and M. MURRAY. Effects of pathogenic trypanosoma on the mammalian reproductive system. Nuclear and related teehniques in animal production and Health International Atomic Energy Agency. Vienna. 1986. 351-363. MATEUS, G., O. GARCIA and J. LEON. Use of trypamidium in an integrated control method of Trypanosoma vivax in Colombia. First internacional seminar on non tsetsc transmitted animal trypanosomoses. Annecy, France. 1992. p 90. MELENDEZ, R., M. FORLANO and W. FIGUEROA. Perinatal infection with Trypanosoma vivax in a calf in Venezuela. The Journal of Parasitology 79(2): 293-294. 1993. OGWU, D. and C. NJOKU. Effect of pregnaney of efinical manifestation of bovine trypanosonúasis. Veterinary Parasitology 24: 25-33. 1987.
OGV,IU, D., C. NJOKU and D. OSORI. Effeets of experimental Trypanosoma vivax
infection on first, second and third trimester pregnaney in heifers. Theriogenology 25(3):
383-398.1986.
OGWU, D., C. NJOKU, D. OSORI, C. EZEOKOLI and J. KUMI- DLAKA.'Effeets of experimental Trypanosoma vivax on fertility of heifers. Theriogenology 22(6):625-633.1984. OGWU, D. and S. NURU. Transpiacental transmission of trypanosomes in animais and man. A review. Veterinary Bulletín 51(6):381-384.1981. OTTE, J. La importancia de la tripanosomiasis en la industria ganadera de Córdova, Colombia. Bogotá. Instituto Colombiano Agropecuario. Informe técnico. No. S. 1991.151 p. PERRONE, T., M. LESSEUR, 1. REVERON, E. FSPINOZA, P. ASO and S. GIARDINA. Seroepídemiology of bovine trypanosomiasis in the area of Santa María de Ipire, Venezuela. First internacional seminar on non tsetse transmitted animal trypanosomoses. Annecy. France. 1992. p 196. PLATT, K and L. ADAMS. Evaluation of the indirect fluorescent antibody test for detecting Trypanosoma vivax in South America cattie. Research in Veterinary Science 21: 53-58. 1976. TAMASAUKAS, R. Epidemiological diagnosis of bovine trypanosomiasis in farms of Guárico State. I. Prevalence. First inter- national seminar on non tsetse transmitid animal trypanosomoses. Anneey, France p. 194. 1992. TORO, M. Seroepideniiología de las hemoparasitosis en Venezuela. In: Hemoparásitos: Biología y Diagnóstico. Universidad Simón Bolívar. 1990. pp. 33-50. (Serie Biología). UZOIGWE, R. Self cure in zebu calves experimentafly infected with Trjpanosoma vivax. Veteaary Parasitology 22: 141-146. 1986. WOO, P. The haematocrit centrifuge for the detection trypanosomes in blood. Canadian Journal of Zoology. 1969. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||