|
Veterinaria Trop. 20:67-84. 1995. PARASITEMIA
Y COMPORTAMIENTO CLÍNICO EN OVEJAS INFECTADAS Espartaco Sandoval*, E. Espinoza **y Alberto Valle***
*Estación Experimental Falcón. Coro, estado Falcón. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
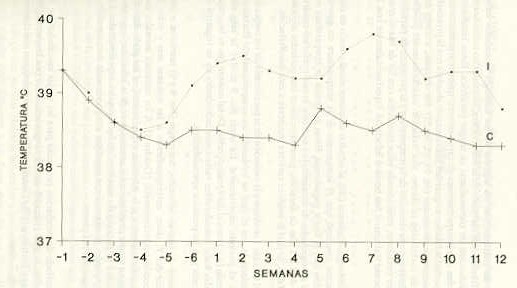
RESUMEN Con el objetivo de conocer la fisiopatología de la anemia que un aislado venezolano de T. vivax provoca en pequeños rumiantes, nueve ovejas mestizas Wet-african de dos años de edad y 25,9 ± 3 kg promedio de peso se seleccionaron mediante el uso de la tabla de números aleatorios. Los animales que ocuparon los seis primeros lugares fueron inoculados por vía intravenosa, con 10 ml de sangre que contenían aproximadamente 3,106 parásitos, provenientes de un caprino positivo; las tres ovejas restantes fueron consideradas controles. Las variables: parasitemia, temperatura, peso corporal y signos clínicos fueron evaluadas durante 120 días. El comportamiento clínico de la enfermedad reflejó una fase aguda, una subaguda y una crónica. Los signos clínicos predominantes fueron: fiebre remitente, parasitemia ondulante, decaimiento y pérdida de brillo en el pelo, mucosas pálidas y deterioro de la condición corporal. INTRODUCCIÓN En muchos países de Centro América, Suramérica y las Antillas se ha señalado la presencia de Trypanosoma vivax (13, 21, 29), sin embargo, en la actualidad no existe un total conocimiento sobre su epidemiología, sugiriéndose un carácter endémico de la enfermedad (60). Su introducción en el continente americano se relaciona con una importación en 1830 de bovinos cebú provenientes del Senegal hacia la Guyana Francesa y las islas Guadalupe y Martinica (9,44,54). En América, el hemoparásito, en ausencia de su transmisor natural (las moscas Tse tse ), aparentemente se adaptó a una transmisión mecánica por insectos hematófagos, entre los que parecen estar involucrados el Tabanus nebulosus y Stomoxys calcitrans (10,22,24,31, 45,47,48), garrapatas (35) así como murciélago hematófagos (58). La evidencia acumulada en estudios fenotípicos y antigénicos sugieren que el T. vivax americano es similar fenotípicamente, pero no serológicamente al encontrado en el oeste de África (14, 23). Sin embargo, parece que el modo de transmisión en América provoca una enfermedad menos grave que en África, lo que parece corresponder a una atenuación de la patogenicidad de las cepas americanas (6). En la enfermedad se reconoce un período prepotente que en bovinos, ovinos y caprinos infectados experimentalmente con Trypanosoma vivax, T congolense y T brucei, oscila entre 3 y 8 días (18, 34). Después de este período, la enfermedad puede ser reconocida clínicamente, pudiendo manifestarse de una forma aguda, subaguda o crónica (15,16, 32,37). Los principales signos clínicos en pequeños y grandes rumiantes son accesos febriles, asociados o no con la presencia de un gran número de tripanosomas en sangre circulante (16, 20); emaciación; enflaquecimiento profresivo; anemia y muerte (7, 9, 10); cambios en el comportamiento del animal; conjuntivitis, edema de la cabeza (5); tumefacción de los ganglios linfáticos (27); abscesos subcutáneos; pelo erizado; cabeza caida (39); lagrimación profusa (49); reacción dérmica local, chancro (1); abortos; muerte neonatal; nacimientos débiles y trastornos endocrinos y fisiopatológicos en machos y hembras (25). A medida que la tripanosomiasis progresa se establece el curso crónico de la enfermedad, el cual abarca un período aproximado de tres meses. En este momento, la frecuencia e intensidad de la parasitemia disminuye y puede generarse un estado de recuperación espontánea de la salud de los animales infectados, principalmente en animales jóvenes (34, 36, 56). Si se toma en consideración la amplia distribución y el impacto económico que el parásito ejerce sobre la ganadería venezolana, así como la escasa información nacional que existe sobre la biología del mismo, particularmente sobre su comportamiento patogénico, se justifica plenamente el estudio de los cambios clínicos en ovejas infectadas experimentalmente con Trypanosoma vivax, como una forma de contribuir al conocimiento de la patología de la enfermedad ya la generación de información que pueda ser instrumentada en programas de control y disminución del efecto detrimental sobre los rebaños de rumiantes domésticos. MATERIALES Y MÉTODOS Se utilizaron nueve ovejas hembras mestizas de la raza West-African, de dos años de edad y un peso promedio de 25,9 ± 3 kg. Mediante el uso de la tabla de números aleatorias (8) se asignaron los seis primeros lugares a los animales inoculados y los tres restantes a los animales controles. Los grupos fueron aislados. La alimentación consistió en heno, pasto picado, alimento concentrado, sales minerales y agua ad libitum . El material parasitológico provino de un estabilizado de Trypanosoma vivax en dimetil sulfóxido, criopreservado en nitrógeno líquido a-196 °C. La dosis del inóculo de las ovejas infectadas fue de 3x106 Trypanosoma vivax contenidos en 1,0 ml de sangre fresca, proveniente de un caprino positivo al hemoparásito ( + + + + ) por la técnica de la microcentrifugación (61). La dosis inoculada fue estimada por medio de un hemocitómetro con el empleo de solución fisiológica en una dilución (1:10), según la metodología de Parra y Vizcaino (46). La temperatura corporal como variable fisiológica se midió en las primeras horas de la mañana (6 a 7 AM), durante las 18 semanas del experimento, empleándose un termómetro rectal de uso veterinario. .Paralelamente a la toma de la temperatura rectal, se realizó la observación y registro de los signos y síntomas clínicos en los animales inoculados y controles (mucosas, ganglios, secreciones, actitud, condición corporal). Las evaluaciones morfométricas se llevaron a cabo cada siete días y fueron obtenidas mediante el empleo de un peso de reloj modelo Salter, con una capacidad de 50 kg. En la determinación de la parasitemia, se utilizó sangre de la vena yugular con EDTA como anticoagulante. La técnica aplicada comprendió el procedimiento de la microcentrifugación (61). El seguimiento de la infección por T vivax se hizo a través de la obtención de muestras de sangre cada tres días durante las primeras ocho semanas de postinfección y luego semanalmente en las 4 semanas restantes, dando por terminado el experimento. Los valores obtenidos fueron comparados mediante la prueba "t" de student para muestras independientes, efectuándose además análisis de correlación lineal de Pearson entre los valores de las variables estudiadas. En todos los análisis se utilizó un nivel de significancia máximo de 5%. RESULTADOS Y DISCUSIÓN Durante el período experimental de preinfección y postinfección, los animales controles evidenciaron una media de temperatura corporal de 38,5 ± 0,2 °C (Figura 1). Los animales inoculados con el estabilizado de Trypanosoma vivax, una vez instaurada la patencia del parásito, mostraron alteraciones considerables en la temperatura corporal, las cuales alcanzaron picos hipertérmicos hasta de 42 °C. No obstante, el mayor promedio semanal de temperatura en las ovejas inoculadas fue de 39,8 °C, el cual coincidió con la semana séptima del período de infección (Figura 1). La primera alza térmica coincidió con la detección del T. vivax en sangre de la vena yugular. Posteriormente, los abscesos febriles coincidieron o no con el diagnóstico del hemoparásito en sangre circulante. Las comparaciones de medias de la temperatura entre las ovejas infectadas con el T. vivax y las ovejas controles evidenciaron diferencias significativas (P < 0,05) para la semana 3 y (P < 0,01) las semanas 4, 7 y 8 del período postinfección; igualmente, entre las medias grupales hubo diferencias significativas (P < 0,01), así como entre las medias parciales de pre y postinfección para los animales inoculados. La coincidencia de la primera alza térmica, en los animales infectados, con la identificación de los parásitos en sangre circulante, concordó con la mayoría de las reseñas efectuadas sobre estudios de tripanosomiasis experimental o natural en ovejas (26, 32, 33, 36, 41, 53, 57). De igual manera, concordaron o reflejaron la pauta general del comportamiento de la temperatura corporal en otros rumiantes infectados con T. vivax (20, 41). A medida que la enfermedad avanzó en los animales inoculados, la temperatura evidenció el mismo significado clínico, es decir, siempre se mantuvo por encima del promedio de los animales controles. Durante el período de postinfección, en algunos de los animales inoculados hubo estados febriles o de elevación de la temperatura, los cuales no coincidieron con la detección de tripanosomas en sangre periférica. Estos resultados concuerdan con interpretaciones de otros autores, quienes argumentaron, que los períodos febriles no guardan una constante absoluta con la presencia de tripanosomas circulantes (16, 19, 33, 34, 52). No obstante, a través del análisis de correlación se obtuvo una relación estadísticamente positiva (r = 0,2801) entre la elevación de la temperatura y la presencia de parásitos en sangre circulante, coincidiendo estos resultados con los de Maxie et al. (39), quienes trabajaron con bovinos infectados experimentalmente con T. vivax.
Sin embargo, Espinoza (20), al estudiar el mismo aislado usado en este experimento concluyó que el incremento de la temperatura no guardó interacción con el factor parasitemia. Estos aumentos de temperatura estuvieron acompañados de decaimiento y anorexia, lo cual conformó cuadros febriles de 1 ó 2 días de duración, para intercalarse con períodos afebriles de 2 ó 6 días, lo cual le confiere carácter remitente a esta manifestación. En el Cuadro 1 se observa la evolución de la parasitemia de las ovejas del grupo infectado, en el cual se evidenció un comportamiento fluctuante durante el período experimental. La oveja No.9 mostró la más alta parasitemia (4 + ) para el día 4 postinfección. De tal manera que en las ovejas inoculadas hubo considerables variaciones individuales en su registros de parasitemia y en los períodos aparasitémicos. Durante la fase de infección, dos ovejas (No.9 y 6) murieron a con- secuencia del T. vivax, correspondiendo a las semanas seis y ocho de postinfección respectivamente, (Cuadro 1). A los restantes animales inoculados, sobrevivientes a la infección experimental, se les pudo detectar parásitos en sangre circulante en la semana trece de la infección, lapso en el cual finalizó el período de muestreo de los animales experimentales. Las ovejas controles permanecieron negativas a tripanosomas durante todo el tiempo que duró el ensayo. El período de incubación promedio para las ovejas inoculadas fue de cuatro días, lo cual coincidió con los rangos señalados por Espinoza (20), Espinoza y Tortolero (19) y González (25), quienes trabajaron con el mismo aislado de T. vivax.
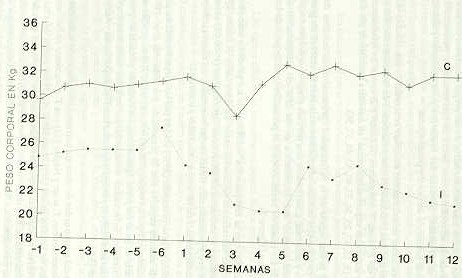
Como se había indicado anteriormente, el primer diagnóstico de T vivax en sangre periférica de las ovejas inoculadas concordó con la primera alza térmica, de tal manera que la parasitemia de estos animales fue de curso ondulante, con altos niveles de tripanosomas durante las cuatro primeras semanas de la infección, para posteriormente mostrar en el resto del ensayo fluctuaciones individuales que variaron cualitativamente entre una y cuatro cruces. El comportamiento ondulante y altos niveles de la tripanosomiasis observada, fue congruente con los resultados obtenidos por Espinoza (20), quien trabajó con novillas Holstein infectadas experimentalmente con el mismo aislado, pero diferente a los datos obtenidos por González (25) cuando inoculó la misma cepa en vacas mestizas Holstein-Cebú, las cuales desarrollaron una parasitosis considerada como moderada. Lo anterior se podría explicar como consecuencia de uno o la combinación de varios de los factores que pueden influir en la intensidad de la infección, tales como: virulencia del parásito, susceptibilidad del hospedador, edad, raza y especie (12, 42, 50). Igualmente, los resultados obtenidos en este experimento concordaron y oscilaron dentro de los rangos señalados en el contienen y americano por otros investigadores que han manejado infecciones experimentales con T. vivax (2, 4, 11, 20, 33, 34, 38, 41, 51, 59). En relación al curso y severidad de las manifestaciones clínicas externas, las ovejas inoculadas experimentalmente con el estabilizado de T. vivax, mostraron cierta anorexia (fase aguda de la enfermedad), debilidad, palidez de las mucosas, pérdida del brillo del pelo, agrandamiento de los ganglios (principalmente el preescapular) y disminución gradual del peso desde el momento en que se diagnosticó el hemaparásito en sangre de la vena yugular . Los signos clínicos se enmarcaron dentro de los criterios asumidos por Van Den Ingh et al. (57), Losos (36) y Espinoza (20). En tal sentido, se determinó una fase aguda de la tripanosomiasis que correspondió con las primeras cinco semanas del período de postinfección, caracterizada generalmente por las manifestaciones externas de hipertermia, decaimiento, emaciación o deterioro de la condición corporal y hematológicamente por el establecimiento de un cuadro pancitopénico. Superada esta etapa de la tripanosomiasis, se estableció la fase subaguda (sexta a novena semana de infección), en donde los signos clínicos más sobresalientes fueron anorexia en alguna de las ovejas inoculadas, parasitemia ondulante, condición corporal extremadamente deteriorada y tendencia a la elevación o recuperación de algunos parámetros sanguíneos, hacia el final de este lapso de la enfermedad. En esta fase subaguda de la parasitosis murieron dos ovejas de las inoculadas (semana sexta y octava de la infección), con un cuadro clínico severo de hipotermia, espasmos, edema submandibular y tumefacción de los ganglios preescapulares. Posteriormente de la semana décima a la décimo primera del período de observación, el resto de los animales inoculados expresaron la fase crónica, con características de una parasitemia variable, donde alternaron lapsos de parasitemia y aparasitemia y donde los parámetros hematológicos tendieron a estabilizarse con valores casi siempre menores o cercanos a los obtenidos en las semanas de preinfección. Los signos clínicos más característicos de las ovejas infectadas durante todo el período de infección fueron: fiebre de tipo remitente; parasitemia ondulante, decaimiento; pérdida del brillo del pelo; mucosas pálidas; deterioro de la condición corporal y pancitopenia. Las alteraciones anteriormente descritas concordaron con reseñas de otros autores que han estudiado el comportamiento de variantes africanas o americanas de T. vivax T congolense, T brucei y T evansi en infecciones naturales o inducidas experimentalmente, en animales domésticos y/o de laboratorio (3,15,17,25,34,37,40,43,44,57,58). Durante la fase aguda de la enfermedad (primeras cinco semanas de infección), en las ovejas inoculadas experimentalmente se acentuó un gran decaimiento y anorexia, generándose una pérdida progresiva del peso corporal, la cual alcanzó una disminución de un 25% en comparación al promedio de los pesos de preinfección y al promedio total de peso de las ovejas controles (Figura 2). Con relación con la comparación individual de los pesos en animales infectados, las variaciones oscilaron entre un 15 y 28% (Cuadro 2). Estadísticamente se encontraron diferencias significativas (P < 0,01) entre medidas de pre y postinfección de las ovejas infectadas, así como también entre las medias totales de las ovejas infectadas y controles. La pérdida de peso promedio (25%) sufrida por las ovejas inoculadas no contrastó de manera negativa con lo presentado por Edwards et al. (16) quienes encontraron que las ovejas y cabras infectadas con T vivax perdieron un 30% o más de peso corporal. Igualmente, los datos de pérdida de peso en los animales infectados concordaron con las informaciones suministradas sobre cabras y ovejas infectadas con T vivax por Isoun y Anosa (30) e Isoun (3). Dentro del mismo orden de ideas encontramos los trabajos de Vohradsky (59) en infecciones con T. vivax y Naylor (43) con T congolense en bovinos, así como los de Ikede y Losos (26); Bouteille et al. (5) los cuales informan que las ovejas inoculadas experimentalmente con T. brucei pierden aproximadamente un 20% de peso en comparación con los controles usados en la misma investigación. Otros autores que estudiaron la flsiopatología de las tripanosomiasis en los animales domésticos, han inferido que la parasitosis no parece afectar la ganancia diaria de peso, pero sí, el promedio de peso vivo (21, 28, 55).
CONCLUSIONES El comportamiento clínico de la tripanosomiasis, provocada por el aislado venezolano, inoculado experimentalmente en ovejas, expresa una fase aguda durante las primeras cinco semanas de infección, seguida por una fase subaguda entre la sexta y novena semana de infección, para presentar hacia el final de la enfermedad ( décima semana de infección en adelante) una fase crónica. Los signos clínicos más característicos estuvieron representados por: fiebre de tipo remitente; parasitemia ondulante; decaimiento; pérdida de brillo en el pelo; palidez de las mucosas; deterioro de la condición corporal y pancitopenia. SUMMARY Phisiopatology of the anaemia that a Venezuelan isolated of T vivax produces on small ruminants was estimated on nine randomly taken crossbred West-African ewes, that averaged two years old and 50.2 ± lb of body weight. The ftrst six ewes were intravenously inoculated with 1,0 ml of blood that containing rougtly 3.106 parasites from a positive goat; the other three conformed the control group trial. Parasitaemia, temperature, body weight and clinical signs, were evaluated during 120 days. Clinical permormance of sicknees showed an acute, a subacute and a cronic phases. Clinical signs more common were; remittent fever, ondulating parasitaemia, weakness and loss of hair brightness, pale mucous membrane and deterioration of the body condition. BIBLIOGRAFÍA
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||