|
Veterinaria Tropical 21(1): 75-84.
1996
DETECCIÓN DE Salmonella sp. EN POLLOS CONGELADOS, EN EL ESTADO ARAGUA1 Antonio José León*, Dilia M. Infante*, Carmen de Noguera*, A. J. Herrera* y P. Valdillo* 1Trabajo financiado por FUNDACITE
Aragua
y FUNDACITE
Carabobo |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
RESUMEN Para determinar la presencia de Salmonella se analizaron 50 pollos beneficiados congelados adquiridos en expendios al detal, correspondientes a cinco marcas comerciales I, II, III, IV, y V. Se utilizó el método de enjuague de la canal descrito por COX et al., modificado, empleando como medio de enriquecimiento Caldo Tetrationato (CI) con solución iodo-iodurada y verde brillante en concentraciones de 2% y 1 %, respectivamente. Del total de pollos muestreados, el 58% resultó positivo a Salmonella. El porcentaje de aislamientos por marcas comerciales estuvo comprendido entre 40 y 70%. Las salmonelas aisladas pertenecen a los serogrupos B, C, D, E y R, mostrando porcentajes de frecuencia entre 0,5 y 22%, correspondiendo el mayor porcentaje a los serogrupos C y D con 22% de aislamientos cada uno. Se obtuvo un promedio de tres serogrupos de salmonela diferentes por marca, excepto para la marca IV, en la cual sólo se aislaron salmonelas pertenecientes al grupo D. El medio de enriquecimiento CT mostró una mayor sensibilidad, obteniéndose un porcentaje de aislamiento de 40%, asimismo el medio XLT4 (42%) resultó superioral medio VBAN (22%). Palabras Clave: Salmonella sp.; detección; pollos congelados. INTRODUCCIÓN La salmonela puede sobrevivir en la superficie externa de las aves vivas, lo cual representa una importante fuente de contaminación cruzada durante el procedimiento y esto puede ocurrir en cualquiera de los puntos de la cadena de comercialización del producto final. La contaminación de las aves o canales con salmonelas representan un peligro potencial, tanto para la seguridad del alimento como para la salud pública, ya que las aves y sus derivados son frecuentemente incriminados como responsables de toxiinfecciones alimentarias en los humanos (D'AOUSTet al., 1982;De AVILA et al., 1974; LAMMERDING et al, 1988; NIVAS et al., 1973). La presencia de Salmonella en las canales de aves está influenciada por la contaminación cruzada durante el procesamiento donde intervienen una gran variedad de factores (COLIN, 1978; MORRIS y WELLS, 1970; SIMMONS y BYRNES, 1972). Las cajas donde transportan a las aves de las cajas a las plantas beneficiadoras representan una fuente importante de contaminación con salmonelas (RIGBY et al, 1980 a, b ). Las operaciones de beneficio y transformación de las carnes de aves favorecen la diseminación de microorganismos en particular de Salmonella (CAMPBEEL et al., 1983; COLIN, 1978; CUNNINGHAN, 1982; ROBERTS, 1990), aún cuando el número de aves contaminadas con salmonelas al inicio del procesamiento no sea muy alto (COX et al., 1981; CUNNINGHAM, 1982;DOUGHERTY, 1974) y el grado de contaminación de los pollos que ingresan a las plantas procesadoras sea relativamente bajo, puede ocurrir una diseminación mecánica durante la etapa del desplume (IZAT et al., 1991; VILLARREAL et al., 1990). Los procesos de sacrificio y evisceración contribuyen a aumentar la frecuencia de salmonela en el producto final (CAMPBEEL et al., 1982; MORRIS y WELLS, 1970). La materia fecal es en gran parte responsable de la transferencia de salmonela a otras aves durante el procesamiento (BILGILL et al., 1992). La ruptura de la pared intestinal de las aves durante la evisceración origina contaminación interna y externa de las canales, así como de los equipos, en ése punto la diseminación puede efectuarse muy rápido después del paso de un lote contaminado (MORRIS y WELLS 1970). Algunos investigadores señalan que aunque la contaminación de las canales puede ser reducida en algunos puntos del proceso, las mismas pueden recontaminarse durante la evisceración o el enfriamiento (MORRIS y WELLS, 1970). Las canales de aves y otros alimentos están frecuentemente contaminados con Salmonella (ROBERTS, 1990). El grado de contaminación del pollo comercial puede ser variable, debido a las diferencias en las prácticas sanitarias de las plantas procesadoras y la posterior manipulación en las ventas al detal (CUNNINGHAN, 1982; DOUGHERTY, 1974). El objetivo general de este trabajo fue detectar Salmonella sp. en pollos beneficiados congelados de cinco marcas comerciales diferentes, adquiridos en expendios al detal en el estado Aragua. MATERIALES Y MÉTODOS Muestras. Se analizaron 50 pollos congelados de cinco marcas comerciales diferentes (I, II, III, IV y V), adquiridos en expendios al detal a razón de dos pollos por semana. El número de muestras procesadas por marca fue de diez pollos. Análisis bacteriológico. Se utilizó la técnica del enjuague de la canal entera en 100 ml de agua peptonada (APT), según técnica descrita por COX et al. en 1981 con algunas modificaciones. Cada canal, una vez descongelada a temperatura de laboratorio, fue colocada en una bolsa plástica de cierre hermético, agregando luego 100 ml de APT y agitando vigorosamente en forma manual durante 1 min. Una vez retirada la canal de la bolsa se incubó al APT a 37°C por 24 h y se transfirieron 10 ml de él a 100 ml de Caldo Tetrationato (CT), adicionado con solución iodo-iodurada y verde brillante en concentraciones de 2 y 1 %, respectivamente; se incubó por una noche a 37°C y se repicó en placas de verde brillante agar novobiocina (VEAN) y Xilosa Lisina Tergitol4 (XLT4). Paralelamente, se hicieron subcultivos en CT y caldo selenito (CS), transfiriendo 1 ml de CT a 10 ml de cada uno de los medios mencionados anteriormente, para obtener las combinaciones CTT y CTS respectivamente, las cuales fueron incubadas a 37°C por una noche y repicadas en placas de VEAN y XL T4. Para la identificación de los aislamientos se utilizó la técnica descrita por INFANTE et al, (1981), la seroagrupación se hizo de acuerdo al método de EDWARDS y EWING (1972). RESULTADOS Y DISCUSIÓN Luego de realizar los análisis, 29 muestras resultaron positivos a Salmonella, lo cual representa 58% del total. El aislamiento de salmonelas, por marcas comerciales estuvo comprendido entre 40 y 70% (Cuadro 1).
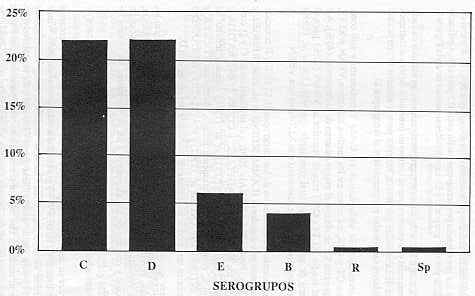
En ensayos similares IZAT et al. (1991) señalan porcentajes de positividad a Salmonella entre 17 y 50% en canales congelados de tres marcas diferentes. En Portugal, MACHADO y BERNARDO (1990) detectaron un promedio de 57% de canales de pollos positivos a Salmonella sp, lo cual coincide con lo señalado en el presente estudio. Porcentajes superiores al 50% han sido encontrados por varios investigadores; LAMMERDING et al, (1988), en Canadá obtuvieron resultados de 60,9% y 67,1% en pollos y pavos beneficiados, respectivamente, y D' AOUST et al., (1982) detectaron 95% de canales de pollos contaminados con salmonelas. En Estados Unidos VILLARREAL et al., (1990) señalan 70% de canales de pavos positivas a salmonela y RENGEL y MENDOZA (1984), en Venezuela, señalan un 91% de pollos beneficiados contaminados con salmonela. El Caldo Tetrationato es uno de los medios de enriquecimiento más ampliamente utilizado para el aislamiento de salmonela nuestros resultados lo señalan como más efectivo que las combinaciones utilizadas, lo cual sustenta los trabajos de INFANTE et al. (1992); D'AOUST et al. (1982) y VILLARREAL et al. (1990), quienes obtuvieron mayor porcentaje de aislamientos de Salmonella con CT . Las salmonelas aisladas pertenecen a los serogrupos B, C, D, R y una no tipificada. La prevalencia por serogrupo osciló entre 0,5 para el no tipificado y el R, y 22% para los grupos C y D. Los detalles se muestran en la Figura 1.
En el Cuadro 1 se señalan los serogrupos de salmonelas aislados en cada marca comercial y se observa que se obtuvo un promedio de tres serogrupos diferentes de salmonelas por marca, excepto para la número IV, en la cual sólo se aislaron salmonelas pertenecientes al serogruposD. El porcentajes de aislamientos en Caldo Tetrationato y sus combinaciones CT y CTS, así como en los medios selectivos VBAN y XLT4, revelan que con CT se obtuvo el mayor número de aislamientos (40%). Así mismo, el medio XLT4 (42%) resultó superior al VBAN (22%) para el aislamiento de salmonela, lo cual concuerda con MILLER et al. (1991) quienes obtuvieron mayor rendimiento con XLT4 que con VBAN. El aislamiento de salmonelas de los serogrupos B, C, D, E y R coincide con numerosos investigadores (LAMMERDING et al., 1988; RENGEL y MENDOSA, 1984; VILLARREAL, 1990) y el predominio de C y D concuerda con los hallazgos de LAHELLEC y COLIN (1984), BATHIA y McNABB (1980) y CUNHA NETTO et al. (1976) quienes señalan al serogrupo C como la más comúnmente aislado. Asimismo TUCKER y GORDON (1968), INFANTE et al (1992) y MACHADO y BERNARDO (1990) señalan una mayor incidencia de salmonela del serogrupo D. El elevado número de aislamientos de Salmonella de las canales procesadas, revela los graves riesgos a los que está sometida la población, de ahí la importancia y necesidad de optimizar las medidas higiénicas de preparación y cocción de los alimentos, a fin de minimizar los riesgos de infección. SUMMARY In order to determine the presence of Salmonellas, 50 frozen carcasses from five brands (1, II, III, IV, V) purchased at retail, were analized. Whole carcass rinse method descrit for Cox et al. modified, using Tetrathionate broth.(CT) with iodine and brilliant green (2% and 1%, respectively) as enrichment medium. The 58% of the carcasses were positive to Samonelle and positive isolation the brands samples ranged from 40 to 70%. The Salmonellas isolated belong to the B, C, D, E and R serogroups with a frecuence between 0,5 and 22%. The high percentage were of the serogroups C and D with 22% each. There were isolated three serogroups in aI1 the brands, except to brand IV, in which only was isolated Salmonellas D. The CT medium show the highest sensibility, with 40% isolation. Salmonellas. The media XLT4 (42%) result better than VBAN (22%), to isolate the Salmonellas . Key Words: Salmonella sp.; detection; frozen carcasses. BIBLIOGRAFÍA BATHIA, T. R. S. and G. D. McNABB. 1980. Dissemination of Salmonella in Broiler chickens Operations. Avian Diseases. 24:616-624. BILGILL, S. F., J. P. JETTON, D. E. CONNER, J. S. KOTROLA and E. T. MORAN. 1992. Jr. Microbiological quality of Commercially Processed Broiler Carcasses. The influence of fecal contamination during evisceration. Procceding Internationa1 Symposium Salmonella and Salmonellosis. France. Ploufragan/Saint-Brieuc. pp 118-119. CAMPBEEL, D. F., S. S. GREEN, C. S. CUSTER and R. W. JOHNSTON. 1982. Incidence of Salmonella in Fresh Dressed Turkeys Raised Under Salmonella controlled and Uncontrolled Enviroments. Poulty Science. 61:1962-1967. CAMPBEEL, D. F., R. W. JOHNSTON, C. S. CAMPBEEL, D. McCLAIN and J. F. MACALUSO.1983. The Microbiology of Raw, Eviscerated chickens. A Ten Year Comparison. Poultry Science. 62:437-444. COLIN, P. 1978. Influence des conditions d'environnement Sur la dissemination des Salmonella chez les volailler, avant et pendant les operations d'abattage. Bulletin d'Information Station experimentale D'aviculture de Ploufragan (Cotes du Movd). France. 18:79-88. COX, N A., J. E THOMSON and J. S BAILEY 1981 Samp1ing or Broiler Carcaresses for , Salmonella With Low Volume, Water Rinse. Poultry Science. 60:768-770 CUNHANETTO, S.J., P CALDEIRA BRANT, M de D FERREIRA and G. V. ALVARES PESSOA 1976 Serotipos de Salmonella aislados de carcacas de frangos de corte, em tres abatedouros, em belo horizonte-MG. Brasil. Arquivos da Escola de Veterinaria de Universidade Federal de Minas Gerais.28:125-129. CUNNINGHAM, F .E. 1982. Microbiological aspects of poultry and poultry products an update. Journal of Food Protection. 45:1149-1164. D'AOUST, J. Y., P. STOTLAND and A. BOVILLE. 1982. Sampling methods for detection of Salmonella in raw chicken carcasses. Journal of Food Science. 47:1643-1645. De AVILA, F. A., M. de D. FERREIRA and E. N. Da SILVA. 1974. Salmonella em carcacas de aves manipuladas nos abatedouros de Belo Horizonte. Brasil. Arquivos de Escola de Veterinaria de Universidades Federal de Minas Gerais. 26:211-214. DOUGHERTY, T.J. 1974. Sal monella contamination in a Commercial Poultry (Broiler) Processing operation. Poultry Science. 53:814-821. EDWARDS, P .R. and W .H. EWING. 1972. The genus Salmonella. Indentification of Enterobacteriaceae. Ch 8. 3a. ed. Burgess. Publishing Company Minneapolis. Minnesota. pp.146-207. INFANTE, D, A. LEÓN, C. de NOGUERA y C. QUIROZ. 1981. Metodología para el diagnóstico bacterio1ógico y sero1ógico de la Salmonelosis Aviar. Instituto de Investigaciones Veterinarias. FONAIAP Venezuela. pp 1-10. INFANTE, C. de NOGUERA, A. J. LEÓN, M. CATARI and A. HERRERA. 1992. Prevalence of Salmonella in Chicken carcasses. Proceedings International Symposium Salmonelosis. Ploufragan/Saint-Brieuce. France. pp 120-l21. IZAT, A. L., J. M. KOPEK and J. D. McGINNIES. 1991. Research Note: Incidence, Number and Serotypes of Salmonella on Frozen Broiler Chickens at Retail. Poultry Science. 70:1438-1440. LAHELLEC, C. and P. COLIN. 1984. Influence of Proccesing on Salmonella contamination of Poultry carcasses: Possibilities of improvement.Proceedings of the International Symposium on Salmonella. New Orleans, Louisiana. USA. pp 249-256. LAMMERDING, A. M., M. M. GARCÍA, E. D. MANN, Y. ROBINSON, W. J. DORWARD, R. B. TREESCOT and F. TITTIGER.1988. Prevalence of Salmonella and Thermophilic Campylobacter in Fresh Pork, Beef, Veal and Poultry in Canadá. Journal of Food Protection 51:47-52. MACHADO, J. and F. BERNARDO. 1990. Prevalence of Salmonella in chicken carcasses in Portugal. Journal of Applied Bacteriology 69:477-480. MILLER, R. G. and C. R. TATE. 1991. Xylose-Lysine-TergitoI4: An Improved Selective agar Medium for the Isolation of Salmonella. Poultry Science 70: 2429-2432. MORRIS, G. K. and J.G. WELLS. 1970. Salmonella contamination in a poultry processing plant. Applied Microbiology. 19:795- 799. NIVAS, S. C., M. C. KUMAR, M. D. YORK and B. S. POMEROY. 1973. Salmonella Recovery from Turkey -Processing Plants in Minnesota. Avian Diseases. 17:605-616. RENGEL, A. and S. MENDOZA. 1984. Isolation of Salmonella from raw chicken in Venezuela. Journal of Food Protection. 47:213-216. RIGBY, C.E., J.R. PETTIT, M.F. BAKER, A.H. BENTECY, M.O. SALOMONS and H. LIOR. 1980. Sources of Salmonellae in an Uninfected Commercially-processed Broiler FIock. Canadian Journal of Comparative Medicine 44:267-274. RIGBY, C. E., J. R. PEITIT, M. F. BAKER, A. H. BENTECY, M. O. SALOMONS and H. LIOR. 1980. Flock Infection and Transport as source of Salmonellae in broiler chickens and carcasses. Canadian Journal of Comparative Medicine. 44:328-337. ROBERTS, D. 1990. Sources of infection: food. Lancet: 336:859-861. SIMMONS, G. C. and R. V. BYRNES. 1972. The origin of Salmonellas in chickens and Chicken Carcasses. Australian Veterinary Journal. 48:186- 189. TUCKER, J. F. and R. F. GORDON. 1968. The Incidence of Salmonellae in Poultry Packing Station. Bristish Veterinary Journal. 124:102-109. VILLARREAL, M. E., R. C. BAKER and J. M. REGENSTEIN. 1990. The incidence of Sa1monella on poultry carcasses. Following the use of slow release chlorine Dioxide (Alcide ). Journal of Food Protection. 53:465-501. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||