|
Veterinaria Tropical 21(1): 59-74.
1996
ORIGEN CULTIVO in vitro Manuel
Toro Benítez*, Sonia Montenegro-James,** Pedro Ramos*, *Investigadores.
FONAIAP
Centro Nacional de Investigaciones
Agropecuarias |
||||||||||||||||||||||||||||||||||||||||
|
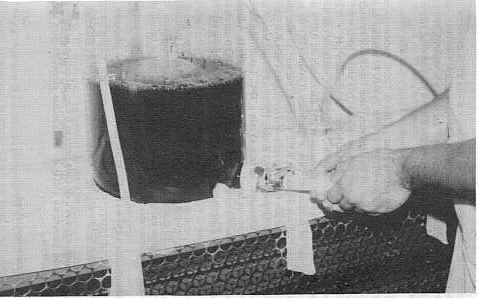
RESUMEN Se reseñan los resultados de un intento de producción de vacuna anti-babesiosis inactivada bivalente (B. bovis/B. bigemina), origen cultivo in vitro, obtenidos mediante la utilización de un fermentador experimental como método modificado de la técnica microaerófila en fase estacionaria (MASP). Como factor de crecimiento se utilizó suero bovino normal (SON) tratado con polietilinglico (PEG) ya l cultivo se mantuvo en suspensión con agitación continua a 37oC. Diariamente, se tomaron muestras del cultivo para determinar contenido antigénico (prueba inmunoenzimática de doble anticuerpo, ELISA), parasitemia y hematocrito. Aunque los valores de exoantígeno en el sobrenadante resultaron inferiores a los observados en pruebas anteriores, la vacuna mostró capacidad para inducir la formación de anticuerpos específicos en bovinos susceptibles (prueba de inmunonorescencia indirecta, IFA). El método evaluado, con mejor rendimiento que el micrométodo convencional MASP. podría ser utilizado para la elaboración de la vacuna a un nivel semi-industrial; siendo además, un procedimiento de fácil manejo y menor costo. La vacuna, así producida, constituye un método eficiente y práctico para la prevención de la babesiosis bovina en Venezuela. Palabras Clave: Babesia; vacuna; exoantígeno. INTRODUCCIÓN La babesiosis bovina, enfermedad hemoparasitaria causada por Babesia bovis (BABES, 1888) y B. bigemina (SMITH y KILBOURNE, 1893), constituye uno de los mayores obstáculos en el desarrollo de la industria ganadera en América Latina. Ambas especies, transmitidas por garrapatas del género Boophilus (CANNESTRINI, 1887), generalmente coexisten en climas húmedos y calurosos que favorecen a la vez el desarrollo de la garrapata vectora (CALLOW, 1974). La babesiosis bovina está presente en la mayoría de los países tropicales y sub-tropicales del mundo, en los cuales aproximadamente un billón de bovinos corren el riesgo de contraer la infección (McCOSKER, 1981). La babesiosis tiene una alta prevalencia en los rebaños bovinos nacionales, variando el riesgo a enfermarse de acuerdo a factores tales como: la diversidad en prácticas de cría y manejo, condiciones climáticas regionales, métodos preventivos utilizados, tamaño y distribución del rebaño (JAMES et al., 1985; MONTENEGRO-JAMES, 1992; TORO BENITEZ, 1990). En la prevención de la babesiosis bovina se ha intentado la aplicación de diversos procedimientos: 1. Uso de cepas patógenas, seguido de observaciones clínicas y control terape6tico de la infección; método conocido tradicionalmente como "premunición" (SERGENT et al., 1924); 2. Uso de cepas de baja patogenicidad, atenuadas por diversos procedimientos tales como: masajes continuos seriados por becerros esplenectomizados (CALLOW, 1971, 1977; CALLOW y MELLORS, 1966; DEVOS, 1978) o por irradiación (PURNELL et al., 1978; PURNELL y LEWIS, 1981; PURNELL et al., 1984); 3. Uso de drogas específicas de acción lenta que permiten controlar la infección y el establecimiento de una estado de portador crónico, garante de una inmunidad co-infecciosa (CALLOW y Mc GREGOR, 1970; ROY -SMITH, 1971; TODOROVIC et al., 1973) y 4. Uso de productos o sub-productos parasitarios no viables, obtenidos bien de animales activamente infectados (MAHONEY, 1967 y 1981; MAHONEY y GOODGER, 1972) o derivados del cultivo in vitro de Babesia spp. (KUTTLER et al., 1982; MONTENEGRO-JAMES et al., 1989; SMITH et al., 1981). La efectividad de una vacuna inactivada, derivada del cultivo in vitro de Babesia bovis y B. bigemina, ha sido exhaustivamente estudiada en el Instituto de Investigaciones Veterinarias, CENIAP -FONAIAP, Maracay, Venezuela, mediante ensayos controlados de campo de laboratorio, los cuales mostraron que la vacuna de exoantígeno es segura, estable y con un buen grado de protección tanto homóloga como heteróloga (MONTENEGRO-JAMES, 1989). El estudio comprendió II pruebas controladas de laboratorio y 16 pruebas de campo con un total de 7 390 animales vacunados en condiciones de exposición natural, dentro de un rango amplio de rasgos epidemiológicos y sistemas de cría y manejo (MONTENEGRO-JAMES et al., 1992). Sin embargo, el procedimiento utilizado para su elaboración, Método Microaerófllo en Fase Estacionaria (MASP) no representa una técnica que permita su producción en cantidades adecuadas y suficientes, para cubrir los requerimientos para la vacunación de la población bovina nacional susceptible y en riesgo de contraer gravemente la infección, con las consiguientes pérdidas económicas directas e indirectas que ello acarrea. En el presente trabajo, se reseñan los resultados de intentos de producción de la vacuna anti-babesiosis, origen cultivo in vitro, a un nivel semi-industrial, mediante la utilización de un fermentador experimental. MATERIALES Y MÉTODOS Animales Experimentales y Cepas de Babesia Como reactivadores de las cepas de Babesia utilizadas en la elaboración del inmunógeno, se usaron becerros mestizos, susceptibles, esplenectomizados de 6 a 8 meses de edad. Un lote de doce bovinos mestizos Holstein, con edades comprendidas entre 10 y 16 meses, serológicamente negativos a Babesia spp. (prueba IFA), se utilizó en una prueba de inmunogenicidad con el fin de determinar la capacidad de inducción de anticuerpos específicos in vivo. Los bovinos experimentales se mantuvieron en galpones cerrados a prueba de insectos y se alimentaron con concentrados, sales minerales y agua adlibitum. Las Babesia utilizadas correspondían a cepas de B. bovis y B. bigemina aisladas en Venezuela y mantenidas en el laboratorio como "estabilizados" criopreservados en nitrógeno líquido. Cultivo y Elaboración del Inmunógeno En el cultivo de las Babesia fueron aplicados los principios generales descritos por LEVY y RISTIC (1980) y VEGA et al. (1985) para la propagación in vitro de B. bovis y B. bigemina, respectivamente. Las modificaciones introducidas incluyeron fundamentalmente en el uso de un fermentador experimental (OBREGON et al., 1984) y la edición de suero bovino normal (SBN), tratado con polietilenglicol (PEG); como factor de crecimiento. El vaso fermentador (Figura 1) consistió de un frasco Schott de 15 1 de capacidad provisto de tres aberturas: dos superiores y una inferior, las cuales portaban, a través de tapones, los elementos de manejo de la unidad de fermentación, permitiendo la realización de las diferentes tareas requeridas por el proceso (introducción del material, insuflación de gases, cosecha del sobrenadante, toma de muestras para análisis, etc.). Los cultivos se iniciaron con sangre defibrinada proveniente de becerros infectados con B. bovis y/o B. bigemina, con un hematocrito aproximado de 20% y una parasitemia de 2,0%, la cual se mezcló para una hematocrito final de 10% con el medio de cultivo (Medio 199, Siqma N° M-2520, Sigma Chemical Co., St. Louis, MO), adicionado de suero normal (20% para B. bovis y 30% para B. bigemina). En el cultivo de B. bigemina se añadió además, un 10% de Medio de VEGA et al. (1985). Continuamente se insufló una mezcla de gases constituida por CO2 (5%), Oxígeno (20%) y Nitrógeno (gas base) y se mantuvo el cultivo en constante agitación ("stirrer" magnético) en estufa a 37°C. El suero bovino normal (SBN) se obtuvo mediante tratamiento con PEG (Polyethylene Glycol 6000, J.T. Baker, New Jersey) de suero recolectado en matadero según técnica descrita por BARTELING (1974). Diariamente, fueron tomadas muestras del cultivo para la determinación de hematocrito, parasitemia, contenido antigénico de los sobrenadantes y control bacteriológico. La cosecha del sobrenadante, realizada cada 24 h, se hizo mediante centrifugación del cultivo total (1.500 a 2.000 rpm por 15 min, a 4°C), separándose el sobre nadan te y añadiéndose, cada vez, un volumen similar del medio completo. Los sobrenadantes se guardaron en congelación para su posterior mezcla (vacuna bivalente) y liofilización. Contenido antigénico de los cultivos El contenido antigénico de los cultivos se cuantificó mediante una prueba inmunoenzimática de doble anticuerpo (Elisa), de acuerdo con la técnica descrita por MONTEALEGRE et al. (1987), utilizando conjugados específicos anti-B.bovis-HRPO (peroxidasa de rábano picante) y anti- B.bigemina-FA (fosfatasa alcalina). Las inmunoglobulinas bovinas (IgG) fueron aisladas de sueros hiperinmunes recolectados de bovinos inmunizados con exoantígenos de cultivo de B. bovis y B. bigemina, y posteriormente, desafiados con cepas virulentas. Las inmunoglobulinas se fraccionaron con ácido caprílico, se purificaron por cromatografía (STEINBUCH y AUDRAN, 1969) y se conjugaron con peroxidasa de rábano picante (WILSON y NAKANE, 1978) o fosfatasa alcalina (AVRAMEAS, 1969) para B. bovis y B. bigemina, respectivamente.
El procedimiento básico para la prueba Elisa de Doble Anticuerpo se adaptó del método descrito por BURKOT et al. (1984). El montaje de la prueba consistió esencialmente en los siguientes pasos: Fijación de anticuerpos específicos (IgG) purificados en microplacas (IgG anti-B.bovis o anti- B.bigemina diluidas 1:600 en buffer carbonato-bicarbonato pH = 9,2). Adición del sobrenadante de los cultivos, en triplicado, iniciando con una dilución 1:2 en solución fosfatada buffer (PBS) adicionada de 0,05% de Tween-20 y con un mínimo de cuatro diluciones. Lavado (3X) de las microplacas con PB5 adicionado de 0,1% Tween-20 durante 10 min., con agitación enérgica y secado final. Agregado del conjugado específico (anti- B.bovis-HRPO o anti-B.bigemina-FA) diluido 1:500 en PBS adicionado de Tween-20 al 0,05% incubando durante 45 min. a 37°C. Lavado similar al descrito anteriormente con lavado final utilizando agua destilada. Adición del substrato, tetrametil-benzidina (TMB) para B.bovis-HRPO o nitrofenil fosfato (NFP) para B.bigemina-FA, incubando en la oscuridad durante 60 min. La reacción se leyó por colorimetría (Titertek Multi-Skan II) utilizando filtro de 450 nm. El contenido de exoantígeno en los sobrenadantes del cultivo, expresado en unidades ELISA por mililitro (UE/ml), se calculó de acuerdo a la siguiente relación:
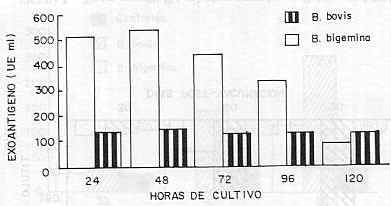
El contenido antigénico de cada proceso o fase del cultivo se expresó como la media geométrica (MG) de las cosechas obtenidas para cada especie de Babesia. Prueba de Inmunogenicidad Doce bovinos mestizos Holsteins, de 10 a 16 meses de edad, serológicamente negativos a Babesia (prueba IF A), divididos en dos grupos experimentales fueron vacunados con diferentes dosis de inmunógeno bivalente: el grupo I (n = 6) recibió el equivalente a 30,0 ml de sobrenadante de cultivo, correspondiendo a un contenido antigénico de 5. 000 unidades Elisa/dosis para cada especie de Babesia. La dosis vacunal, contenida en un volumen final de 3,0 ml, se aplicó por vía subcutánea en dos dosis con intervalo de 30 días, adicionada de 2,0 mg de Saponina Quil-A purificada (Superfos Biosector a/s., Denmark) como adyuvante. El grupo II ( n = 6) se vacunó en forma similar recibiendo el equivalente de 15,0 ml de sobrenadante (2.500 UE/especie de Babesia). Tres bovinos, en condiciones similares de manejo, se mantuvieron sin vacunar como animales controles (la prueba se realizó en el Instituto de Producción Animal de la Facultad de Agronomía, UCV, Maracay). Muestras séricas, tomadas los días O (pre-vacunación), 30, 60 y 90 (post-vacunación) fueron analizadas mediante la técnica indirecta de anticuerpos flourescentes (IFA), según método descrito por JAMES et al. (1981). Los resultados se analizaron y compararon mediante la prueba "t" de significancia. RESULTADOS Y DISCUSIÓN En el Cuadro 1 se presentan los valores promedios (MG) del contenido antigénico (Prueba Elisa de Doble Anticuerpo) y la parasitemia (%EP) de los cultivos de B. bovis y B. bigemina obtenidos mediante la utilización de un fermentador experimental de 15 l de capacidad, como intento para la evaluación de un procedimiento de mayor rendimiento en comparación con el micrométodo MASP usado hasta el presente en la elaboración de la vacuna anti-babesiosis, origen cultivo in vitro. En B. bovis la parasitemia osciló entre 0,4% EP (cultivo de 24 h) y 0,3% ( cultivo de 120 h) para un promedio general de 0,39% en todo el proceso de cultivo. El contenido antigénico de los sobrenadantes estuvo entre un mínimo de 118,5 UE/ml y un máximo de 140,6 UE/ml, para un promedio final de 127,0 UE/ml. En B. bigemina la parasitemia promedio fue de 0, 77% EP , en tanto que, el contenido antigénico promedio del sobrenadante resultó mayor que el de B. bovis (MG = 320,0 UE/ml y 127,0 UE/ml para B. bovis y B. bigemina. respectivamente).
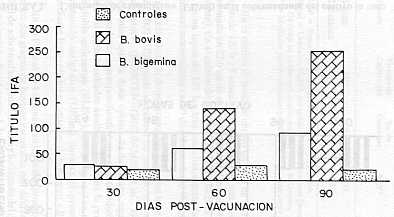
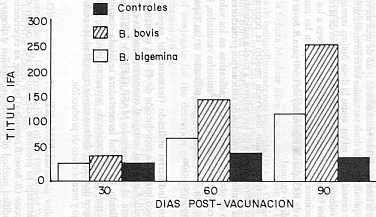
En el cultivo B. bovis se obtuvo un total de 33 l. de sobrenadante en un lapso de 120 h y 5 cosechas realizadas, con una dosis vacunal monovalente estimada en 22,0 ml de sobrenadante (22,0 ml/eq = 2 500 UE aproximadamente). En el cultivo de B. bigemina, la producción total obtenida fue de 12 l, en un lapso de 120 h y tres cosechas efectuadas, estimándose la dosis vacunal monovalente en 8,0 de sobrenadante (8,0 ml/eq. = 5 000 VE). El cálculo de la dosis vacunal bivalente con base en un valor aproximado de 5.000 UE/especie se estimó de acuerdo con experiencias previas de laboratorio (MONTENEGRO-JAMES et al., 1989), en las cuales, se determinó que la dosis óptima de la vacuna equivalía a 10,0 ml/eg. de sobrenadante, correspondiendo esto a aproximadamente 5600 UE por dosis vacunal según resultados analíticos mediante la prueba inmunoenzimática de doble anticuerpo (ELISA). En la Figura 2 se muestran los valores de contenido antigénico (UE/ml) durante el proceso de cultivo in vitro mediante fermentador experimental de B. bovis y B. bigemina. En las Figuras 3 y 4 se muestran los títulos promedios de anticuerpos IFA en los dos grupos de bovinos vacunados con diferentes dosis (5.000 y 2.500 VE) de sobrenadante, concentrado y liofilizado del cultivo in vitro de B. bovis y B. bigemina. En el grupo I, los títulos IFA oscilaron entre 1:28 (30 días después de la primera dosis vacunal) y 1:89 (90 días post-vacunación) para B. bigemina y de 1:25 (día 30) a 1:254 (día 90) para B. bovis (Figura 3). En el grupo II, los títulos IFA estuvieron entre 1:25 (30 días después de la primera dosis vacunal y 1:118 (90 días post-vacunación) para la especie B. bigemina y entre 1:35 (día 30) y 1:253 (día 90) para la especie B. bovis (Figura 4). Los bovinos controles no mostraron seroconversión.
Los valores de contenido antigénico resultaron inferiores a los contenidos en experiencias previas. MONTENEGRO-JAMES et al., (1987) obtuvo valores aproximados de 650 UE/ml para B. bovis y de 500 UE/ml para B. bigemina. Sobre la base de dichos resultados se trató de usar un volumen de sobrenadante equivalente a las dosis vacunales anteriormente utilizadas, entre las cuales se consideró 10 ml/eg. como la dosis óptima inmunizante. Por otra parte, los valores de los títulos IF A, como indicadores de la reacción inmunológica en los bovinos vacunados, resultaron inferiores a los observados en investigaciones previas (TORO et al., 1980), en las cuales, se constataron títulos de 1:432 para B. bigemina y de 1:640 para B. bovis usando 10,0 ml/eq. como dosis vacunal. Sin embargo, la seroconversión observada mostró la presencia de exoantígenos en los sobrenadantes de los cultivos, a niveles suficientes para estimular el sistema inmune y la formación de anticuerpos protectores frente a la infección. No se observó diferencias significativas en los valores de seroconversión al comparar los dos grupos de animales vacunados, lo cual, podría indicar que aún dosis menores a las utilizadas serían capaces de estimular la inmun-protección. El método semi-industrial utilizado (fermentador experimental) permitió en un único intento la reproducción de 45 l de sobrenadante de cultivo, lo cual significó una real ventaja al compararse con las cantidades obtenidas mediante el micrométodo MASP (LEVI y RISTIC, 1980) anteriormente utilizado. La unidad fermentadora señalada constituye un método mejorado para la elaboración de la vacuna bivalente inactivada anti-babesiosis, origen de cultivo, dada su mayor capacidad de rendimiento, facilidad de manejo y menor costo de producción. SUMMARY Results of an attempt to produce inactivated bivalent culture-derived anti-babesiosis vaccine (B. bovis/B.bigemina) by using an experimental fermentator as a modified method of the microaerophilus stationary phase technique (MASP) are reported. As growing factor, normal bovine serum (NBS) treated with polyetilenglicol (PEG) was used and the culture was maintained in suspension and continuous shaking at 37°C. Daily, samples of culture were taken to determine antigenic content (two steps EIA test). parasitemia and packed cell volume. Despite of exoantigen values were lower as compared with previous tests. vaccine showed capacity to induce the production of specific antibodies in susceptible cattle (IFA test). The method evaluated. with a higher yield than conventional micromethod MASP, could be used to elaborate vaccine at a semiindustriallevel. Furthermore, the method is easy to handle and cost of production is lower. Vaccine. produced in that way, is an efficient and practical method to prevent bovine babesiosis in Venezuela. Key Words: Babesia; vaccine; exoantigen. AGRADECIMIENTO A la Señora Maglene Silva por su cooperación en la conducción de la prueba de inmunofluorescencia indirecta (IF A), a Daniel Cadenas y José R. Blanco por su ayuda en el manejo del fermentador experimental y a Jorge Luis Silva por su colaboración en la recolección de muestras a campo. BIBLIOGRAFÍA AVRAMEAS, S. 1969. Coupling of enzyrnes to proteins with glutaldehyde. Use of conjugate for the detection of antigens and antibodies. Inmunochemistry 6: 43. BARTELING, J.S. 1974. Use of polyethyleneglycol treated serum to production of foot and mouth disease virus in growing BHK suspended cell cultures. Bull. Of. Int. Epiz.: 81 (11-12): 1243-1254. BURKOT, T .R. et al. 1984. Identification of malaria infected mosquitoes by a two-site enzyme linked inmunosorbent assay. Am. J. Trop. Med. Hys. 33: 227. CALLOW, L.L. 1971. The control of babesiosis with a highly infective attenuated vaccine.In: Proceedings of the 19th World Veterinary Congress. Vol. I. Lito Arte México. p. 357-360. CALLOW, L. L. 1974. Epizootiology, diagnosis and control of bovine babesiosis and anaplasmosis. Revelance of Australian fmdings in development countries. Bull. Off. Int. Epiz. 81: 825-835. CALLOW, L. L. 1977. Vaccination against bovine babesiosis. Advances in Expl. Med. and Biology 93: 121-123. CALLOW, L. L. and L. T. MELLORS. 1966. A new vaccine for Babesia argentina infections prepared in splenectomised calves. Aust. Vet. J. 42: 464-465. CALLOW, L. L. and W. Mc GREGOR. 1970. The effect of Imidocarb against Babesia argentina infections of cattle. Aust. Vet. J. 46: 195-200. DEVOS, A. J. 1978. Immunogenecity and Pathogenicity of three South African strains of Babesia bovis in Bos indicus cattle. Onderstepoort of Vet. Res.45: 119-124. JAMES, M. A. et al. 1981. Antibodies kinetics in response to vaccination against Babesia bovis. Am. J. Vet. Res. 42: 1999-2001. JAMES, M. A. et al. 1985. Seroepidemiology of bovine anaplasmosis and babesiosis in Venezuela. Trop. Anim. Hlth. Prod. 17: 9-18. KUTTLER, K. L. et al. 1982. Efficacy of nonviable culture-derived Babesia bovis vaccine. Am. J. Vet. Res. 43: 281-284. LEVY , M. G. and M. RISTIC. 1980. Babesia bovis continuous cultivation in a microaerophilus stationary phase culture. Science 207: 1218-1220. McCOSKER, J .P .1981. The global importance of Babesiosis.In: Babesiosis. Eds. M. Ristic and J.P. Kreier. Academic Press, New York. p. 1-24. MAHONEY, D. F. 1967. Bovine Babesiosis: The immunization of cattle with killed Babesia argentina. Expl. Parasitology 20: 125-129. MAHONEY, D. F. 1981. Immunization against blood derived antigens of Babesia. In: Babesiosis. Eds. M. Ristic and P J Kreier. Academic Press, New York. p. 475-483. MAHONEY, D. F. and B. V. GOODGER. 1972. Babesia argentina: Immunogenicity of plasma from infected animals. Expl. Parasitology 32: 71-85. MONTEALEGRE, F. et al. 1987. Detection of culture-derived Babesia bovis exoantigen using a two-site enzyme-immunoassay. J. Clin. Microbiology 25: 1648-1652. MONTENEGRO-JAMES, 8.1992. Prevalence and control of babesiosis in the Americas. Mem. Inst. Oswaldo Cruz. Río de Janeiro. vol. 87 (Suppl): 27-36. MONTENEGRO-JAMES, S. et al. 1987. Bovine Babesiosis: induction of protective immunity with culture-derived Babesia bovis and Babesia bigemina immunogens. Parasitology Res 74: 142-150. MONTENEGRO-JAMES, S., I. KAKOMA and M. RISTIC.1989. Culture- derived Babesia exoantigens as immunogens. In: Veterinary Protozoan and Hemoparasites Vaccines. Eds. I.G. Wright. CRC Press. Boca Ratón, Florida. p. 61-98. MONTENEGRO-JAMES, S., M. TORO, E. LEÓN and A. T. GULLIEN. 1992. Field evaluation of an exoantigen-containing Babesia vaccine in Venezuela. Mem. Inst. Oswaldo Cruz. Río de Janeiro, 87 (III): 283-288. OBREGON, J., P. RAMOS, J. APONTE and N. CONDE. 1984. Cultivo de células BHK-2 clon 13 en suspensión: construcción y operación de un fermentador experimental. Veterinaria Tropical 9: 3-15. PURNELL, R. E., D. W. BROCKLESBY and A. J. STARK.1978. Protection of cattle against Babesia major by inoculation of irradiation piroplasms. Res. Vet. Sci. 25: 388-390. PURNELL, R. E. and O. LEWIS. 1981. Babesia divergens: comparation of dead and live parasites in an irradiated vaccine. Res. Vet. Sci. 30: 18-21. PURNELL, R. E. et al. 1984. Field use of an irradiated vaccine to protec cattle against red-water (Babesia divergens infection) on a farm in Dorset. Vet. Record. 108: 28-31. ROY-SMITH, F. 1971. The prophylactic effects of Imidocarb against Babesia argentina and Babesia bigemina infections in cattle. Aust. Vet. J. 47: 418-420. SERGENT, E. et al. 1924. Une question de terminologie: lmmuniser et premunizer. Bull. Soc. Path. Exot. 17: 37-38. SMITH, R. D. et al. 1981. Bovine babesiosis: protection of cattle with culture- derived soluble Babesia bovis antigen. Science 212: 335-338. STEINBUCH, M. and P. AUDRAN. 1969. The isolation of IgG from mammalian sera sith the aid of caprilic acid. Arch. Biochem. Biol. 34: 279. TODOROVIC, R.A. et al. 1973. Chemoprophylaxis (Imidocarb) against Babesia bigemina and Babesia argentina infections. Am. J. Vet. Res. 34: 2253-2261. TORO BENITEZ, M. 1990. Seroepidemiología de las hemoparasitosis en Venezuela. In: Cuadernos USB, serie Biología N°1: Hemoparasitos, Biología y Diagnóstico. Eds. S. Giardina y F. Farcía Universidad Simón Bolívar. Caracas, Venezuela. p. 35-49. TORO, M. et al. 1980. Resultados de un muestreo serológico sobre bovinos portadores de Babesia, mediante inmunofluorescente indirecta. Vet. Tropical 5: 3-8. VEGA, C.A. and MARTINEZ et al. 1985. In vitro cultivation of Babesia bigemina. Am. J. Vet. Res. 46: 416-520. WILSON, M.B. and K. P. NAKANE. 1978. Recent developments in the periodat methods of conjugating horse radish peroxidase (HRPO) to antibodies. In: Immunfluorescence and Related Staining Tcchniques. Eds. Knap, W ., H. Halabar and G. Wicks. Elsevier North Holand Biomedical Press, Amsterdam. p. 215. |
||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||