|
Veterinaria Tropical 21(2): 201-214. 1996 CLASIFICACIÓN MORFOLÓGICA DE LA ANEMIA DESARROLLADA EN BOVINOS INFECTADOS EXPERIMENTALMENTE CON Trypanosoma vivax Emir Espinoza*, Pedro Aso**, Nersa González * y Luis Rangel*** *Universidad Simón
Rodríguez, Rectorado. Recibido: mayo 02, 1996 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
RESUMEN Se realizó el estudio de la clasificación morfológica de la anemia desarrollada en tres vacas Holstein, inoculadas experimentalmente con un estabilizado de Trypanosoma vivax. Los parámetros hematológicos evaluados incluyeron el número total de eritrocitos, hematocrito y hemoglobina, los índices eritrocíticos (volumen corpuscular medio y concentración de la hemoglobina corpuscularmedia). Se estudió las alteraciones de la morfología de los eritrocitos. En general, la anemia observada fue normocítica normocrómica (P < 0,01) y eventualmente los eritrocitos mostraron anisocitosis, poiquilocitosis, policromasia, cuerpos de Howell-Jolly, rubrocitosis y punteados basófilos. Palabras Claves: Trypanosoma vivax; clasificación; anemia; bovinos. INTRODUCCIÓN La anemia puede presentarse como consecuencia de infecciones con tripanosomas, en los animales domésticos en general y en los bovinos en particular (DE DIEGO et al., 1986; IGROKWE y ANOSA, 1989; ILRAD, 1990; NAYLOR, 1971). Los cambios hematológicos del hospedador en infecciones con Trypanosoma vivax están determinados, por varios factores, tales como la virulencia del parásito, susceptibilidad del hospedador, período de infección, momento de tomar las muestras, edad, estado nutricional y raza (ANOSA et al., 1992; ANOSA, 1988; ESPINOZA, 1988; SAROR, 1979). La identificación y la comprensión de los mecanismos que limitan la severidad de esta anemia pueden proveer elementos claves para la selección genética en programas convencionales de cruzamiento y permitir la selección, por medios terapéuticos, inmunológicos o genética molecular, de animales más resistentes a los efectos de la infección y por ello más productivos (MORRAY y DEXTEX, 1988; TRAIL et al., 1991). Durante la enfermedad, la anemia usualmente se presenta con la primera ola de parasitemia, aunque suele no observarse en la fase temprana de la tripanosomiasis africana humana (ANOSA, 1988). El subsecuente desarrollo de la anemia está determinado por la frecuencia e intensidad de la parasitemia. Cada oleada de parásitos está acompañada por una disminución en el número de eritrocitos con intentos de lograr una recuperación parcial de los valores hematológicos después de cada recrudecencia (EMERIBE y ANOSA, 1991; FIENNES, 1954; IGBOKWE, 1989). Diferentes anormalidades en la morfología de los eritrocitos de animales infectados con distintas especies de tripanosoma se han señalado: anisocitosis, poiquilocitosis, punteado basófilo, macrocitosis y esquitocitos (ANOSA y KANEKO, 1983; ANOSA e ISOUN, 1980; JENKIS et al., 1980). No obstante, sólo se ha señalado anisocitosis en infecciones con T. vivax en cabras, ovejas y bovinos, debido a la presencia de microcitos y macrocitos (ANOSA, 1983; ANOSA e ISOUN, 1980). En este trabajo, se informa sobre la morfología de la anemia desarrollada durante una infección experimental con un aislado venezolano de T. vivax en animales de la raza Holstein. MATERIALES Y MÉTODOS Se utilizaron 5 bovinos hembras de la raza Holstein, entre 2 y 3 años de edad, negativos serológica y parasitológicamente a T. vivax. Adicionalmente se descartó la presencia de Babesia sp y Anaplasma marginale, por los mismos métodos. Los bovinos se dividieron en dos grupos: uno experimental de 3 individuos inoculados con el aislado de T. vivax, y el otro de 2 animales que sirvieron como controles, ubicándose en ambientes separados. La alimentación consistió en heno, alimento concentrado y agua ad libitum, su suplementación de minerales. El grupo experimental se inoculó con un estabilizado de T. vivax (Guárico-IIV), administrado intravenosamente (IV) a una dosis total 2,2 x 106. El aislado, se había mantenido en forma criopreservada en nitrógeno líquido y con pasajes en bovinos, caprinos y ovinos susceptibles (ESPINOZA, 1988; SANDOVAL et al. 1995). Las muestras de sangre fueron colectadas en tubos con EDTA. Para la determinación de la parasitemia se utilizaron dos métodos parasitológicos directos: frotis delgado teñido con Wright y la técnica de la microcentrifugación (WOO, 1969); estos, a su vez, permitieron la estimación de la morfología de los globulos rojos y del hematocrito (Ht). El recuento de eritrocitos se realizó mediante el contaje electrónico en el sistema Unimeter 300. La hemoglobina se cuantificó espectrofotométricamente por el método de la cianometahemoglobina a 540 nm (COLES, 1986; JAIN, 1979). Los índices eritrocíticos y la morfología de los glóbulos rojos fueron determinados según los procedimientos descritos por COLES (1986). Los resultados obtenidos en el ensayo fueron agrupados y comparados usando una prueba de "t" de Student's y un ANOVA de una vía. Se utilizó un nivel de significación máximo de 5%. RESULTADOS La temperatura rectal en las hembras inoculadas fluctuó, durante la etapa experimental, entre períodos hipertérmicos y otros apiréticos. Algunas reces su elevación correspondió con la detección del hemoparásito en sangre circulante; no obstante, hubo días donde la temperatura osciló dentro de los parámetros normales a pesar de la presencia de tripanosomas (T. vivax). Los bovinos del grupo experimental mostraron un período de incubación le 5 días y el primer pico de parasitemia se detectó en el séptimo día post-inoculación (PI), (Cuadro 1). A medida que la enfermedad progresó, e hizo más difícil detectar tripanosomas en el torrente sanguíneo y las ondas fases de parasitemia presentaron una duración corta.
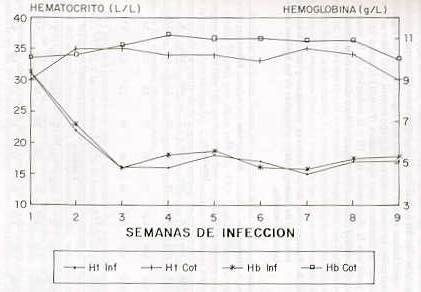
Instaurada la patencia y al manifestarse el primer estado pirético comenzaron a desarrollarse las diferentes fases de la enfermedad. En el día 10 PI, los animales infectados presentaron anorexia ya partir de la tercera semana (16 día PI) recuperaron el apetito, pero mostraron un des- mejoramiento de su estado corporal y un enflaquecimiento progresivo. El consumo de agua no mostró variaciones durante todo el lapso de la infección. A la palpación externa de los ganglios, ellos mostraron una inflamación intensa, principalmente los preescapulares. Al examinar las mucosas, se evidenció una marcada palidez, la cual fue proporcional al desarrollo de la pancitopenia. Las alteraciones del hematocrito se manifestaron de manera progresiva desde los primeros días post-inoculación, manteniéndose disminuidas hasta el final del ensayo (ver Figura); con una reducción entre un 51 y 66 %, la cual fue estadísticamente muy significativa (P < 0,01 ): se obtuvieron cifras individuales hasta con un valor de 0,11 1/1 (Cuadro 2), nivel de pronóstico crítico para la vida del animal. La hemoglobina tuvo un comportamiento similar, registrándose valores individuales muy bajos (38 g/l) (ver Figura). Esta disminución, en comparación con el grupo control, varió entre un 56 y 65 %, siendo la diferencia muy significativa (P<0,01) (Cuadro 2). Este patrón, junto con la disminución del Ht y la reducción de la masa de eritrocitos (P < 0,001) ( Cuadro 2) configuró el signo clínico de la anemia.
El examen de los frotis sanguíneos reveló varias anormalidades en los animales experimentales. Estas incluyeron policromasia, anisocitosis, poiquilocitosis, presencia de cuerpos de Howell Jolly, rubrocitosis y punteados basófilos. La anisocitosis se presentó a partir del día en que la parasitemia se hizo patente, con excepción de un animal que manifestó una ligera anisocitosis para el día de la inoculación. La conformación irregular de los eritrocitos en la extensión sanguínea (poiquilocitosis) no fue tan clara en las tres primeras semanas de infección, presentándose como una constante en un solo bovino. Residuos nucleares fueron vistos a partir de la segunda semana PI, sin embargo, no fue consistente en todo los animales infectados. La presencia de células jóvenes con algún resto de ARN (policromasia) se evidenció tempranamente (día 14), no observándose después de la tercera semana de la infección (fase subaguda). Células eritrocíticas inmaduras (rubrocitos) fueron vistas a partir de la segunda semana. Dos animales mostraron la presencia de cuerpos de Howell Jolly entre los días 11 y 13 (2da. semana) de la infección. U n estado de eritrogenesis (punteado basófilo) se evidenció en uno de los animales experimentales. El Cuadro 3 presenta los valores promedios del volumen corpuscular medio (V CM), y la concentración de la hemoglobina corpuscular media (CHCM) de los bovinos infectados experimentalmente con T. vivax. Para el inicio del segundo tercio de la hemoparasitosis ( 4ta. semana) aumentó ligeramente el promedio del V CM, reflejando su máximo valor en la quinta semana, sin embargo, la comparación de ese promedio, con la media del grupo control para la misma semana, no indicó diferencia significativa. Igualmente, la contrastación de las medias totales del grupo experimental contra la media del control no evidenció diferencia estadística (Cuadro 3). Con respecto a la CHCM, los valores promedios semanales y totales de ambos grupos oscilaron dentro de los parámetros considerados como normales para la especie, sin poderse demostrar diferencia estadística significativa (Cuadro 3).
DISCUSIÓN La anemia inducida por el aislado de T. vivax (Guárico-IIV) en los bovinos Holstein fue normocítica normocrómica (P < 0,01) y etiológicamente, una anemia por destrucción excesiva de eritrocitos (COLES, 1986; JAIN, 1979; JENKIS et al., 1980), la cual estuvo asociada con la presencia de la parasitemia. Estos datos no concuerdan, en parte, con los hallazgos de NAYLOR, (1971); MAXIE et al. (1979); ANOSA e ISOUN (1980); IGBOKWE y ANOSA (1989), IGBOKWE (1989) y KATUNGUKA et al (1992) quienes demostraron la presencia de una anemia macrocítica normocrómica en las tres primeras semanas de la enfermedad, producida en diferentes rumiantes por T. vivax y T. congolense. No obstante lo anterior, MAXIE et al.(1979) refieren que la macrocilosis son menos severas en las infecciones con T. vivax. SAROR (1979) y GARDINER (1989) en bovinos y SANDOVAL (1994) en ovejas, informaron que la anemia producida por T. vivax al inicio de la enfermedad es del tipo normocítica normocrómica, con una tendencia a ser macrocítica normocrómica posteriormente, mientras que SANDOVAL (1994) señala que en la tripanosomiasis crónica la anemia puede derivar hacia microcítica hipocrómica. Contrariamente, IGBOKWE y ANOSA (1989) encontraron que la anemia inducida por el T. vivax en ovinos fue macrocítica normocrómica, sin estar acompañada por una respuesta de reticulocitos. JAIN (1986) indica que cuando ocurre una destrucción hemolítica de los eritrocitos, la anemia que se presenta es del tipo normocítica normocrómica. Las anemias normocíticas tienen un VCM y CHCM normal, y son diagnosticadas sólo por la disminución en el número de eritrocitos, bajo hematocrito, y una reducción en el total de la hemoglobina. Tales anemias ocurren cuando hay depresión de la eritrogénesis (COLES, 1986; JAINS, 1986; SAROR, 1979) y donde la respuesta de los reticulocitos está ausente o es insignificante (IGBOKWE y ANOSA, 1989; IGBOKWE, 1989; JAIN, 1986). Como causa se citan deficiencia en la elaboración de eritropoyetina, descripción de la médula ósea o defecto en la utilización del hierro (ANOSA, 1988; IGBOKWE, 1989; JAIN, 1986), asociadas con enfermedades renales, inflamaciones crónicas y enfermedades del hígado. Histopatológicamente, ESPINOZA (1988) y SANDOVAL (1994) encontraron que el aislado de T. vivax utilizado en este ensayo produce alteraciones microscópicas graves en riñón e hígado; quizás lo anterior explique el desarrollo de la anemia normocítica normocrómica observada en los bovinos usados en esta experimentación. Los datos hematológicos explorados en el presente ensayo indicaron aparentemente una macrocitosis transitoria (Cuadro 3) para la quinta emana de infección. El valor promedio del VCM exhibió una cifra de 65 fl y el nivel de CHCM permaneció dentro de los límites considerados como normales, tal vez como una respuesta regenerativa a la anemia (COLES, 1986). Sin embargo, los parámetros hematológicos (NTE, Ht, Hb) permanecieron bajos en las restantes semanas de la etapa experimental (Figura 1, Cuadro 3), posiblemente por causa de la continua destrucción de lo: eritrocitos maduros e inmaduros en la médula ósea (KATONGUKA et al. 1992). El estudio de la morfología (tamaño, forma y color) de los eritrocitos (COLES, 1986; JAIN, 1986; JAIN, 1979) permitió observar las anomalías causadas por el T. vivax las cuales consistieron en anisocitosis, poiquilocitosis y policromasia. COLES (1986) y JAIN (1986; 1979) expresan que la variación en tamaño (anisocitosis) de los glóbulos rojos ocurre normalmente en los frotis sanguíneos de los bovinos. Esto pudiera explicar la presencia de una anisocitosis moderada en un bovino para el día de la inoculación del T. vivax. El resto de los animales presentó en el transcurso de la infección una anisocitosis de grado leve. Con respecto a las alteraciones de la forma de los eritrocitos (poiquilocitos), éstas fueron más aparente en las dos primeras semanas de la hemoparasitosis, momento que correspondió con la crisis hemolítica (Figura 1). Lo anterior permitió inferir alteraciones en la eritrogénesis (COLES, 1986) y concomitantemente poderla asociar con el desarrollo de la anemia hemolítica (ANOSA y KANEKO, 1983; ESPINOZA, 1988; JENKIS et al., 1980) y con los hallazgos histopatológicos en el riñón e hígado, glomerulonefritis y coagulación intravascular diseminada, respectivamente (datos no publicados). En la segunda semana de la infección se observó policromasia en dos animales lo cual fue indicativo de posible presencia de eritropoyesis compensatoria (extramedular). ESPINOZA (1989), mediante estudios microscópicos en órganos de bovinos infectados con T. vivax, demostró la presencia de metaplasia mieloide. JAIN (1979) y COLES (1986) señalaron que estas anomalías son una consecuencia de eritropoyesis anormal y de anemias ferropénicas, características de las anemias hemolíticas microangiopáticas. Sobre el último aspecto, MORRA y y DEXTER (1988) y WELLDE et al. (1989) plantearon que la coagulación intravascular diseminada (CID) en rumiantes afectados portripanosomiasis bovina (T. vivax) puede llevar a una forma de anemia hemolítica la cual degenera en una anemia hemolítica microangiopática. En el estudio histopatológico se observó la presencia de microtrombos (CID) en hígado y pulmón que pudieron ser la causa de la muerte de dos bovinos después de haber finalizado el experimento (datos no publicados). Los punteados basófilos siempre ocurren en las anemias de bovinos ovinos, en este caso sólo un animal lo presentó, coincidiendo con el aumento individual del y CM. Los cuerpos de Howell Jolly fueron observados de la misma manera que el punteado basófilo, concordando con el inicio de la macrocitosis regenerativa. Estos cuerpos son remanentes de materia nuclear y se pueden confundir con cuerpos de Anaplasma marginale, su embargo, ellos no están confinados a la periferia. La presencia de estos cuerpos puede indicar una reducción de la función esplénica (COLES, 1986; JAIN, 1986). JENKINS et al. (1980) estudiando las anormalidades de los glóbulos rojos en conejos infectados Con T: brucei, observaron ocasionalmente cuerpos de Howell Jolly, pero con la diferencia de que dichas. anormalidades se hicieron patentes cuando la infección progresó. La conclusión de este estudio evidenció la presencia de una anemia normocítica normocrómica en bovinos de la raza Holstein infectados con un aislado de T. vivax. Estos datos coincidieron con los datos de SAROR (1979) y GARDINER (1989) en referencia a la morfología de la anemia producida por variantes de T: vivax africanas, y a la información de SANDOVAL (1994) quien trabajó Con el mismo aislado de T: vivax. SUMMARY In the present work the morphologic study of a realized in three Holstein cows inoculated experimentally with a Trypanosoma vivax stabilated. Rematological parameter evaluated included, the red cell count, packed cell volume, hemoglobin; red cell indices as corpuscular volume and corpuscular hemoglobin concentration. Changes in the red cell morfology were studied. La anemia was normocyte normocromic (P<0,01). The erythrocytes showed anisocytosis, poikilocytosis, policromasy, Howell-Jolly bodies, rubrocytosis and basophilic stippling. Key Words: Trypanosoma vivax; classification; anemia; bovine. BIBLIOGRAFÍA ANOSA, Y., L. LOGAN and M. SRA W. 1992. A light and electron microscopic study of changes in blood and bone marrow in acute hemorrhagic Trypanosoma vivax infection in calves. Veterinary Pathology 29:33-45. ANOSA, V. 1988. Haematological and biochcmical in human and animal trypanosomiasis. Part I. Revue D'elevage et de Medicine Veterinaire des pays Tropicaux 4(1):65- 78. ANOSA, V. and J. KANEKO. 1983. Pathogenesis of Trypanosoma brucei infection in deer mice (Peromyscus malliculalus): Hematologic, erythrocyte biochemical, and iron metabolic aspects. Amcrican Journal of Veterinary Research of the American Veterinary Medical Association 44(4):639-644. ANOSA, V. and T.ISOUN.1980. Haematological studies on Trypanosoma vivax infections of goats and intact and splenectomized sheep. Journal of Comparative Pathology 90: 155-168. COLES, L. 1986. Veterinary clinical pathology. 4. Ed. Philadelphia. Saunders. p. 68-91. DE DIEGO, J., C. ESCRIBANO, J. REY, R. MAYER y M. DE DIEGO. 1986. El cuadro hemático en la infección experimental con Trypanosoma brucei. Revista Iberoamericana Parasitológica 46(1):13-20. EMERIBE, A. and V. ANOSA. 1991. Haematology of experimental Trypanosoma brucei gambiense infection. II. Erythrocyte and leucocyte changes. Revue D'Elevage et de Medicine Veterinaire des Pays Tropicaux 44(1):53-56. ESPINOZA, E. 1988. Evaluación clínica, Parasitológica y serológica de bovinos infectados experimentalmente con Trypanosoma vivax. Tesis MSc. Universidad Central de Venezuela. 224 p. FIENNES, R. 1954. Haematological studies in trypanosomiasis of cattle. Veterinary Record 66(30):423-434. GARDINER, R. 1989. Recent studies of the biology of Trypanosoma vivax. Advance Parasitology 28:229-317. IGBOKWE, I. and V. ANOSA. 1989. Response to anaemia in experimental Trypanosoma vivax infection of sheep. Journal of Comparative Pathology 100:111-118. IGBOKWE, I. 1989. Dyserythropoyesis in animal trypanosomiasis. Revue D' Elevage et de Medicine Veterinaire Pays de Tropicaux 42(3):423-429. ILRAD. 1990. Why do livestock infected with trypanosomas develops anaemia. Reports lnternational Laboratory for Research on Animal Diseases. 6 p. ILRAD. 1984. Anaemia in trypanosomiasis: Haemorrhagic T: vivax may provide a clue. 2(4):1-3. JAIN, N. Veterinary Hematology. Schalms. 4 ed. Philadelphia. Lea and Febiger. p. 177-207. JAIN, N. 1979. Hematologic characteristic of anemia. II. Interpretative aspects. California Veterinarian 33(10):15-18. JENKINS, O. , P. McCRORIE, C. FARSBER and J. BROWN.1980. Studies on the anemia in rabbits infected with Trypanosoma brucei. Evidence for haemolisis. Journal of Comparative Pathology and Therapeutes 90: 107-121. KATUNGUKA, E., M. MURRA Y and P. HOLMES.1992. The pathology of ovine trypanosomosis: Haematalagical and blaad biachemical changes. Veterinary Parasitalagy 45:17-32. MAXIE, M., G. LOSOS and H. TABEL. 1979. Experimental bovine trypanosomiasis (Trypanosoma vivax and T. congolense). I. Symptomatology and clinical pathology. Tropenmedizin und Parasitologie 30:274-283. MURRAY, M. and T. DEXTER. 1988. Anaemia in bovine African trypanosomiasis. A review. Acta Tropica 45:389-432. NAYLOR, O. 1971a. The haematology and histopathology of Trypanosoma congolense infection in cattle. II. Haematology. Tropical Animal Health and Production 3:159-168. NAYLOR, O. 1971b. The haematology and histopathology of Trypanosoma congolense infection in cattle. 3. Discusión and conclusions. Tropical Animal Health and Production 3:203-207. OGUNSANMI, A., S. AKPAVIE and V. ANOSA. 1994. Serum biochemical changes in West African Dwarf sheep experimentaly infected with Trypanosoma brucei. Revue D'Elevage et de Medicine Veterinaire des Pays Tropicaux 4(1):65- 78. SANDOVAL, E. 1994. Variaciones fisiopatológicas de la anemia en ovejas infectadas experimentalmente con Trypanosoma vivax. Tesis MSc. Universidad Central de Venezuela. Facultad de Ciencias Veterinarias. 131 p. SANDOVAL, E., E. ESPINOZA y A. VALLE. 1995. Parasitemia y comportamiento clínico en ovejas infectadas experimentalmente con Trypanosoma vivax. Veterinaria Tropical 20:67-84. SAROR, O. 1980. Observations on the course and pathology of Trypanosoma vivax in Red Sokoto goats. Research Veterinary Science 28:36-38. SAROR, O. 1979. Classification ofthe anaemia of bovine trypanosomiasis. Veterinary Record 105:96-98. SEKONI, V ., O. SAROR, C. NJOKU, J. KUMI-DIACA and G. OPALUWA. 1990. Comparative haematological changes following Trypanosoma vivax and T: congolense infection in zebu bulls. Veterinary Parasitology 35(1-2):9-11. TRAIL, J., G. D'IETERAN, A. FERON, O. KAKIESE, M. MULUNGO and M. PELO. 1991. Effect of trypanosome infection development on productivity of N'Dama cattle. Acta Tropica 48:37-45. WELLOE, B., J. PRESTON, J. KOVATCH,J. HIGGS and D. CHYRNON. 1990. Of Trypanosoma congolense: Erythrocyte indices plasma iron turnover and effects of treatment in infected cattle. Annals of Tropical Medicine and Parasitology 83(1):201-206. WOO, P .1969. The haematocrit centrifuge for the detection of trypanosome in blood. Canadian Journal of Zoology 47:921-923. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||