|
Veterinaria Trop. 26(1): 35-46. 2001 PRIMER AISLAMIENTO E IDENTIFICACIÓN DEL AGENTE CAUSAL DE BORDETELOSIS AVIAR Y REPRODUCCIÓN DE LA ENFERMEDAD EN VENEZUELA Carmen de
Noguera*, Dilia Infante*, Antonio J. León*, José G. Fernández***, * Investigadores y
**Técnicos Asociados a la Investigación. lNIA. Recibido: agosto 30, 2001. |
||||||||||||||||||||||||||||||||
|
RESUMEN Se presentó una enfermedad de las vías respiratorias superiores en pavos de 5 semanas de edad. Los signos clínicos incluyeron estornudos, descarga nasal, disnea, respiración por la boca, y exudado espumoso en los ojos; la morbilidad fue de 100% sin mortalidad. A la necropsia presentaron tráqueas colapsadas con exudado mucoso. Se tomaron hisopados traqueales que fueron sembrados en tripticasa soya sangre agar y MacConKey agar al 2,5%, infusión cerebro corazón, caldo infusión de ternera y caldo triptosa. Se inocularon pavitos de un día vías intranasal y ocular, con una dosis de 106 unidades formadoras de colonia de la cepa P:6502. De los hisopados traquéales del brote natural se aisló un bacilo gram negativo, móvil, aerobio estricto no fermentador. En MacConKey produjo colonias lisas con un centro marrón a las 48 horas y filamentos en medios líquidos, catalasa y oxidasa positivos, ureasa y reducción de nitratos negativos. El estudio de las característica macroscópicas y microscópicas de las colonias y las pruebas bioquímicas identificaron este aislamiento como Bordetella avium. Los pavos infectados experimentalmente mostraron síntomas respiratorios a partir del segundo día post inoculación. Los inoculados vía nasal presentaron morbilidad de 80% y mortalidad de 60%. B. avium fue recuperada de los pavos enfermos y muertos. Los hallazgos de este reporte coinciden con las características de B. avium y con los brotes clínicos de bordetelosis de los pavos. El aislamiento de B. avium y la reproducción de la enfermedad en ellos, permite concluir que la enfermedad respiratoria corresponde a un brote de bordetelosis. Palabras Clave: Bordetelosis; Bordetella avium; infección experimental. INTRODUCCIÓN La infección por Bordetella en aves fue descrita por primera vez en Canadá por Filión et al., 1967. Posteriormente, a mediados de la década de los 70, se presentó en los Estados Unidos y Alemania un síndrome similar conocido como coriza de pavos, rinotraqueítis y bordetelosis. Bordetella avium originalmente fue clasificada como Bordetella bronchiseptica-like o Alcalígenes faecalis , sin embargo, estudios posteriores realizados por Kersters et al. (1984), concluyeron que el agente causal correspondía a una nueva especie del género Bordetella a la cual se denominó B. avium. Aunque su huésped natural son los pavos, también se ha presentado en pollos y otras especies aviares (Kersters et al., 1984; Kelly et al.,1985; Blackall y Farrah, 1985; Blackall y Doheny, 1987; Jackwood et al., 1995). La bordetelosis de los pavos es una enfermedad de las vías respiratorias superiores, altamente contagiosa, sobre todo en explotaciones comerciales, y de una importancia económica significativa, ya que las aves afectadas quedan predispuestas a infecciones secundarias. El curso clínico de la enfermedad varía de moderada a severa dependiendo de la presencia de otros microorganismos y condiciones ambientales (Saif et al., 1980; Arp y Skeeles, 1991; Wilding, 1996). La infección natural afecta a pavos entre 2 y 6 semanas de edad, con una morbilidad que puede variar de 80 a 100%, mientras que la mortalidad es de 10% (Arp y Skeeles, 1991; Wilding, 1996; Skeeles y Jackwood 1998). En pavos jóvenes la enfermedad se caracteriza por la aparición repentina de estornudos, acompañados de abundante descarga nasal, tos seca, respiración por la boca, disnea, exudado espumoso alrededor de los ojos y disminución del consumo de agua y alimento con pobre ganancia de peso (Kelly et al., 1986; Wilding, 1996; Skeeles y Arp, 1997; Skeeles y Jackwood, 1998). B. avium es un bacilo gram negativo, móvil, aerobio estricto, no fermentador, oxidasa y catalasa positivos, urea negativa. En medios sólidos forma colonias puntiformes (0,2-1 mm) a las 24 horas de incubación y en el medio selectivo MacConKey agar muchas cepas producen colonias con un centro marrón (Kersters et al., 1984; Skeeles y Arp 1987; Skeeles y Jackwood 1998) . En medios líquidos, se ha descrito la formación de filamentos de varias longitudes (Domingo et al., 1992). Numerosos ensayos se han realizado con el objeto de infectar experimentalmente pavos de diferentes edades, logrando en la mayoría de los casos reproducir el cuadro clínico respiratorio. compatible con bordetelosis entre 4 y 6 días post-exposición, así como la recuperación de B. avium de las aves inoculadas (Saif et al., 1980; Gray et al., 1983; Montgomery et al., 1983; Arp et al., 1984; Sacco et al., 2000). Algunos autores además relacionan la patogenicidad de B. avium con las características morfológicas de las colonias (Jackwood et al., 1985; Jackwood et al.,1995) y con la capacidad de producir formas filamentosas en cultivos líquidos (Domingo et al., 1992; Jackwood et al., 1995). El propósito de este trabajo es reseñar el aislamiento de B. avium, de un brote de Bordetelosis en pavos, así como la reproducción experimental de la enfermedad. MATERIALES Y MÉTODOS Muestras. En el laboratorio se recibieron 5 pavos de 5 semanas de edad procedentes de una explotación comercial ubicada en la región capital del país. Los signos clínicos observados en las aves fueron tristeza, alas caídas, plumas erizadas, descarga nasal, estornudos, disnea, respiración con la boca abierta y exudado espumoso en los ojos (Figura 1), con una morbilidad del 100% y sin mortalidad.
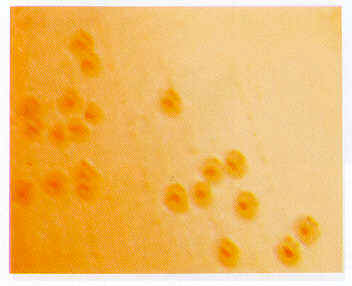
El total de las aves fueron necropsiadas y se tomaron muestras de hisopados traqueales, tráqueas y pulmón. Las muestras de pulmón y tráquea fueron procesadas para el aislamiento de los virus de Newcastle (NC) y bronquitis infecciosa aviar (BIA) siguiendo las técnicas descritas por Alexánder ( 1998) y Gelb y Jackwood ( 1998) y los hisopados traqueales para el aislamiento de B. avium. Aislamiento e identificación de B. avium. Muestras de hisopados de mucosa traqueal de todos los pavos recibidos se sembraron en los medios de tripticasa soya sangre agar (TSSA) y MacConKey (MCA) con un incremento de 2,5% de agar, infusión cerebro corazón (ICC), caldo infusión de ternera (CIT) y caldo triptosa (CT), siguiendo las técnicas descritas por Skeeles y Jackwood (1998). Para la identificación bioquímica se utilizaron las pruebas de catalasa, oxidasa, indol, rojo de metilo, Voges-Proskauer, producción de H2S, reducción de nitratos a nitritos, ureasa y malonato siguiendo los procedimientos recomendados por Kersters et al. (1984). Para la prueba de fermentación de carbohidratos se utilizaron glucosa, lactosa, sacarosa, manitol, maltosa, arabinosa, sorbitol, dulcitol, ramnosa y rafinosa a una concentración del l % en agua peptonada. Reproducción de la enfermedad. Con la finalidad de reproducir el cuadro respiratorio observado en las aves procedentes de la granja, se utilizaron 15 pavos de un día de edad, obtenidos de una incubadora comercial, los cuales se dividieron en 3 grupos de 5 cada uno identificados como A, B y C. El grupo A se inoculó por vía intraocular (IO) con una dosis de 106 de la cepa P:6502. El grupo B se inoculó por vía intranasal (IN), con el mismo cultivo y la misma concentración y el grupo C (no inoculado) correspondió a los controles. Las aves fueron observadas durante 10 días, llevando registros diarios de los signos clínicos y mortalidad. Todas las aves fueron necropsiadas y se tomaron muestras de tráqueas, las cuales se sembraron en medios de cultivo, para la recuperación del agente bacteriano inoculado siguiendo la misma técnica utilizada en las aves procedentes de la granja. RESULTADOS Y DISCUSIÓN A la necropsia, tres de los pavos de 5 semana presentaron tráqueas colapsadas con exudado mucoso claro; pericardio ligeramente engrosado en dos aves, sacos aéreos abdominales ligeramente turbios y uno con cáseos. Las muestras de pulmón y tráquea de los mismos resultaron negativas al aislamiento de los virus de NC y BIA. De los hisopados traquéales de los pavos procedentes de la granja y con signos respiratorios, se aisló un bacilo pequeño, gram negativo, aerobio estricto, móvil, oxidasa y catalasa positivas que en TSSA produjo colonias puntiformes no hemolíticas y en MCA se observaron colonias pequeñas de aspecto liso, traslúcidas, perladas, de bordes regulares a las 24 horas de incubación, que a las 48 h desarrollaron un centro marrón (Figura 2). Las características morfológicas de las colonias obtenidas en este traba.jo coinciden con las colonias tipo I de B. avium descritas previamente por Kersters et al., 1984; Jackwood et al., 1985, Arp y Skeeles 1991. La cepa aislada fue identificada P = 6502.
En los medios de cultivo ICC, CIT y CT se observó crecimiento filamentoso y la formación de una película en la superficie (Figuras 3 y 4). Domingo et al. ( 1992) señala el desarrollo de filamentos de diferentes longitudes en cultivos líquidos de B. avium.
En el Cuadro se indican las propiedades bioquímicas de la cepa aislada a partir de los hisopados traqueales de pavos de 5 semanas, las cuales coinciden con las descritas previamente por otros autores, para aislamientos de B. avium (Kersters et al., 1984; Jackwood et al., 1985). En los pavos inoculados por vía IO, la morbilidad alcanzó e1 60% pero sin ninguna mortalidad. Los primeros síntomas observados a los 2 días post-inoculación (PI) fueron tristeza y estornudo. A partir del tercer día presentaron ruidos respiratorios y disnea. La secreción nasal se manifestó a los 5 d PI y se mantuvo hasta el final del período de observación (10 d); estos resultados son similares a los descritos por Gray et al. (1983); Saif et al. (1980), quienes informan sobre la presencia de secreción mucosa entre 4 y 6 d PI en pavos inoculados vía IN de 1 y 3 d de edad, respectivamente.
Los pavos inoculados IN presentaron una morbilidad de 80% con 60% de mortalidad, la cual ocurrió los días 3 y 4 PI. La elevada morbilidad coincide con los informes de Kersters et al. (1984) y Saif et al. (1980), quienes obtuvieron 100% de morbilidad en pavos inoculados IN con B. avium a los 3 d de edad. Estos autores no señalan mortalidad, mientras que Gray et al. (1983) observaron 20% de mortalidad en pavos inoculados IN al primer día de edad y Sacco et al. (2000) quienes probaron la resistencia de varias líneas genéticas de pavos a la infección con B. avium, obteniendo entre 10 y 30% de mortalidad cuando inocularon por vía IN pavos de un día. La penetración de la bacteria por vía IN alcanza más rápido la mucosa oronasal con la posterior adherencia a las células ciliadas y la colonización en la porción superior de la tráquea. La diseminación de la bacteria a lo largo de la mucosa respiratoria estimula la inflamación, presentándose los signos respiratorios y la obstrucción nasal, lo cual puede ocasionar la muerte en las aves. Presumiblemente ese proceso pudiera explicar la no mortalidad registrada en las aves inoculados por vía 10 a pesar de los signos clínicos y la recuperación de la bacteria. Jackwood et al. (1985 y 1995) relacionan la patogenicidad de B. avium con las características de las colonias y la formación de filamentos, señalando que las cepas lisas son patógenas para pavos y Domingo et al. (1992), demuestran la patogenicidad de las formas filamentosas. En el presente estudio la cepa inoculada corresponde a la forma lisa y filamentosa, resultando patógena para pavos de un día, lo cual coincide con los autores antes mencionados. Ninguna de las aves controles presentó manifestaciones clínicas durante el período de observación. De todos los pavos inoculados, tanto por vía IN como IO, se aisló en estado puro un bacilo gram negativo, cuyas características morfológicas y bioquímicas coincidieron en su totalidad con el aislamiento original, el cual fue identificado como B. avium, mientras que de los hisopados traqueales de los pavos controles no hubo aislamiento bacteriano. Los hallazgos de este trabajo permiten concluir que la cepa aislada P = 6502 de los pavos procedentes de la granja y con síntomas de enfermedad en el tracto respiratorio superior correspondió a B. avium. Esta cepa fue capaz de infectar experimentalmente pavos de un día de edad, los cuales presentaron manifestaciones clínicas respiratorias y mortalidad compatibles con bordetelosis de los pavos, cumpliendo así con uno de los postulados de Koch. Las manifestaciones clínicas de la enfermedad pueden ser confundidas con otros agentes que causan afecciones de las vías respiratorias superiores, motivo por el cual es indispensable el aislamiento e identificación del agente causal. Este aislamiento es el primer reporte oficial de la enfermedad en el país por lo que se recomienda aplicar medidas higiénico-sanitarias y de prevención y control a fin de disminuir la transmisión de la enfermedad entre granjas, así como la realización de investigaciones sobre la presencia de la enfermedad en otras explotaciones de pavos, así como de otros factores que puedan contribuir a la perpetuación de la enfermedad. La sobrevivencia de la bacteria en el ambiente de los galpones ayuda a que ocurran ciclos de reinfección (Pardue y Luginbuhl, 1998). La cama y el agua contaminada juegan un papel importante en la transmisión de la bacteria. AGRADECIMIENTOS A la Dra. Yuraima Pineda, por su asistencia técnica y a Laboratorios Shering Plough Animal Health, por el suministro de medios de cultivo, reactivos y trabajo fotográfico. SUMMARY An upper respiratory disease was observed in a 5 weeks-old turkeys flock. Clinical signs included sneezing, nasal discharge, dyspnea, open-mouth breathing and foamy exudates from the eyes. The morbidity was 100% without mortality. Gross lesions were collapsed trachea with mucous exudates. Swabs of tracheal samples were cultivated on Tripticase Soy blood agar and MacConkey agar 2.5% brain heart infusión, veal infusion broth and triptose broth. Day-old poults were inoculated intranasal and intraocular with 106 colony forming units of Bordetella avium strain P:6502. From the tracheales swabs of the natural outbreak, a gram negative, motile, strict aerobic nonfermenting bacillus was isolated. On MacConkey agar, after 48 hours, grow of smooth colonies with brown centers were observed as well as filamentous forms in broth medium, catalase and oxidase positive, urease and nitrate reducción negative. According to the characteristics of the colonies and the biochemical tests, this isolation is identified as B. avium. Infected poults, showed respiratory signs two days after the challenge. The intranasal inoculated poults showed 80% of morbidity and 60% mortality. Bordetella avium was recuperated from the sicks and dead poults. The results of this report coincide with B. avium characteristic and with the clinical outbreak of bordetellosis in turkeys. The isolation of B. avium and the reproduction of the disease allow us to conclude that the respiratory disease corresponded with a bordetellosis outbreak. Key Words: Bordetellosis; Bordetella avium; experimental infection. BIBLIOGRAFÍA ALEXANDER, D. J. 1998. Newcastle diseases virus and other Paramyxovirus. In: Swayne, D. E.; J. R. Glisson, M. W Jackwood; J. E. Pearson and w. M. Reed, eds. Isolation and identification of avian pathogens 4th ed. American Association of Avian Pathologists. p. 156-163. ARP, L. H. and J. K. SKEELES. 1991. Turkey bordetellosis (Coryza) In: B. W. Calnek, H. J. Barnes, W. M. Reid and H. W. Yoder Jr, eds. Diseases of Poultry, 9th ed. Iowa State University Press, Ames, Iowa. p. 277-288. RP, L. H. and N. F. CHEVILLE.1984. Tracheal lesions in young turkeys infected with Bordetella avium. Am J. Vet. Res. 45:2 196-2200. BLACKALL, P. J. and C. M. DOHENY. 1987. Isolatiom and characterization of Bordetella avium and related species and an evaluation of their role in respiratory disease in poultry. Aust Vet. J. 64:235-239. BLACKALL, P. J. and J. G. FARRAH.1985. Isolation of Bordetella aviun from poultry. Aust. Vet. J. 62: 370-372. DOMINGO, D. T ., M. V. JACKWOOD and T. P. BROWN. 1992. Filamentous forms of Bordetella avium: culture conditions and pathogenicity. Avian Dis. 36:707-713. FILION, P. R., S. CLOUTIER, E. R. VRANCKEN and G. BERNIER. 1967. Infection respiratoire du dindonneau causee par un microbe apparente au Bordetella bronchiseptica. Can. J. Comp. Med. Vet. Sci. 31:l29-134. GRAY,J. G., J. F. ROBERTS, R. C. DILLMAN and D. G. SIMMONS. 1983. Pathogenesis of change in the upper respiratory tracts of turkeys experimental1y infected with an Alcaligenes faecalis isolate. Infect. Immun. 42;350-355. GELB, J. and M. W. JACKWOOD. 1998. Infectious Bronchitis. Isolation and identification of avian pathogens 4th ed. Swayne, D. E.; J. R. Glisson, M. W. Jackwood; J. E. Pearson and W. M. Reed, eds. American Association of Avian Pathologists. p. 169-174. JACKWOOD, M. W., S. M. McCARTER and T. P. BROWN. 1995. Bordetella avium: an oportunistic pathogen in leghorn chickens. Avian Dis. 39:360-367. JACKWOOD, M. W., Y. M. SAIF, P. D. MOORHEAD and R. N. DEARTH. 1985. Further characterization of the agent causing coriza in turkeys. Avian Dis. 29:690- 705. KELL Y, B. J ., G. Y. GHAZIKHANIAN and B. MA YEDA. 1985. Clinical outbreak Bordetella avium infection in two turkey breder flocks. Avian Dis. 30:234-237. KERSTERS, K., K. H. HINZ HERTLE, P. SEGERS, A. LIEVENS, O. SIEGMANN and J. De LEY. 1984. Bordetella avium sp. Nov. isolated from the respiratory tracts of turkeys and other birds. Int. J. Syst. Bacteriol. 34:56-70. MONTGOMERY, R. D., S. H. KLEVEN and P. VILLEGAS.1983. Observations on the pathogenecity of Alcaligenes faecalis in chickens. Avian Dis. 27:751-761. PARDUE, S. L. and G. H. LUGINBUHL. 1998. Improvement of poult performance following Bordetella avium challenge by administration of a novel oxy-halogen formulation. Avian Dis. 42:140-145. SACCO, R. E., K. E. NESTOR and R. A. KUNKLE. 2000. Genetic variation in response of turkeys to experimental infection with Bordetella avium. Avian Dis.44:197-200. SAIF, Y. M., P. D. MOORHEAD, R. N. DEARTH and D. J. Jackwood. 1980. Observations on Alcaligenes faecalis infection in turkeys. Avian Dis. 24:665-684. SKEELES, J. K. and L. H. ARP. 1997. Bordetellosis (turkey coriza) In: Calnek B. W., Barnes H. J.; Beard C. W.; McDougald and J. M. Saif, eds. Diseases of Poultry, 10th ed. Iowa state University Prees, Ames, Iowa. p.275-287. SKEELES, J. K. and M. W. JACKWOOD. 1998. Bordetellosis. In: Swayne, D. E.; J. R. Glisson, M. W Jackwood.; J. E. Pearson and W. M. Reed, eds. Isolation and identification of avian pathogens 4th ed. American Association of Avian Pathologists. 26-28. WILDING, G. P. (1996). Bordetella avium (Turkey coriza). In: F.T.W. Jordan and M. Pattison, eds. Poultry diseases. 4th ed. London, England. W. B. Saunders Company. p. 57-59. |
||||||||||||||||||||||||||||||||