|
Veterinaria Trop. 26(2): 117-131. 2001 PRIMERA RESEÑA DE Echinobothrium brachysoma Pintner, 1889 (Diphyllidea: Echinobothriidae) EN RAYAS (Condrichthyes: Rajidae) DE LA PLATAFORMA CONTINENTAL GALLEGA Walkiria Aragort F. *; Ana Aguilar P. **; Maglene Silva ** y Manuel L. San martín D. ** Trabajo financiado por el
Instituto Nacional de Investigaciones Agrícolas (INIA). Recibido: mayo 05, 2002. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
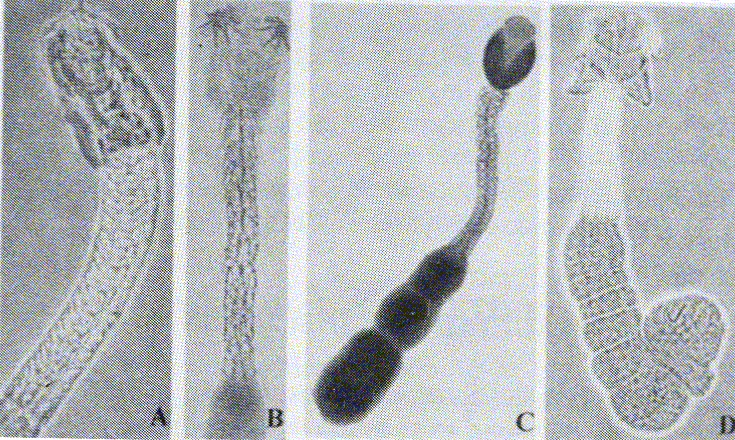
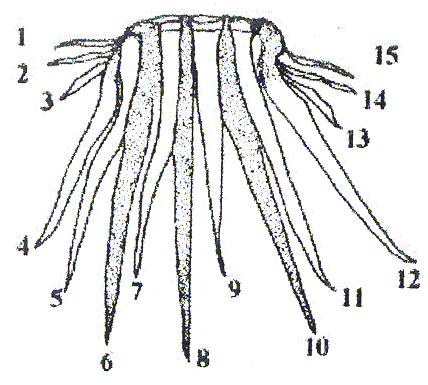
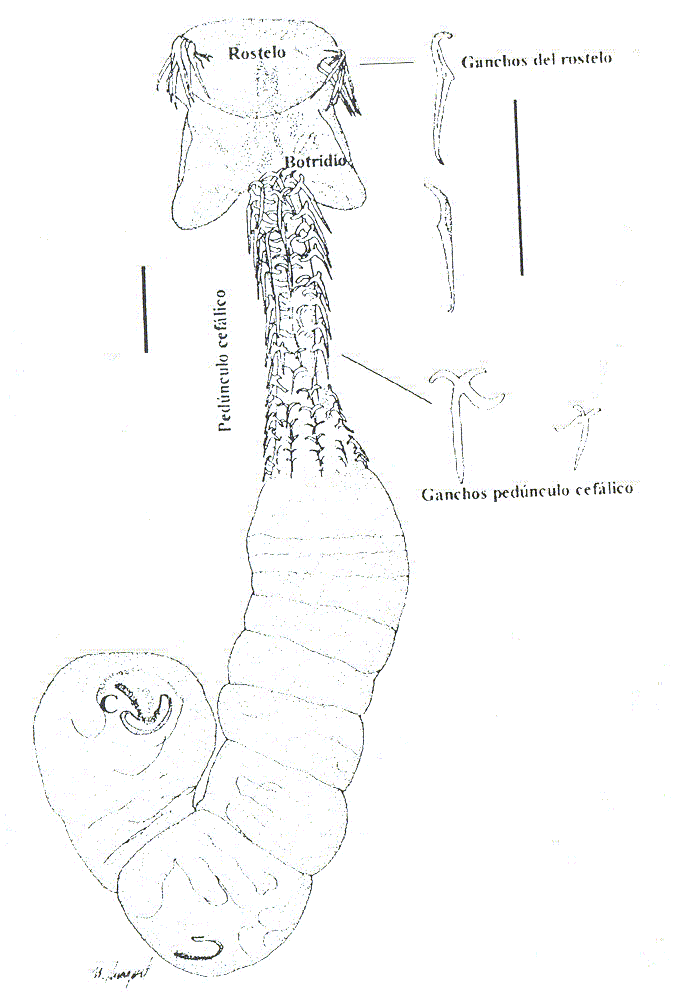
RESUMEN Durante el período comprendido entre marzo de 1999 y marzo de 2000, se realizó el análisis de la helmintofauna presente en el intestino en espiral de 132 rayas (Raja brachyura, R. microocellata, R. montagui. R. undulata y Raja spp.), capturadas en la plataforma continental gallega. En la región anterior del intestino en espiral de R. brachyura. R. microocellata y R. montagui se encontró un cestodo identificado como Echinobothrium brachysoma Pintner, 1889, el cual se caracteriza por poseer un rostelo armado con 9 ganchos largos en cada botridio, situados en una hilera y flanqueados por 3 ganchos pequeños. El pedúnculo cefálico consta de 8 hileras formadas por 14 ganchos cada una. La segmentación es acraspedota, cirro armado y ovario posterior lobulado. Tiene 8 y 9 testículos por segmento. La prevalencia es del 10% y la intensidad media de 26 parásitos. Se realizó un estudio detallado de la morfología interna mediante microscopía óptica y de la superficie externa haciendo uso de la microscopía electrónica de barrido. Por primera vez se informa sobre este grupo de cestodo parasitando peces en la Península Ibérica. Palabras Clave: Echinobothrium brachysoma; cestoda; Diphyllidea; Galicia; España. INTRODUCCIÓN Los cestodos son platelmintos polizoicos, carecen de aparato digestivo, circulatorio y respiratorio, tienen un órgano de fijación bien diferenciado denominado escólex (en el que se encuentran ventosas, botridios y rostelo), el cuello (región insegmentada posterior al escólex) y un estróbilo constituido por una sucesión de segmentos denominados proglótides. Cada proglótide madura contiene órganos genitales masculinos y femeninos (Cheng, 1978; Gállego, 1998). Echinobothrium Van Beneden 1849, es el género de cestodo que cuenta con el mayor número de especies dentro de los tres géneros existentes en el orden Diphyllidea. La revisión realizada por Campbell y Andrade (1997) reconoce un total de 20 especies en este género, quedando, según dichos autores, 8 especies como inquerendae. Posteriormente se describen otras dos (Ivanov, 1997; Ivanov y Campbell, 1998). El género Echinobothrium lo estableció Van Beneden para E. typus Van Beneden, 1849, en el intestino en espiral de Raja clavata Linnaeus, 1758. Estos cestodos se encuentran frecuentemente en rayas y, en algunas ocasiones en tiburones (Sanaka et al., 1986). Esta investigación se planteó debido a que el grupo de las rayas posee un alto valor económico como pez de captura en la costa de Galicia; sin embargo, hasta la fecha no se había realizado una investigación helmintológica detallada de este grupo de cestodos. MATERIALES Y MÉTODOS Se analizaron para diagnóstico parasitológico 132 rayas, capturadas mediante artes de pesca de uso tradicional en Galicia, nor-oeste de España, las cuales se identificaron como Raja brachyura, R. microocellata, R. montagui, R. undulata y otras rayas no identificadas hasta nivel de especie, denominadas Raja spp. Las coordenadas de pesca se ubicaron en el siguiente rango: 42° 35' 00" - 42° 41' 00" latitud norte y 09° 02' 01" - 09° 10' 00" longitud oeste, que corresponden con la plataforma continental de la Ría de Muros y Noya, siendo la profundidad media de captura de 21,31 ± 7,53 brazas (1 braza = 1,67 m). Las rayas, colocadas en hielo triturado, fueron transportadas inmediatamente al laboratorio para realizar la disección. Luego de extraerles el intestino en espiral a cada pez, éstos se observaron baja lupa estereoscópica, realizándose seguidamente alícuotas del contenido intestinal para seleccionar los cestodos objeto de análisis; el contenido de las alícuotas se pasó a través de un tamiz de 50 μm, lavando sucesivamente con solución salina al 10%. Los cestodos se transfirieron a alcohol 70°, coloreándose con carmín alumbre y montaron en bálsamo de Canadá. Dichos montajes permitieron la realización de dibujos y tomas de medidas, utilizando un microscopio Nikon con tubo de dibujo. Para microscopía electrónica de barrido (SEM) se fijaron en glutaraldehido 2,5% post-fijación en tetraóxido de osmio al 1% deshidratándose en series crecientes de etano. Posteriormente fueron disecados con CO2 (desecador Emitech K850) y montados en porta objetos de aluminio con película de carbono, metalizándose con oro paladio (metalizador Emitech K550) y observados en microscopio electrónico LEO/Zeiss. Para la clasificación y descripción de los cestodos hasta nivel de género, fueron utilizadas las siguientes claves: Wardle y McLeod (1952), Khalil et al. (1994) Y Brooks et al. (1985). La determinación a nivel de especie se realizó consultando la bibliografía publicada en diversas revistas de parasitología. Las diferentes medidas se tomaron en μm, seguidas de la desviación estándar (DE) presentando entre paréntesis el rango (mínimo o máximo). RESULTADOS Y DISCUSIÓN En la región anterior del intestino en espiral de R. brachyura, R. microocellata y R. montagui se encontró un helminto que, de acuerdo con sus características fue identificado como Echinobothrium brachysoma (Diphyllidea: Echinobothriidae). Este cestodo presenta proglótides acraspedota más largas que anchas, apolítico con pocos segmentos (mínimo 3, máximo 9), con una longitud total de 653 ± 102 (500 - 780) y un ancho de 301 ± 41 (250 - 350). Escólex 266 ± 42 (225 - 308) de largo y 214 ± 17 (200 - 233) de ancho, constituido por un rostelo armado y dos botridios ovalados, uno dorsal y otro ventral, con 126 ± 13 (115 - 138) de largo y 204 ± 10 (193 - 213) de ancho. La armadura rostelar está formada por dos grupos de 15 ganchos, uno en posición dorsal y otro en posición ventral, dispuestos en dos hileras (Figuras 1 y 2), las medidas de los mismos se detallan en el Cuadro 1. Posee un pedúnculo cefálico, 401 ± 58 (338 - 455) de largo y 89 ± 1 (88 - 90) de ancho, armado con 8 hileras longitudinales de 14 ganchos cada una, los cuales disminuyen paulatinamente de tamaño: 70 μm los situados en posición apical, 50 μm los de posición media y 20 μm los ubicados en posición basal (Figuras 2, 3, 4C, 4D y 4E). Fueron pocos los especímenes maduros que presentaron nueve testículos pre-ováricos distribuidos en dos filas longitudinales, solapando el saco del cirro. El ovario posterior es bilobulado.
Preparaciones en montajes acuosos como líquido de Hoyer-azul de algodón permitieron la observación al microscopio óptico de microtricos en el escólex (Figuras 3 y 4), los cuales no se detectaron en montajes permanentes coloreados con carmín (Figura 1 A, B, C) o en muestras de microcopía electrónica de barrido (Figura 4 B), posiblemente porque se desprendieron durante el procesamiento de las muestras. Aunque algunos sugieren que para evitar la pérdida de los microtricos no debe hacerse el punto crítico y usar Peldri II (Verónica A. Ivanov. Comunicación personal. Universidad de Buenos Aires. Facultad de Ciencias Exactas y Naturales. Dpto. de Cs. Biológicas. Laboratorio de Helmintología. Ciudad Universitaria. Argentina), no pudo ponerse a prueba dicha técnica debido a la baja prevalencia e intensidad parasitaria. Se encontró polimorfismo en los parásitos asociado con la especie hospedadora, no obstante la coincidencia de las características taxonómicas de rigor (Figura 1 A, B, C y D). La validez del orden Diphyllidea (Carus, 1863) se acepta actualmente a pesar de las controversias entre los diferentes autores (Ivanov y Hoberg, 1999; Caira et al., 1999). Este orden fue aceptado por Hyman (1951), Rees (1959), Yamaguti (1959), Joyeux y Baer (1961), Schmidt (1970, 1986) Y Khalil (1994). Wardle y McLeod (1952) Y Schmidt (1986) sugieren que los dos botridios que presentan dichos cestodos se desarrollaron por fusión de cuatro botridios ancestral es, planteando la existencia de una relación con los Tetraphyllidea (Carus, 1863). Al contrario, Rees (1959) afirma que la distribución de las glándulas vitelinas en Ditrachybothridium macrocephalum Rees, 1959 (Diphyllidea) se parece a lo observado en los Trypanorhyncha Diesing (1863) y en los Pseudophyllidea (Carus, 1863). Así mismo, Slais (1973) encuentra similitud entre varios estadios larvarios de Trypanorhyncha y Diphyllidea. Este orden está compuesto por tres familias, cada una con un género: Echinobothriidae Perrier, 1897 (Echinobothrium Van Beneden, 1849); Ditrachybothridiidae Schmidt, 1970 (Ditrachybothridium Rees, 1959) y Macrobothridiidae descrita por Khalil y Abdul-Salam, 1989 (Macrobothridium Khalil y Abdul-Salam, 1989). Se han desarrollado estudios filogenéticos (Ivanov y Hoberg, 1999; Caira et al., 1999) que tratan de explicar las relaciones entre los distintos grupos. Los resultados condujeron a la siguiente hipótesis: los Diphyllidea son un grupo monofilético; de los tres géneros que lo componen existe mayor relación entre Echinobothrium sp., y Macrobothridium sp., que cualquiera de éstos con Ditrachybothridium macrocephalum (Caira et al., 1999).
Todas las especies del género Echinobothrium poseen un escólex con rostelo armado y un pedúnculo cefálico, también armado, con hileras de ganchos longitudinales, excepto E. Reesae Ramadevi, 1969 y E. Deeghae Gupta y Parmar, 1988 (Ramadevi, 1969; Gupta y Parmar, 1988). Estas especies, ambas de las costas de la India, requieren de nuevas investigaciones, dado que una de las principales características de dichos cestodos, como se indicó antes, es la presencia de ganchos en el pedúnculo cefálico. El género Echinobothrium lo estableció Van Beneden, 1849 para E. typus, parasitando el intestino en espiral de R. clavata Linnaeus, 1758. Estos cestodos se han descrito frecuentemente en rayas y en algunas ocasiones en tiburones (Sanaka et al., 1986). Campbell y Andrade (1997), realizando una revisión del género, encontraron un total de 20 especies, quedando, según dichos autores, 8 como inquirendae; ellas son: E. benedeni Ruszkowski, 1927; E. boisii Southwell, 1911, E. deeghai Gupta y Parmar, 1988, E. laevicolle Lespes, 1857, E. lateroporum Subhapradha, 1948, E. reesae Ramadevi, 1969, E. rhinoptera Shipley y Homell, 1906 y E. scoliodoni Sanaka, Lakshmi y Rao, 1986. Posteriormente, Ivanov (1997) describe E. notoguidoi; más tarde Ivanov y Campbell (1998) describen E. californiensis, luego se identifican E. mexicanum y E. fautleyae, en elasmobranquios del golfo de México (Tyler y Caira, 1999), aumentando a 24 el número de especies descritas para dicho género. Así, Echinobothrium es el género que cuenta con el mayor número de especies, dentro de los tres que componen el orden Diphyllidea (Cuadro 2). No existen descripciones previas de E. brachysoma sobre Raja brachyura, R. microocellata y R. montagui. En esta última fue descrito E. acanthinophylum (Rees, 1959). El no detectar estos cestodos sobre el resto de las rayas muestreadas puede deberse al hábitat y a los hábitos alimentarios diferentes, ya que el hospedador intermediario es generalmente un crustáceo (Ramadevi y Rao, 1974). La investigación aquí descrita representa el primer trabajo de este género de cestodo para la Península Ibérica (Cordero del Campillo et al., 1994; Sanmartín et al., 2000).
AGRADECIMIENTO Deseo dejar constancia de mi gratitud a la institución para la cual trabajo al Laboratorio de Parasitología, Instituto de Investigaciones y Análisis Alimentario, Campus Sur, Universidad de Santiago de Compostela, España. Al armador del barco "El Depredador II", don José Francisco Rodríguez, por la captura del material objeto de este estudio. SUMMARY During the period of march 1999 to march 2000, a study was performed of the helminthic fauna in the hairspring intestine of 132 rays (it Rends brachyura, R. microocellata, R. montagui, R. undulata and it Rends spp.) captured in the Galician continental platform, within the range of coordinates of 42° 35' 00" - 42° 41' 00" North latitude and 09° 02' 01'09° 10' 00" West longitude with an average depth of capture of 21.31 ± 7.53 fathoms. In the region previous to the hairspring intestine of R. brachyura, R. microoclellata and R. montagui a cestode identified as Echinobothrium brachysoma Pintner, 1889, was found. It has an armed rostellum with 9 long hooks in each botridio, which are located in an array and they are tlanked by three small hooks. The cephalic peduncle consists of 8 arrays formed by 14 hooks each. The segmentation is acraspedota, armed cirrus and ovary posterior lobulated. It has 8 to 9 testicles per segment with a prevalencia of 10% and a half intensity of 26 parasites. A detailed study ofthe internal morphology was carried out by means of optic microscopy and of the external surface making use of a scanning electron microscope. For the first time this group of cestodes is reported as a parasite of fish in the Iberian Peninsula. Key Words: Echinoboyhrium brachysoma; cestode; Diphyllidae; Rajidae. BIBLIOGRAFÍA BROOKS, D. R., R. T. O'GRADY and D. R. GLEN. 1985. The phylogeny of the cercomeria brooks, 1982 (Platyhelminthes). Proc. Helminthol. Soco Wash. 52(1):1-20. CAIRA, J. N., K. JENSEN and C. HEALY. 1999. On the phylogenetic relationships among tetraphyllidean, lecanicephalidean and diphyllidean tapeworm genera. Systematic Parasitology 42:77-151. CAMPBELL, R. A. and M. ANDRADE. 1997. Echinobothrium raschii n. sp. (Cestoda: Diphyllidea) from Rhinoraja longi (Condrichthyes: Rajoidei) in the Bering sea. J. Parasitol. 83 (1): 115-120. CHENG, T. C. 1978. Parasitología general. Madrid. la Ed. española. Ed. A. C. 695 p. CORDERO del CAMPILLO, M. L., CASTAÑÓN-ORDOÑEZ y A. REGUERA-FEO. 1994. Índice-catálogo de zooparásitos ibéricos. 2a edición. Universidad de León. Secretariado de Publicaciones. 650 p. GÁLLEGO, B. J. 1998. Manual de parasitología. Morfología y biología de los parásitos de interés sanitario. Ediciones Universitarias de Barcelona. 491 p. GUPTA V. and S. P ARMAR. 1988. Echinobothrium deeghai n. sp. from a marine fish Trygon sephen of West Bengal. Proceedings of Parasitology 6:78-81. HYMAN, H. L. 1951. The invertebrates: Platyhelminthes and Rhychocoela. New York. McGraw-Hill. Vol. II. 550 p. IVANOV, V. A. 1997. Echinobothrium notoguidoi n. sp. (Cestoidea: Diphyllidea) from Mustelus schmitti (Condrichthyes: Carcharhiniformes) in the Argentine sea. The Joumal of Parasitology 83(5):913-916. IVANOV, V. A. and R. A. CAMPBELL. 1998a. Echinobothrium megacanthum n. sp. (Cestoda: Diphyllidae) from the eagle ray Myliobatis goodei (Condrichthyes: Rajoidei) from the Patagonian shelf of Argentina. Folia Parasitologica 45(3):225-229. IVANOV, V. A. and R. A. CAMPBELL. 1998b. Echinobothrium californiense n. sp. (Cestoda: Diphyllidea) from the thomback ray Platyrhinoidis triseriata (Chondrichthyes: Rajoidei) and a key to the especies in the genus. Systematic Parasitology 40:49-54. IVANOV, V. A. and P. E. HOBERG. 1999. Preliminary comments on a phylogenetic study of the order Diphyllidea van Beneden in Caros, 1893. Systematic Parasitology 42:21-27. JOYEUX, C. and J. G. BAER. 1961. Classe des cestodes. In: Grassé, P. P. (Ed.). Traité de Zoologie. Anatomie, systematic, biologie. Platyhelminthes, mésozaires, acanthocéphales, némertiens. Paris: Masson et Cie. Vol. 4 Fase. 1. p. 347-560. KHALIL, L. F. 1994. Keys the cestode parasites of vertebrates. Wallingford, UK. CAB Intemational. 751 p. KHALIL, L. F. and J. ABDUL-SALAM. 1989. Macrobothridium rhynchobati n. sp. from the elasmobranch Rhynchobatus granulatus. representing a new family of diphyllidean Cestodes, the Macrobothridiidae. Systematic Parasitology 13: 103-109. McVICAR, A. H. 1976. Echinobothrium harfordi n. sp. (Cestoda: Diphyllidea) from Raja naevus in the North sea and English Channel. Joumal of Helminthology 50: 31-38. PROBERT, A. J. and B. STOBART. 1989. Echinobothrium clavatum n. sp. (Cestoda: Diphyllidea) from the spiral valve of Raja clavata L. 1758, including a note on its ultrastructure and a key to species of the genus. Systematic Parasitology 13: 71-77. RAMADEVI, P. and K. RAO. 1974. The larva of Echinobothrium reese Ramadevi, 1969 (Cestoda: Diphyllidea) from the body cavity of a pasiphaeid crustacean Leptochela aculeocaudata Paulson, 1875. Joumal of Helminthology 48: 129-131. RAMADEVI, P. 1969. Echinobothrium reese (Cestoda: Diphyllidea) from the sting rays of Waltair Coast. Annales de Parasitologie Humaine et Comparée 44: 231-239. REES, G. 1959. Ditrachybothridium macrocephalum n. gen., n. sp., a cestode from some elasmobranch fishes. Parasitology 49: 191-209. SANAKA, S., C. V. LAKSHMIAND and K. H. RAO. 1986. Studies on a new species Echinobothrium scoliodoni (Order: Diphyllidea) from Chiloscyllium indicum from Waltair Coast. Revista Ibérica Parasitológica 46:53-57. SANMARTÍN, M. L., M. F. ÁLVAREZ, D. PERIS, R. IGLESIAS and J. LEIRO. 2000. Parasite community of the undulate ray Raja undulata in the Ría of Muros (Galicia, northwest Spain). Aquaculture 184:189-201. SAOUD, M. F., M. M. RAMADAN and S. I. HASSAN. 1982. On Echinobothrium helmymohamedi n. sp. (Cestoda: Diphyllidea), a parasite of the sting ray Taeniura Iymma from the red sea. Journal of the Egyptian Society of Parasitology 12(1): 199-207. SCHMIDT, G. D. 1970. How to know the tapeworms. Dubuque, Iowa. Brown Co. Publishers. 226 p. SCHMIDT, G. D. 1986. CRC hadbook of tapeworm identification. Florida, USA. CRC Press. 675 p. SLAIS, J. 1973. Functional morphology of cestode larvae. Advances in Parasitology 11 :395-706. TYLER, G. A. and J. N. CAIRA. 1999. Two new species of Echinobothrium (Cestoidea: Diphyllidea) from Myliobatiform elasmobranches in the Gulf of California, México. J. Parasitol. 85(2):327-335. WARDLE, R. A. and J. A. McLEOD. 1952. The zoology of tapeworms. Minneapolis. University of Minnesota Press. USA. 780 p. WILLIAMS A. D. and R. A. CAMPBELL. 1980. Echinobothrium bonasum n. sp. A new cestode from the cownose ray, Rhinoptera bonasus (Mitchill, 1815), in the Western North Atlantic. J. Parasitol. 66(6):1 036-1 038. WILLIAMS, H. H. 1964. A list of parasitic worms, including 22 new records, from marine fishes caught of the British Isles. Ann. Mag. Nat. Hist. 2:705-715. WOJCIECHOWSKA, A. 1991. Some tetraphyllidean and diphyllidean cestodes from Antartic bato id fishes. Acta Parasitológica 36(2):69-74. YAMAGUTI, S. 1959. Systema Helminthum 2. The cestodes of vertebrates. London. Intersciences Publishers. 860 p. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||