|
Veterinaria Trop. 26(2):89-108. 2001 CULTIVO in vitro DE Babesia bovis Ana T. Guillén Torres* y Edgar A. León Arenas* 1 Parte del trabajo de la
Tesis de Maestría del autor principal. Recibido: febrero 19, 2003. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
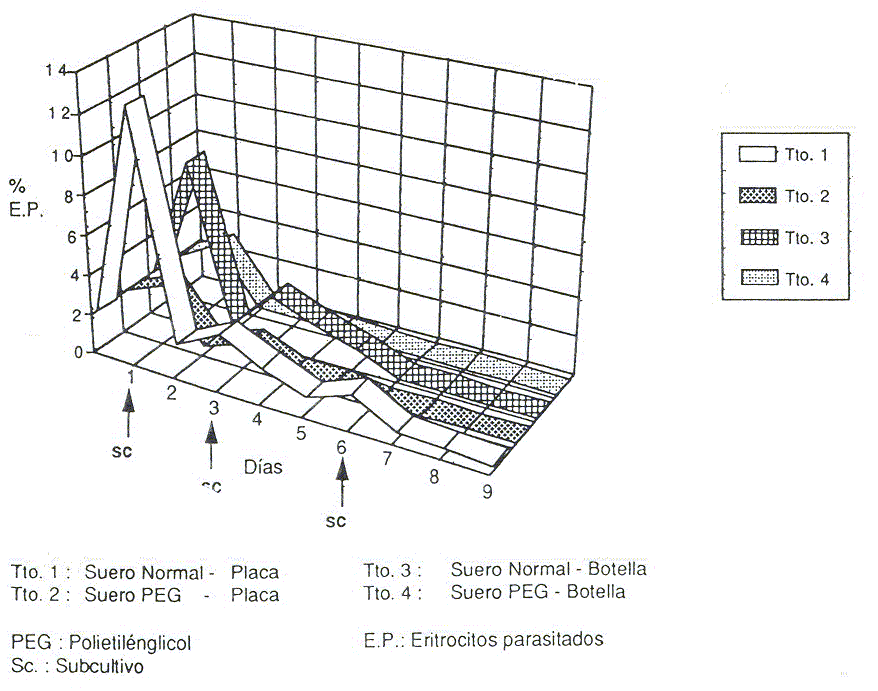
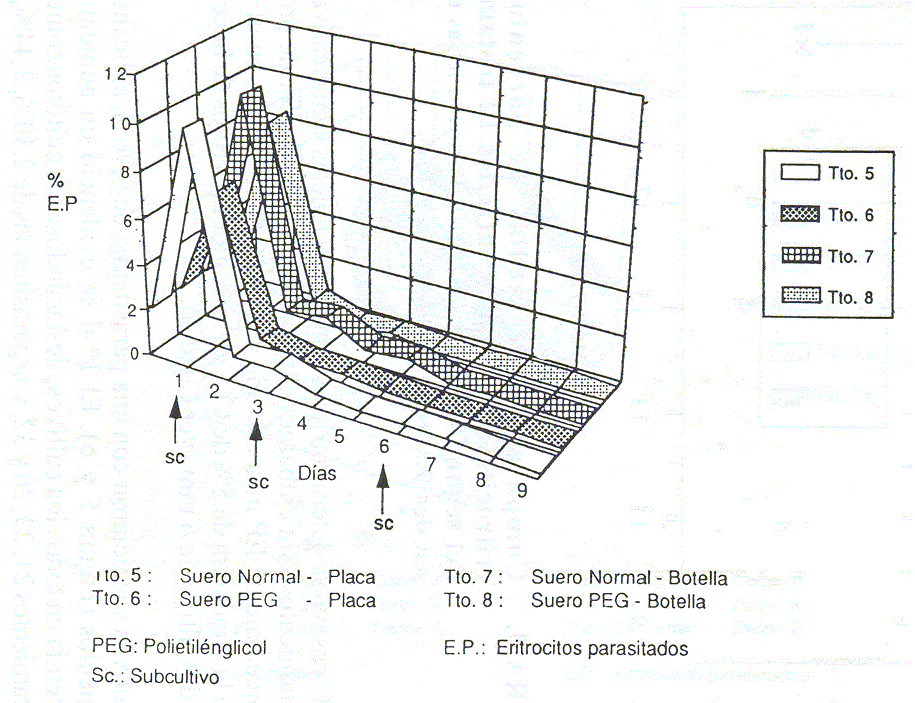
RESUMEN Para establecer las condiciones bajo las cuales el cultivo en sistemas microaerófilo en fase estacionaria (SMAE) permitiera el mejor crecimiento y multiplicación continua de Bahesia bovis en el país, se aplicaron 32 tratamientos repartidos en tres ensayos, en arreglo factorial de 2x2x2 y 2x2x3, realizando análisis de varianza factorial, comparación de medias y evaluación de las curvas de crecimiento parasitario. Los tratamientos a evaluar involucraron las siguientes variables: dos atmósferas (5% de CO2 en aire y la mezcla de 5% de CO2, 2% de O2 y 93% de N2); dos tipos de suero (suero normal bovino, SNB y suero normal bovino tratado con polietilénglicol, SPEG); dos recipientes (placa y frasco); dos bovinos adultos (A y B), como dadores de glóbulos rojos normales y SNB; dos dadores de glóbulos rojos normales (bovino adulto y becerro) y tres alturas del cultivo (4, 5 y 6 mm). Los tratamientos que obtuvieron los promedios de porcentaje de eritrocitos parasitados más elevados, involucraron a la atmósfera de 5% de CO2 en aire y altura del cultivo de 6 mm. Se evidenció crecimiento parasitario durante las primeras 24 horas, sin establecerse un periodo previo de adaptación. El crecimiento de los parásitos se vió afectado luego de realizar los subcultivos, no estableciéndose los cultivos en forma continua. Palabras Clave: Babesia bovis; cultivo in vitro; bovino. INTRODUCCIÓN Para lograr el crecimiento de cualquier agente infeccioso en condiciones de laboratorio es necesario mantenerlo en condiciones similares a las que se encuentran cuando está en su hospedador natural. Las babesias, por su condición de parásitos intracelulares, dependen para su sobrevivencia y replicación del buen estado del parásito, de la célula hospedadora y del entorno donde se desarrolla. Tradicionalmente, el mantenimiento de las especies de protozoarios del género Babesia se realizaba a través de pases en forma seriada en animales, utilizando un hospedador natural o adaptado (Palmer et al., 1981; Rodríguez, 1989). Sin embargo, la baja parasitemia alcanzada por algunas babesias (notablemente Babesia bovis) y la remoción continua de parásitos extracelulares, como de sus productos, por el sistema retículo endotelial del hospedador, limitaba la población de parásitos disponibles para estudio (Gravely et al., 1979). De ahí, el interés de los investigadores en real izar ensayos que permitieran el crecimiento y reproducción · de algunas de las diferentes especies del género Babesia fuera del hospedador y bajo condiciones relativamente sofisticadas de laboratorio (Aboytes y Vega, 1985), logrando una importante contribución al estudio de estos agentes, el desarrollo de cultivos in vitro (Rodríguez et al., 1994). El método desarrollado por Trager y Jensen (1976) para Plasmodium falciparum fue utilizado en 1978 por Erp et al., para cultivar B. bovis por primera vez, obteniéndose un ligero incremento en el porcentaje de eritrocitos parasitados (EP) después de las 24 a 48 horas, adaptándose conjuntamente el sistema de matraces en agitación magnética, lográndose crecimiento a corto plazo. Timms (1980) logró cultivar B. bovis in vitro, por el método de velobiosis, con resultados positivos, pero sólo por períodos de 72 h. En sus trabajos Erp et al. (1980a ) lograron establecer el crecimiento continuo del parásito por primera vez, fijando con ello un precedente a nivel mundial. Ese mismo año, Erp et al. (1980b) analizaron diferentes variables a distintos niveles y su efecto sobre el crecimiento del parásito. Levy y Ristic (1980) logran perfeccionar la técnica y desarrollar el sistema microaerófilo en fase estacionaria (SMAE), el cual permitió la multiplicación continua de B. bovis en eritrocitos de bovino sedimentados, realizándose posteriormente por Palmer et al. (1981), experimentos con el fin de optimizar el SMAE. Por su parte, Rodríguez et al. (1983) iniciaron cultivos con parasitemias inferiores a 0,1% utilizando atmósferas de baja tensión de oxígeno y niveles de fluido o altura de 4 y 5 mm, permitiéndoles detectar a animales portadores que habían resultado negativos en frotis de sangre. Figueroa et al. (1984), tomando en cuenta las modificaciones realizadas en el SMAE por Palmer et al. (1981) Y Rodríguez et al. (1983), lograron establecer las condiciones óptimas para la multiplicación de B. bovis, bajo las condiciones ambientales de la ciudad de México. Con el método de cultivo SMAE es posible realizar, entre otros, estudios de la biología básica del organismo, su interacción con el huésped, factores inmunes disparados por el parásito, factores involucrados con la resistencia innata de animales jóvenes a la infección y susceptibilidad antimicrobial, a niveles no alcanzados antes del establecimiento de los cultivos (Schuster, 2002). Es conveniente señalar que la información relativa a la metodología de cultivo in vitro de B. bovis ha sido generada en laboratorios de diferentes latitudes geográficas. Esto implica que para obtener resultados satisfactorios en otros laboratorios, se requiere de ensayos previos para establecer las condiciones óptimas de cultivo. En vista de ello, el objetivo de este trabajo fue someter cultivos de B. bovis, cepas autóctonas, a diferentes condiciones de manejo, utilizando el SMAE. MATERIALES Y MÉTODOS Animales experimentales Para los ensayos de cultivo se utilizaron tres becerros esplenectomizados, mestizos Holstein, menores de 9 meses de edad, de los cuales se obtuvieron glóbulos rojos parasitados, previa inoculación vía endovenosa con aislados de B. bovis. Como donante de suero normal se utilizaron dos bovinos adultos, mestizos Holstein de 3 años de edad y como donantes de glóbulos rojos no infectados, se utilizaron un bovino adulto y un becerro. Los animales estaban libres de agentes hemotrópicos y seronegativos por la técnica de inmunofluorescencia indirecta. Obtención de suero normal y glóbulos rojos de bovino La sangre se obtuvo mediante punción yugular, colectada a través de sonda en frasco estéril con perlas de vidrio. La sangre desfibrinada se centrifugó a 1 500 g por 15 minutos a 4°C. El suero se separó y clarificó por centrifugación, congelándose a -20°C. Los eritrocitos se lavaron 3 veces con solución de Vega y Martínez, VYM (Vega et al., 1985), eliminando la capa de glóbulos blancos al final de cada centrifugación, almacenándose en refrigeración hasta su uso, en un período no mayor de 10 días. Obtención de glóbulos rojos parasitados La sangre de los becerros inoculados experimentalmente con B. bovis se recolectó, cuando las parasitemias alcanzaron niveles mayores de 0,5%. El manejo para obtener los glóbulos parasitados fue el mismo que para obtener los glóbulos rojos normales. Cultivos Y subcultivos El medio de cultivo completo (MCC) se preparó utilizando 60 % de medio de cultivo M-199 con sales de Earle, 2,2 g de bicarbonato de sodio por litro de medio, TES a una concentración de 25 mM y 40% de suero normal bovino (SNB, Moyao, 1989 ), esterilizado por filtración a través de una membrana de 0,22 μm. El paquete de EP se resuspendió en MCC a una concentración de 5% v/v, para sembrar las placas de 24 pozos y los frascos de cultivo. Se realizaron cambios diarios de medio, lo cual permitía eliminar metabolitos y sustancias tóxicas y por otra parte proveer nutrientes nuevos (Álvarez, 1989). El porcentaje de EP se determinó diariamente mediante la observación de frotis sanguíneo teñido por Giemsa (FSTG). Los subcultivos, donde se utilizó una suspensión de eritrocitos no parasitados (ENP) en MCC al 5% v/v, se realizaron cada 48 h y la dilución del subcultivo dependió de la parasitemia del cultivo. Primer ensayo Se infectó experimentalmente un becerro esplenectomizado con un inóculo de glóbulos rojos parasitados con B. bovis (aislado Guárico, segundo pasaje), realizándose evaluación diaria de temperatura, hematocrito y FSTG El día 13 post-inoculación y con valores de hematocrito de 22%, temperatura de 39 °C y 2% de EP, se procedió a recolectar y procesar la sangre para el cultivo, evaluándose las variables: 2 atmósferas de gases (5% de CO2 en aire y una mezcla compuesta por 5% de CO2, 2% de O2 y 93% de N2), 2 tipos de suero (SNB y suero tratado con polietilénglicol, SPEG), basándonos en el trabajo de Barteling (citado por Mesquita y Vieira, 1979) y dos recipientes (frascos de 25 cm2 y placas de cultivo de 24 pozos). La altura o nivel de la suspensión fue de 5 mm, por lo que los volúmenes por pozo y por frasco fueron 1 000 μ11 y 10 ml, respectivamente. Los cultivos se colocaron en sus respectivas estufas a 37°C. Como diseño experimental se utilizó un arreglo factorial 23, lo que significa que se evaluaron tres factores (atmósfera, tipo de suero y recipiente) con 2 niveles cada uno, resultando un total de 8 tratamientos (1 al 8). Segundo ensayo En este ensayo, se inoculó un becerro con B. bovis (aislado Guárico, 3er pasaje), realizándose evaluación diaria de temperatura, hematocrito y FSTG. El día 12 post-inoculación y con valores de hematocrito de 26%, temperatura de 40,8 °C y 0,67% de EP, se procedió a recolectar y procesar la sangre para el cultivo, evaluándose las variables: 2 atmósferas de gases (5% de CO2 en aire y una mezcla compuesta por 5% de CO2, 2% de O2 y 93% de N2), 2 dadores adultos de eritrocitos normales y SNB (dador Ay dador B) y tres niveles o alturas de la suspensión (4, 5 Y 6 mm) para lo cual se agregaron 800 μl, 1 000 μl Y 1 200 μl en los pozos de las placas de cultivo, respectivamente. Se evaluaron dos factores (atmósfera y dador de suero y ENP) con 2 niveles y un factor (altura del cultivo) con 3 niveles, para un total de 12 tratamientos (9 al 20). Tercer ensayo En este ensayo se inoculó un becerro con B. bovis (aislado Yaracuy, 7mo pasaje), realizándose evaluación diaria de temperatura, hematocrito y FSTG. El día 12 post-inoculación y con valores de hematocrito de 28%, temperatura de 41 °C y 0,96% de EP, se procedió a recolectar y procesar la sangre para el cultivo, evaluándose las variables: 2 atmósferas de gases (5% de CO2 en aire y una mezcla compuesta por 5% de CO2, 2% de O2 y 93% de N2), 2 dadores de eritrocitos normales (adulto y becerro) y tres niveles o alturas de la suspensión (4, 5 Y 6 mm) para lo cual se agregaron 800 μl, 1 000 μl y 1 200 μl en los pozos de las placas de cultivo, respectivamente. Se evaluaron dos factores (atmósfera y dador de ENP) con 2 niveles y un factor (altura del cultivo) con 3 niveles, para un total de 12 tratamientos (21 al 32). En los diferentes ensayos se calcularon promedios de los porcentajes de EP por tratamiento, analizándose los datos por medio de análisis de varianza factorial y comparación de medias mediante la prueba de Duncan (Sokal y Rohlf, 1979). A través de las curvas de crecimiento parasitario, se evaluó el efecto de los diferentes tratamientos sobre el comportamiento de los cultivos. RESULTADOS Y DISCUSIÓN En el 1er ensayo se determinó que no hubo diferencias significativas entre los tratamientos. Sin embargo, el valor más elevado del promedio de porcentaje de EP con B. bovis se obtuvo con el tratamiento 1 (3,88% EP), el cual consistía en el uso de la atmósfera de 5% CO2 en aire, suero normal y utilización de placa como recipiente (ver Cuadro).
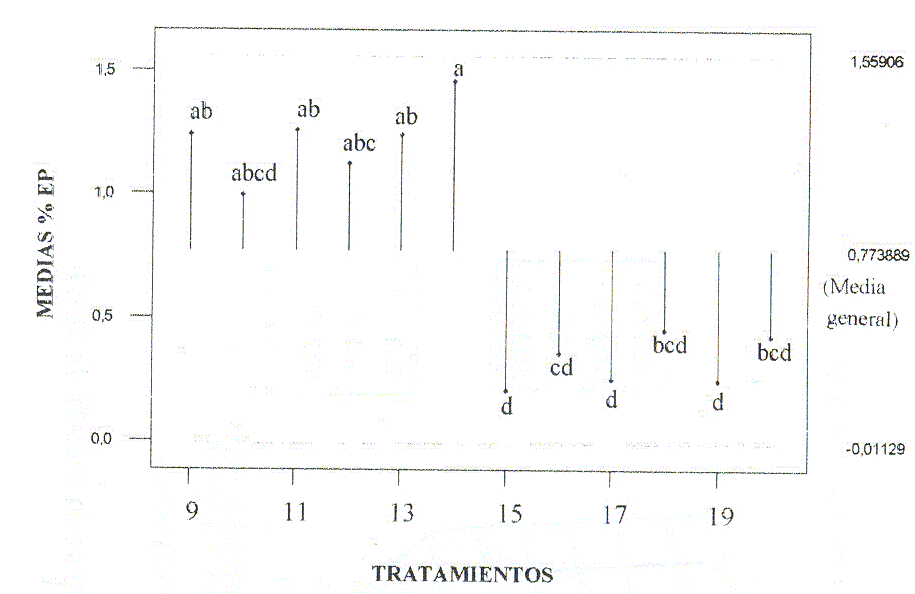
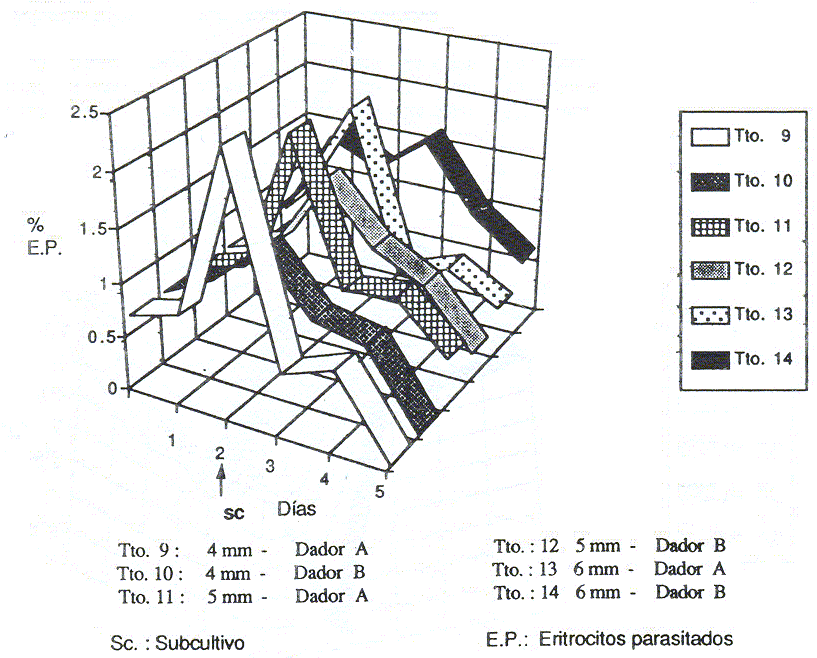
En la curva de crecimiento diario (Figuras 1 y 2) se observó que los cultivos con los tratamientos 1, 3, 5, 6 ,7 Y 8, alcanzaron parasitemias superiores a 6,75% a las 24 h, siendo el tratamiento 1 con el que se alcanzó mayor crecimiento (12,75% EP), realizándose subcultivos ese mismo día. En el 3er d se evidenciaron intentos de recuperación con los tratamientos 1,3 y 7. Así mismo, el 5to d se observaron ligeros aumentos de los valores de parasitemia con el tratamiento 7 (0,52%) y el 6to d con el tratamiento 1 (1,60%), día en el cual sólo se observaron EP en los cultivos sometidos a los tratamientos 1,5 Y 6. Al realizarse el 3er subcultivo, no hubo intentos de recuperación de los parásitos. Con el tratamiento 1 también se observaron más intentos de recuperación, posterior a la realización de los diferentes subcultivos, obteniéndose parasitemias durante un período continuo de 9 d. El tratamiento 4 resultó el menos eficiente. Para el 2do ensayo se determinó que hubo diferencias estadísticamente significativas (P<0,05) entre los tratamientos. Al determinar cuales tratamientos eran estadísticamente diferentes por medio de comparación de medias (Figura 3), se evidenció que las medias de todos los tratamientos que involucraban el uso de la atmósfera de 5% CO2 en aire estaban por encima de la media general. Así mismo, los tratamientos que utilizaron el dador A (9, 11, 13, 15, 1..7 Y 19), tuvieron un efecto similar, dentro de cada atmósfera. Los tratamientos que utilizaron el dador B (10, 12 ,14 16, 18 Y 20) se comportaron estadísticamente diferentes entre ellos y en relación a los tratamientos con el dador A. El promedio del porcentaje de EP más elevado (1,46% EP), correspondió al tratamiento 14, el cual consistía en el uso de la atmósfera de 5% de CO2 en aire, con el dador adulto B y la altura de cultivo de 6 mm (ver Cuadro). En este ensayo, los cultivos se iniciaron con una parasitemia de 0,67% EP, utilizándose 12 tratamientos. El 1er d hubo un aumento de las parasitemias sólo con los 6 primeros tratamientos (Figura 4), correspondiendo los valores más elevados al 13 y 14 (1,19% Y 1,49% EP, respectivamente). Para el 2do d se evidenció crecimiento parasitario en los cultivos sometidos a los tratamientos 9, 10, 11, 12, 13, siendo el mayor valor, el alcanzado por el tratamiento 9 (2,41 %). Una vez hecho el subcultivo, el tratamiento que se mantuvo hasta el 5to d con los valores de parasitemia más altos fue el 14. Los cultivos sometidos a los últimos 6 tratamientos, en ningún momento sobrepasaron la parasitemia inicial.
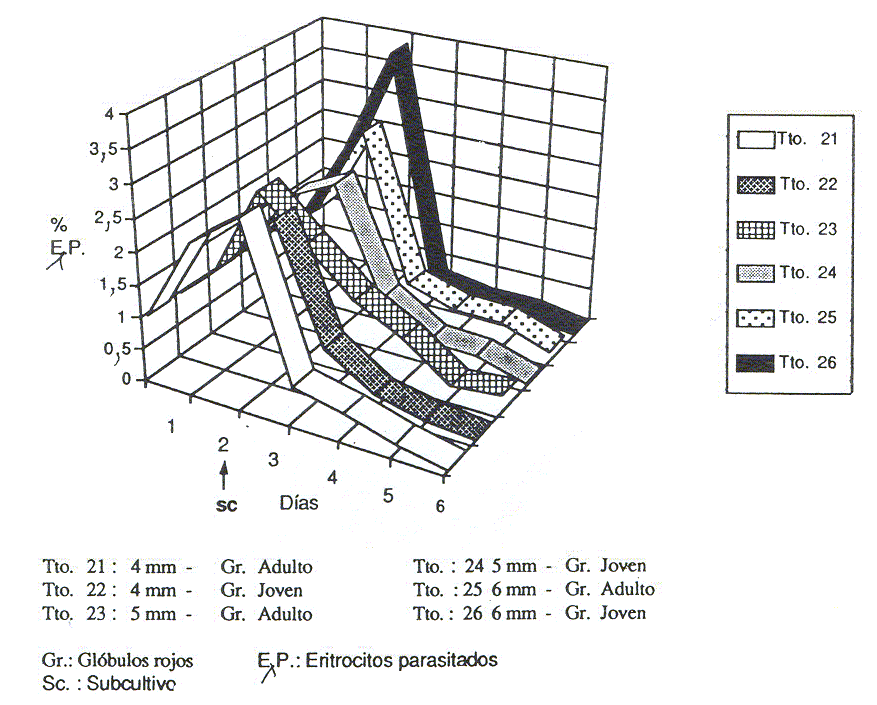
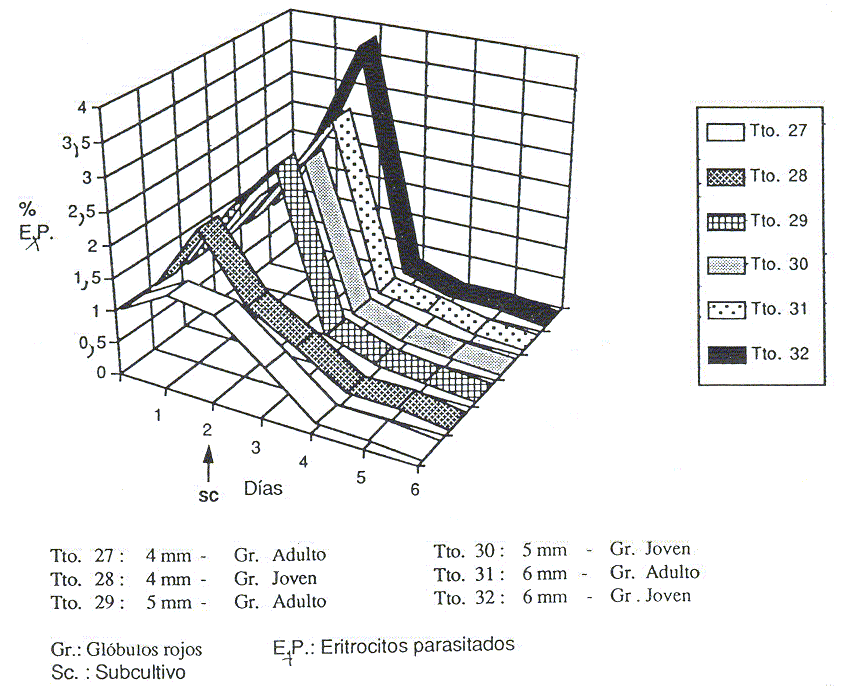
En el 3er ensayo se determinó que no hubo diferencias significativas entre los tratamientos. Sin embargo, el tratamiento con el valor de promedio del porcentaje de EP más elevado fue el 26 (1,35% EP), en el cual se evaluó la atmósfera de 5% de CO2 en aire, glóbulos rojos de becerro y la altura de cultivo de 6 mm (ver Cuadro). Los cultivos se iniciaron con una parasitemia de 0,96%, aplicándose 12 tratamientos (Figura 5 y 6). El 1er d se evidenció un aumento de la parasitemia en todos los cultivos, destacándose los cultivos sometidos a los tratamientos 21, 23, 26 y 32, con parasitemias de 2,30%, 2,44%, 2,20% Y 2,23%, respectivamente. En el 2do d se observó un nuevo ascenso en los valores de EP de la mayoría de los cultivos, a excepción de los sometidos a los tratamientos 23, 27 y 28, obteniéndose los mayores porcentajes en los tratamientos 26 y 32 (3,86% y 3,85%, respectivamente). En general, a partir del 3er d, día posterior al subcultivo, las parasitemias no lograron alcanzar niveles que permitieran la recuperación de los cultivos.
La morfología parasitmia predominante en los cultivos fue la de merozoitos (Figura 7), siendo los trofozoitos más frecuentes en la sangre de los animales parasitados. La morfología no se modificó, ni aún después que las parasitemias disminuyeron. Los cultivos en los que se evidenció porcentajes de EP más altos, tanto en el ensayo donde hubo diferencias estadísticamente significativas entre los tratamientos y en los que el comportamiento entre ellos fue similar, resultaron ser aquellos que se incubaron en la atmósfera de 5% de CO2 en aire y una altura de 6 mm de la columna de medio. Esto coincide con los trabajos de Levy y Ristic (1980) y de Rodríguez et al. (1983) donde los mejores crecimientos se obtuvieron en los cultivos mantenidos en atmósfera alta en oxígeno y niveles de fluido de 4,5 y 6.2 mm de altura cuando el porcentaje de EP inicial fue de 0,5 o más. El trabajo de Figueroa et al. (1984) coincide con el presente en que estadísticamente la mejor atmósfera para el cultivo fue la de 5% de CO2, pero difieren en lo relativo con el nivel de fluido recomendado. El SMAE utiliza como requerimiento para B. bovis una baja tensión de oxígeno, suministrando un sistema capaz de generar cantidades masivas de antígeno. Si las condiciones de cultivo permiten el establecimiento de los parásitos, el resultado de su actividad metabólica es la reducción del oxígeno en el microambiente, con lo cual se previene el efecto tóxico de una alta concentración de este gas. Es por esta razón que el término microaerófilo es utilizado para describir este sistema de cultivo (Levy y Ristic, 1980 y 1983). Los requerimientos de oxígeno en este sistema son controlados por la columna de medio de cultivo sobre la capa de eritrocitos, incubados en la atmósfera de 5% de CO2 en aire (20% de oxígeno). El CO2 es un requerimiento para el crecimiento parasitario y su concentración un parámetro importante ( Levy y Ristic, 1983). Entre los tratamientos del 1er ensayo, donde fue evaluada la variable recipiente, no hubo diferencias significativas. Sin embargo, el tratamiento 1 en el que se obtuvo el promedio de porcentaje de EP más elevado, se usó placa como recipiente. En la literatura existen diferentes opiniones sobre el uso de recipientes, así Monroy et al. (1987) concluyeron que la microatmósfera formada en los frascos de cultivo favorecían el desarrollo de mayores porcentajes de EP, para el caso de B. bigemina. Sin embargo, Levy y Ristic en 1983 señalaron que mientras la relación volumen de cultivo y área de superficie fuese mantenida, no deberían existir limitantes en el recipiente a utilizar. De ahí que los parásitos se han desarrollado en cultivos, utilizando una gran variedad de recipientes.
Muchas investigaciones se han realizado para la formulación de medios definidos. En algunos casos, factores de crecimiento son identificados y sustituidos por suero o componentes de suero (Visvesvara y García, 2002). En trabajos recientes como el de Jackson et al. (2001) se ha puesto en práctica la utilización del albumax II con hypoxantina como sustituto de suero bovino en los cultivos de B. bovis, logrando incrementar la población de parásitos. Los autores, utilizando volúmenes de 600 μl en placas de 24 pozos y una atmósfera de 5% de CO2, 2% de O2 y 93% de N2 alcanzaron porcentajes significativamente más alto de glóbulos rojos parasitados que en cualquier otra combinación de volumen y mezcla de gases evaluada. Así mismo, Neves et al. (2001), utilizando medio RPMI 1640 suplementado con 100 μM de hypoxantina y 10% de suero bovino, lograron mantener los cultivos de B. bovis y B. bigemina por 6 meses, también reemplazaron el suero bovino con suero de equino, suero bovino adulto comercial o suero fetal bovino al 10%, bajo las mismas condiciones. Sin embargo, cuando el suero bovino fue remplazado por Albumax II y GF21 el crecimiento de los parásitos disminuyó marcadamente, después de 3 ciclos de 72 h de crecimiento. Los resultados obtenidos en los diferentes ensayos coinciden con lo señalado por Levy y Ristic (1980, 1983) y Figueroa et al. (1984) sobre la no existencia de un período de adaptación o selección por parte del parásito a su nuevo ambiente, debido al aumento en el porcentaje de EP que se evidenció a las 24 h de iniciado el cultivo. Según Levy y Ristic (1983), los subcultivos producen una caída de los valores de EP, los cuales tienden a subir en los días subsiguientes; siendo las máximas ratas de crecimiento alcanzadas cuando las parasitemias son reducidas a 0,5 y 1 %. En los ensayos realizados, la reducción de la parasitemia a un rango entre 0,5 y 1 %, durante los subcultivos, afectó el mantenimiento del crecimiento parasitario de forma continua. Aún cuando no se logró mantener el cultivo de B. bovis en forma continua, las mejores condiciones para su crecimiento fueron similares a las señaladas por otros autores. AGRADECIMIENTO Los autores expresan su agradecimiento a todo el personal del Laboratorio de Parasitología del Instituto de Investigaciones Veterinarias (actual Unilab Sanidad Animal) del Ceniap, por la colaboración prestada en el desarrollo de este trabajo. Así mismo, al Instituto de Investigaciones Zootécnicas (actual Unilab Producción Animal) del CENIAP y a la Cátedra de Parasitología de la Facultad de Ciencias Veterinarias de la Universidad Central de Venezuela, por facilitar los animales utilizados en la investigación. SUMMARY In order to select the best conditions for grow and replication of in vi/ro cultures of Babesia bovis using the microaerophilous stationary phase method, 3 assays and 32 treatments were conducted in a factorial arrangement of 2x2x2 and 2x2x3. Results were analyzed using factorial variance analysis, mean comparisons and growth curve evaluations. Treatments were two atmospheres (5% CO2 in air and the mixture of 5% CO2, 2% O2, 93% N2, two types of sera (normal bovine serum and bovine serum treated with polyethylene glycol PEG), two types of recipients (culture plate and culture flask), two donors of serum and normal red blood cells (A and B), two donors ofnormal red blood cells (adult bovine and calf) and three different levels offluid (4,5 and 6 mm). The highest percentage of parasitic growth was obtained using 5% CO2 in air with 6 mm of fluid level. There was parasitic multiplication during the first 24 hours,without a previous adaptation period of the parasite. Parasite growth was affected by subculture. A continuous cultivation was not achieved. Key Words: Babesia bovis; in vitro culture; bovines. BIBLIOGRAFÍA ABOYTES, R. Y C. A. VEGA. 1985.. Cultivo in vitro de Babesia bovis y Babesia bigemina. Parasitología. Sociedad Mexicana de Parasitología A.c. 25(1):73-100. ÁLVAREZ, J. A. 1989. Cambio de medio y subcultivo. In: Curso internacional "Cultivo in vitro de especies de Babesia". Instituto Nacional de Investigaciones Forestales y Agropecuarias (INIFAP). Centro Nacional de Investigaciones Disciplinarias en Macrobiología (CENID). Jiutepec. Estado de Morelos, México. Mimeo. s/n.ss ERP, E. E., S. M. GRAVELY, R. D. SMITH, M. RISTIC, B. M. OSORNO and C. A. CARSON. 1978. Growth of Babesia bovis in bovine erythrocyte cultures. Am. J. Trop. Med. Hyg. 27(5): 1061-1 064. ERP, E. E., SMITH, R. D. RISTIC, M. and a. M. OSORNO. 1980a. Continuous in vitro cultivation of Babesia bovis. Am. J. Vet. Res. 41(7):1 141-1 142. ERP, E. E., R. D. SMITH, M. RISTIC and B. M. OSORNO. 1980b. Optimization of the suspension culture method for in vitro cultivation of Babesia bovis. An J. Vet. Res. 41(12):2 059-2 062. FIGUEROA, J. v., G J. CANTO, J. J. FLORES. Y F. RUÍZ. 1984. Cultivo in vitro de Babesia bovis: establecimiento y condiciones óptimas de multiplicación. Téc. Peco Méx. 46: 46-52. GRAVELY, S. M., R. D. SMITH, E. E. REP G J. CANTO, M. AIKAWA, B. M. OSORNO and M. RISTIC. 1979. Bovine babesiosis: Partial purification and characterization ofblood culture-derived Babesia bovis. Intemational Joumal for Parasitology. 9:591-598. JACKSON, L. A., S. J. WALDRON, H. M. WEIER, C. I. NICOLL and a. M. COOKE. 2001. Babesia bovis: Culture oflaboratory adapted parasite lines and clinical isolates in a chemically defined medium. Exp. Parasitol., 99: 168-174. LEVY, M. G and M. RISTIC. 1980. Continuous cultivation in a microaerophilus stationary phase culture. Science. 207: 1 218-1 220. LEVY, M. G. and M. RISTIC. 1983. Cultivation an in vitro studies of Babesia. In: In vitro cultivation of protozoan parasites. De. Jensen, J.B. CRC Press, Inc. Boca Ratón. Florida. 221-241. LEVY, M. G, E. E. ERP and M. RISTIC. 1981. Cultivation of Babesia. In: Babesiosis. Eds. Ristic, M. and Kreier, 1.P. Academic Press Inc. New York. 207-223. MESQUITA, J. A. y A. VIEIRA. 1979. Suero bovino tratado por PEG para el uso en cultivos de células. Boletín del Centro Panamericano de fiebre aftosa. 35-36:63-64. MISHRA, A. K., G CLABAUGH and I. KAKOMA. 1992. Human serum for in vitro cultivation of Babesia bovis. Veterinary Parasitology. 45:153-156. MISHRA, A. K., G CLABAUGH, I. KAKOMA and M. RISTIC. 1991. Goat serum, a substitute ofbovine serum in cultivation of Babesia bovis. In: Servicio de información bibliográfico sobre hemoparásitos de la Red de Cooperación Técnica entre Laboratorios de Investigación Diagnóstico Veterinario. FAO. Marzo-Junio 1992. Acta Vet. Hungary. 39( 1-2):25-28. MONROY, M., G ROMERO, R. ABOYTES, J. A. ÁLVAREZ, G. J. CANTO Y C. A. VEGA. 1987. Establecimiento en México del cultivo in vitro de Babesia bigemina. Téc. Peco Méx. 25(2): 141-150. MOYAO, F. A. 1989. Preparación del medio de cultivo completo. In: Curso internacional "Cultivo in vitro de especies de Babesia". Instituto Nacional de Investigaciones Forestales y Agropecuarias (INIFAP). Centro Nacional de Investigaciones Disciplinarias en Macrobiología (CENID). Jiutepec. Estado de Morelos, México. Mimeo. s/n. NEVES, L., H. F. CROSS, L. LOUREIRO, A. AKCA, M. HOMMEL and A. J. TREES. 2001. Addition of hypoxanthine to culture media allows in vitro cultivation of Babesia bovis and Babesia bigemina at reduced serum concentrations. Parasitology 123:357-363. PALMER, D. A., G. M. BUENING and C. A. CARSON. 1981. Cultivation of Babesia bovis in vitro. Proccedings. In: 7th National Anaplasmosis Conference. Mississippi State University. 207-217. RODRÍGUEZ, S. D. 1989. Por qué cultivar Babesia spp. In: Curso internacional "Cultivo in vitro de especies de Babesia". Instituto Nacional de Investigaciones Forestales y Agropecuarias (INIFAP). Centro Nacional de Investigaciones Disciplinarias en Macrobiología (CENID). Jiutepec. Estado de Morelos, México. Mimeo. s/n. RODRÍGUEZ, S. D., R. ABOYTES, J. V. FIGUEROA and C. VEGA. 1994. Bovine babesiosis: a review of recent advances. Arch. Med. Res. 25(2):241-245. RODRÍGUEZ, S. D., G M. BUENING, T. J. GREEN and C. ANDREW. 1983. Cloning of Babesia bovis by in vitro cultivation. Infection and inmunity. 42( 1): 15-18. SOKAL, R. and F. ROHLF. 1979. Biometría. Madrid. H. Blume Ediciones. 832 pp. SCHUSTER, F. 2002. Cultivation of Babesia and Babesia- like blood parasites: agents of an emerging zoonotic disease. Clinical Microbiology Reviews. 15(3):365-373. TIMMS, P. 1980. Short term cultivation of Babesia especies. Research in Veterinary Science. 29: 102-104. TRAGER, W. and J. B. JENSEN. 1976. Human malaria parasites in continous culture. Science. 193.673-675. VEGA, C. A., G. M. BUENING, T. J. GREEN and C. A. CARSON. 1985. In vitro cultivation of Babesia bigemina. American Joumal of Veterinary Research. 46(2):416-420. VISVESVARA, S. G and L. S. GARCÍA. 2002. Guest Cornmentary. Culture of Protozoan Parasites. Clinical Microbiology Reviews. 15(3):327-328. YUNKER, C. E., K. L. KUTTLER and L. W. JOHNSON. 1987. Atenuation of Babesia bovis by in vitro cultivation. Veterinary Parasitology.24:7-13. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||