|
Veterinaria Tropical > Colección > Sumario > Volumen 28 > Articulo |
Veterinaria Trop. 28(1): 63-77. 2003 AISLAMIENTO E IDENTIFICACIÓN DE TRES CEPAS NEFROPATÓGENAS DEL VIRUS DE BRONQUITIS INFECCIOSA AVIAR EN LA REGIÓN CENTRAL DE VENEZUELA Mariela Brett*, Carmen de Noguera*, Carlos
Quiroz*, Morela de Rolo*, *Investigadores y **Técnicos Asociados a la
Investigación. Recibido: mayo 17,2004. |
||||||||
|
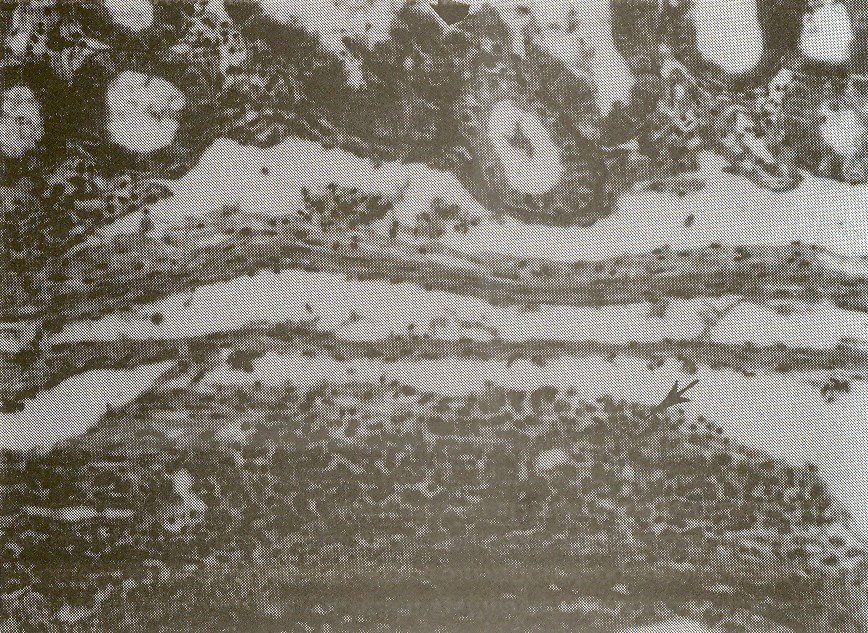
RESUMEN Se realizó un estudio para aislar e identificar cepas del virus de bronquitis infecciosa aviar (BIA) en pollos de engorde en la región central de Venezuela. Se muestrearon 21 granjas en los estados Aragua, Carabobo, Miranda y Cojedes: En 57,1 % de las granjas, las aves se vacunaron contra la enfermedad, utilizando la cepa M-120 al primer día de edad. Todas las aves estudiadas mostraron enfermedad clínica respiratoria, pero sólo tres casos (06, 6228, 6328), evidenciaron también enfermedad renal. En el estudio histopatológico las aves correspondiente a estos casos presentaron lesiones severas en riñones y lesiones menos consistentes en tracto respiratorio. En 57% de los 21 casos analizados, se aisló el virus de BIA, mediante la técnica en huevos embrionados libres de anticuerpos específicos. La caracterización genómica se realizó mediante la prueba de Transcriptasa Reversa-Reacción en cadena de la Polimerasa- y el análisis del Polimorfismo de la Longitud de los Fragmentos de Restricción (RT-PCR-RFLP, siglas en inglés). Las cepas 6228 y 6328 correspondieron al nuevo serotipo (Variante genotípica), y la cepa 06 correspondió al serotipo Massachussets. Palabras Clave: Bronquitis; coronavirus; nefropatógena; serotipo; rt-pcr-rflp. INTRODUCCIÓN La bronquitis infecciosa aviar (BIA) es una enfermedad viral altamente contagiosa, producida por un miembro de la familia Coronaviridae, perteneciente al género Coronavirus. El genoma es un ARN de cadena simple en sentido positivo y en su superficie contiene proyecciones formadas por la glucoproteína de espiga grande (S), dividida post-traduccional en dos subunidades: S1 y S2 (Cavanagh et al., 1992; Kwon y Jackwood, 1995; Sapats et al., 1996; Shi et al., 2000; Kingham et al., 2000; Lee et al., 2001). El virus afecta el sistema respiratorio y urogenital en pollos, ponedoras y reproductora,s (Criñion et al., 1970; Kinde et al., 1991; Wang et al., 1996; Di Fabio et al., 2000). La BIA se considera una de las principales enfermedades virales que causa pérdidas económicas significativas a la industria avícola mundial, debido a la baja ganancia de peso, disminución de la postura, baja fertilidad y decomisos en plantas procesadoras (Criñion et al., 1970; Gelb et al., 1991; Cavanagh y Naqi, 1997). La enfermedad tiene una morbilidad alta, 100% en la mayoría de los casos; pero la mortalidad frecuentemente es baja (5%), ésta aumenta cuando actúan cepas nefropatógenas (Fulton et al., 1993; Wang et al., 1996; Ziegler et al., 2002; Zanella et al., 2003) o cuando se presenta complicada con otros agentes patógenos como Escherichia coli, micoplasmas y otros virus (Goryo et al., 1984; Avellaneda et al., 1994; Naqi et al., 2001). La enfermedad renal se observó por primera vez en 1960 (Cavanagh y Naqi, 1997), aislándose cepas nefropatógenas en todo el mundo. Estas cepas varían en patogenicidad, por ejemplo, en Australia la cepa T es altamente patógena y virulenta (Fulton et al., 1993); en Italia Zanella et al., (2003) mencionan cepas relacionadas con un serotipo (AZ 23/74), causando daños moderados y severos particularmente en pollos de engorde; sin embargo, las cepas Holte y Gray han sido reconocidas en EE.UU. con una patogenicidad baja (Mcdonald y McMartin, 1976); aunque recientemente estudios realizados por Ziegler et al., (2002) demostraron la presencia en Pensilvania de dos genotipos únicos del virus (PA/Wolgemuth/98 y PA/171/99), causantes de lesiones severas en pollos de engorde, ponedoras y reproductoras de todas las edades. A pesar del uso regular de vacunas con virus atenuados e inactivados para controlar la enfermedad, ésta continúa afectando planteles avícolas, debido a que algunos serotipos no proporcionan inmunidad cruzada adecuada contra serotipos no relacionados ni contra cepas variantes, incluso contra serotipos relacionados (Erbeck y McMurray, 1998). El efecto de la enfermedad renal depende de la virulencia de la cepa, la edad, estado inmune del ave y el manejo de la granja. Esta condición puede ser exacerbada por varios. factores relacionados con el estrés por frío, dietas altas en proteína animal o calcio Curnming (1969), o cuando la BIA está asociada con enfermedades inmunodepresoras como enfermedad infecciosa de la bursa (Goryo et al., 1984; Ziegler et al., 2002). Se ha observado que el virus podría modificar su tropismo, dependiendo de la ruta de penetración al huésped (Uenaka et al., 1998; Ziegler et al., 2002; Zanella et al., 2003), por lo que el serotipo Massachussets (Mass), en la mayoría de los brotes, produce enfermedad respiratoria; aunque algunas cepas como la Mass-Holland, perteneciente al mismo serotipo, es nefropatógena (MacDonald y MacMartin, 1976). Otras investigaciones, basadas en biología molecular, sugieren que cambios en la secuencia de aminoácidos del genoma del virus, podría afectar el tropismo del mismo (Kwon y Jackwood, 1995; Sapats et al., 1996). El tropismo por el tejido renal se ha observado en serotipos desconocidos y cepas variantes generalmente (El-Houadfi et al., 1986; Wang et al., 1996; Sapats et al., 1996; Ziegler et al., 2002; Zanella et al., 2003). El virus de BIA es uno de los genéticamente más inestables, durante su replicación se producen seis ARN mensajeros por un mecanismo de transcripción discontinua (virus anidado), pudiendo ocurrir nuevas recombinaciones (Cavanagh y Naqi, 1997). Esto sugiere que la población de virus de BIA está en un estado de cambio continuo en su genoma, específicamente en la región hipervariable del gen que codifica la porción S 1 de la proteína de espiga (S), y son los que dan lugar a nuevos serotipos (Cavanagh et al., 1992; Jackwood y Jackwood, 1998; Shi et al., 2000; Kingham et al., 2000; Lee et al., 2001). Esto podría ser consecuencia de: presión inmunológica por el amplio uso de vacunas, infecciones mixtas (varios serotipos) o disminución del serotipo dominante (Lee et al., 2001; Zanella et al., 2003). Las variaciones genéticas y antigénicas son observadas en todo el mundo (Nix et al., 2000; Di Fabio et al., 2000; Shi et al., 2000; Lee et al., 2001; lia et al., 2002). En Venezuela estudios realizados por Brett et al., (2001) aislaron el virus de BIA perteneciente a un genotipo no conocido (variante genotípica), cuyo patrón de la técnica de Polimorfismo en la Longitud de los Fragmentos de Restricción (RFLP, siglas en inglés), no correspondió con el serotipo Mass, ni con otro serotipo conocido. El objetivo de este estudio fue aislar e identificar cepas nefropatógenas del virus de BIA en planteles avícolas, específicamente de pollos de engorde, ubicadas en la región central de Venezuela. MATERIALES Y MÉTODOS Muestra. Se seleccionaron de 4 a 6 aves en 21 granjas avícolas comerciales, de pollas de engorde, ubicadas en diferentes municipios de los estados Aragua, Carabobo, Miranda y Cojedes, para un total de 21 muestras analizadas. En estas granjas las aves presentaron cuadros respiratorios compatibles con BIA. Histología. La tráquea, pulmón y riñón de todas las aves fueron removidas durante la necropsia, y se fijaron con formol amortiguado a 10%, procesándose mediante la técnica descrita en el manual de técnicas histopatológicas y tinciones especiales, y teñidas con Hematoxilina Eosina, H&E (Armed Forces Institute of Pathology, 1960). Las muestras fueron observadas en un microscopio óptico a 40 y 100X. El aislamiento viral se realizó en huevos embrionados de 9 a 11 días de edad, libres de anticuerpos específicos contra BIA. El inóculo se preparó a partir del macerado de tráquea, pulmón, riñón y tonsilas cecales de las aves que, en la necropsia, presentaron lesiones compatibles con BIA (21 muestras). Las muestras se procesaron según la técnica descrita por Gelb y Jackwood (1998). Aislamiento del RNA. Se realizó mediante la técnica de extracción con Trizol Ls (Gibco BRL, NY), modificada (Wang et al., 1999). La modificación se basó en el uso de 5 μl de oligo (dT) cellulose (Gibco BRL, NY), con el fin de purificar el ARN. La técnica se explica: el RNA viral se obtuvo a partir de fluido alantoideo, en un tubo de centrifuga de 1,5 ml, se colocó 0,25 mi de fluido alantoideo, agregándose 0,75 ml de TRIzol ls. La muestra fue incubada a temperatura ambiente por 5 min, adicionando 0,2 mi de cloroformo (CHC13), e incubándose a temperatura ambiente por 10 min, se centrifugó a 12000 r.p.m., por 15 min, la capa superior, fue transferida a un nuevo tubo añadiéndose 5μl de oligo(dT) cellulose y 0,5 mI de alcohol isopropílico, se incubó a temperatura ambiente por 10 min, centrifugándose a 12 000 r. p.m. a 4 °C por 10 min para la formación de un precipitado compacto (pellet), éste fue lavado con 1 mI de alcohol al 75%, centrifugado a 9 000 r.p.m., por 5 min y resuspendido, en 50 μl de agua ultra pura, tratada con dietil pirocarbonato, obteniéndose de esta manera el RNA purificado el cual se mantuvo en congelación a -30°C hasta el momento de ser usado para la RT-PCR. RT-PCR-RFLP. Se realizó siguiendo el procedimiento de Kwon et al., (1993). Los iniciadores (primers, en inglés) utilizados (S1oligo5’ y S1oligo3’) fueron diseñados y sintetizados en la Universidad de Georgia (Molecular Genetics Facility) EE. UD., a una concentración final de 0,5 ng/ml). Para la proteína N se utilizó el código y la secuencia siguiente: NIBVPCR. 5’ TGG CAC CGC TAC CTI CAAACTTGG GCG G 3’. Para la proteína M: MIBVPCR 5’ TAA GTC TIC AGT GGC TTG CTAAGT GTG AAC C 3’. Para la proteína SI: SIOLIG05’: TGA AAC TGA ACA AAA GAC y SI OLIG03’: CAT AAC TAA CAT AAG GGC AA. La RT-PCR se realizó utilizando el kit TitanR (One Tube RT-PCR system, Boehringer Mannheim), y fue conducido en un termociclador Gene Amp PCR System 9600 y 2400 de Perkin Elmer, con el fin de amplificar los genes que codifican las proteínas estructurales del virus (N/M y S1), realizándose dos PCR individuales para N/M y S1, respectivamente. La transcripción reversa (RT) se realizó por 1 h a 50°C. La amplificación fue realizada en 35 ciclos continuos de tres fases: desnaturalización a 94°C x 30 seg. La unión de los primers a 55°C x 30 seg, y polimerización a 68°C x 1,5 mino Como control positivo se utilizó el serotipo Mass y como negativo no se agregó ARN. El producto de esta amplificación fue corrido por electroforesis sobre un gel de agarosa al 1 %, Y observado en un transiluminador de luz ultravioleta. Para el RFLP se utilizó el producto amplificado por PCR de la proteína S1, cortado por tres enzimas: BestY-I, Hae-III y Xcm-I. El producto de esta restricción se separó por electroforesis sobre un gel de agarosa a 2%, observado a través de luz ultravioleta para evidenciar y comparar con patrones de referencia del virus de BIA (Arkansas, Connecticut, JMK, Mass). RESULTADOS Y DISCUSIÓN Hallazgos de. necropsia: Todas las aves mostraron en el sistema respiratorio tráqueas con secreción que iban de clara transparente a catarral; en un caso se observó la traquea con congestión y secreción hemorrágica de grado moderado. En pulmones se observaron seis casos con focos neumónicos y sacos aéreos turbios. En el sistema renal se observó en tres muestras, aumento de volumen del riñón de grado severo (06, 6228 Y 6328). Respecto al intestino en todos los casos mostraron las tonsilas cecales con hemorragia leve. En otros órganos, en tres casos hubo pericarditis, perihepatitis y peritonitis. Histopatología: Las lesiones más consistentes en la tráquea fueron edema de la mucosa, degeneración del epitelio con pérdida moderada de cilios, en algunas zonas se observó hipertrofia e hiperplasia glandular de moderada a severa, se observó la formación de agregados linfoides, algunas zonas del epitelio presentaron células planas dando apariencia de metaplasia escamosa. La lámina propia mostró edema moderado con infiltrado de tipo linfocítico predominante, también se observaron heterofilos y células plasmáticas. En el caso de las muestras 6228 y 6328 las lesiones fueron leves, caracterizadas por edema de la mucosa, pérdida parcial de cilios y congestión. En el pulmón se observaron regiones con congestión hemorrágica leve, infiltrado linfocítico y heterofilico leve en el intersticio. La muestra 6228 presentó un proceso inflamatorio difuso denominado neumonía intersticial leve con infiltrado inflamatorio linfocitario. Las muestras 06, 6228 y 6328 de los riñones, presentaron lesiones caracterizadas por nefritis intersticial severa con focos hemorrágicos y congestión, infiltrado mixto de tipo linfocítico principalmente, con heterófilos y algunas células plasmáticas (Figura 1).
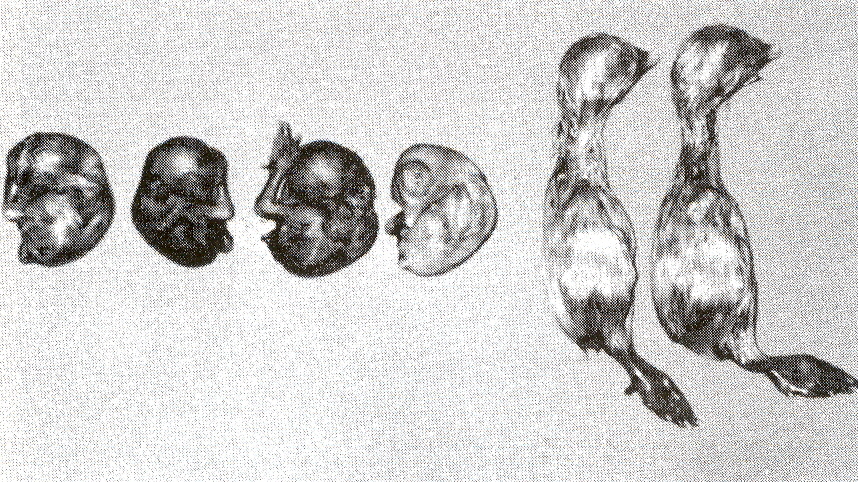
Los túbulos se observaron dilatados, con cambios degenerativos hasta necrosis y pérdida de alguno de ellos (Figuras 1,2 y 3), se aprecia un material eosinofílico intatubular, aparentemente formando uratos (Figuras 2 y 3). En el glomérulo se observó necrosis y atrofia con adelgazamiento de la cápsula de Bowman. Se observó degeneración hidrópica severa en algunas áreas y hemorragia (Figura 2). No se observó fibrosis. De un total de 21 muestras analizadas en el aislamiento viral, 12 aislados, corresponden a 57%, mostraron lesiones en embriones compatibles con las producidas por el virus de BIA, éstas consistieron en mal emplume, enanismo, encorvamiento, deformación de patas (Figura 4), en 9 muestras los embriones mostraron depósito de material blanquecino en uréteres y en riñones. En todas las muestras se necesitaron no menos de 2 pasajes ciegos para observar lesiones en embrión, lo que es característico de las cepas de campo. En 2 muestras, además del virus de BIA, se aisló el virus de la enfermedad infecciosa de la bursa (6228 y 6246).
La caracterización genómica en todas las muestras con aislamiento viral se amplificó el gen que codifica las proteínas N, M y S1 del virus de BIA. De las cepas que mostraron lesión renal, los patrones de RFLP determinaron que la cepa 06 pertenece al serotipo Mass y las cepas 6228 y 6328 al nuevo serotipo o "variante genotípica" aislado en el país por Brett et al., (2001). En Venezuela las pérdidas ocasionadas por BIA a la industria avícola aún no han sido cuantificadas, siendo ésta, una de las patologías más comunes en los planteles avícolas y poco diagnosticada, esto posiblemente se deba a que la enfermedad puede presentarse en forma leve, y sólo se observan los signos clínicos consistentes cuando el cuadro se complica con agentes bacterianos generalmente (Erbeck y McMurray, 1998), lo que conlleva a un diagnóstico errado. En el estudio se aisló el virus de BIA en 57% de las muestras analizadas, lo que sugiere que el virus tiene una alta circulación en esta región.
Las lesiones histopatológicas observadas en el aparato respiratorio concuerdan con los resultados obtenidos por Purcell et al., (1976); Fulton et al. (1993); Ziegler et al., (2002) entre otros, estos autores señalan que todas las cepas estudiadas produjeron lesiones leves y moderadas, especialmente en tráquea, los cuales consistieron en daño al epitelio traqueal e infiltración de la lámina propia; siendo los daños en pulmón menos consistentes. Las cepas 6228 y 6328, que en la necropsia presentaron lesión severa renal en las aves, produjeron lesiones leves en el tracto respiratorio, lo que concuerda con otros estudios (El-Houadfi et al., 1986; Fulton et al., 1993; Wang et al., 1996; Ziegler et al., 2002). Por otra parte, la cepa 06, que en la necropsia también presentó lesión renal, causó lesiones moderadas en tráquea, en lo que podría considerarse las condiciones ambientales, sanitarias, correspondiente a la carga de microorganismo s patógenos presentes, capaces de exacerbar la enfermedad, o ser una característica per se de está cepa.
Las lesiones en riñón se presentaron en forma severa sólo en tres cepas, correspondientes a la cepa 06 del serotipo Mass y las cepas 6228 y 6328 del nuevo geno tipo observado en Brett et al., (2001). Estudios de Fulton et al., (1993) señalan que las lesiones en riñón producidas por la cepa M-41 del serotipo Mass son mínimas, lo que difiere con los resultados de la cepa 06 del mismo serotipo en este estudio, ya que ésta produjo lesiones severas en el riñón. Los hallazgos descritos coinciden con estudios de otros investigadores, quienes señalan que la cepa M-41, puede causar a baja incidencia lesiones severas en el riñón (Chong et al., y Siller, citados por Fulton et al., 1993), en adición, estudios de El-Houadfi et al., (1986) demuestran que una cepa altamente relacionada, antigénicamente, con el serotipo Mass produjo lesiones de moderadas a severas en el riñón de las aves. La variación genética del virus de BIA posiblemente esté relacionada con el tropismo del mismo, aunque ésta, todavía, no halla sido comprobada cabalmente. En este estudio, el hecho de que las cepas 6228 y 6328 (nefropatógenas), pertenecientes a un nuevo genotipo, concuerda con otras investigaciones (El-Houadfi et al., 1986; Fulton et al., 1993; Wang et al., 1996; Ziegler et al., 2002; Zanella et al., 2003), en ese mismo aspecto, difiere con investigaciones de Sapats et al., (1996) los que aislan un grupo de cepas pertenecientes a un nuevo genotipo y que son causantes de lesiones sólo en el tracto respiratorio. La naturaleza de los Coronavirus aviares de ser genéticamente inestables, induce a una gran diversidad antigénica, lo que conlleva a la aparición de nuevos serotipos causantes de enfermedad, que pudieran igualmente, variar su patogenicidad y tropismo, lo que facilita de esta manera, confundir el diagnóstico clínico con otras enfermedades como lo son la enfermedad infecciosa de la bursa, nefritis infecciosa, micotoxicosis, entre otras, en consecuenria la determinación rápida y exacta del genotipo de cepas de campo, es un factor importante para controlar BIA a través de acertados programas de vacunación; ya que el virus posee un mecanismo adaptable a la presión selectiva inmune (Sapats et al., 1996; Gelb et al., 1997; Keeler et al., 1998; Jackwood, 1999), que pudiera estar asociado con programas intensivos de vacunación y prácticas de manejo inadecuadas, como resultado, muchos serotipos seguirán apareciendo y causar grandes pérdidas económicas a la industria avícola mundial. AGRADECIMIENTO Especialmente al Dr. Víctor Bermúdez (UCV-FCV), por la asesoría en el estudio histopatológico y al Dr. Ben Amy Yufa (UCV-FCV). SUMMARY A study was conducted in order to isolate and identify strains of avian infectious bronchitis virus in broiler chickens in the Venezuelan central region. Twenty one chicken farms in Aragua, Carabobo, Miranda and Cojedes States were sampled. Birds were vaccinated against the disease using the M-l20 strain on day one ofage in 57.1% ofthe farms. All the studied birds showed clinical respiratory disease, but three cases (06, 6228, 6328), displayed renal disease as well. Histopathological study of these particular cases, revealed severe lesions in kidneys and slight lesions in the respiratory tract. In 57% ofthe 21 studied cases, avian infectious bronchitis virus (IBV) was isolated using embryonated specific antibody free chicken eggs. Genomic characterization was performed by Reverse Transcription- Polymerase Chain Reaction test and -Restriction Fragment Length analysis (RT-PCR-RFLP). Strains 6228 and 6328 corresponded to a new serotype, while strain 06 corresp9nded to Massachusetts serotype. Key Words: bronchitis, Coronavirus, nephrophatogenic, serotype, RTPCR-RFLP. BIBLIOGRAFÍA ARMED FORCES INSTITUTE OF PATHOLOGY. 1960. Routine staining procedure. In: Manual of Histology and special staining technique. Second edition, Ed. McGraw-Hill Book Company. Chapter 4. p. 25-32. AVELLANEDA, G E., P. VILLEGAS, M. W. JACKWOOD and D. J. KING 1994. In vivo evaluation ofthe pathogenicity offield iso1ates of infectious bronchitis virus. Avian Dis. 38:589-597. BRETT, M., C. NOGUERA, C. QUIRÓZ, M. ROLO, A. HERRERA, J. MARTÍNEZ y B. YUFA. 2001. Caracterización molecular de cepas del virus de la bronquitis infecciosa aviar aisladas en la región central de Venezuela. Veterinaria Trop. 26(1):15-23. CAVANAGH, D., P. DAVIS, J. COOK, D. LI, A. KANT and G KOCH. 1992. Location of the amino acids differences an the S1 spike glycoprotein subunit of closely re1ated serotypes of IBY. Avian Path. 21:33-43. CAVANAGH, D. and S. NAQI. 1997. Infectious Bronchitis. In: Diseases of Poultry, 10th ed. B. W Ca1nek, H. J. Bames, C. W. Beard, W. M. Reid and H. W. Yoder, eds. lowa State University. Press. Ames, IA. pp.511-526. CRIÑION, R. A. P., R. A. BALL and M. S. HOFSTAD. 1970. Pathogenesis of oviduct 1esions in immature chickens following exposure te infectious bronchitis virus at one day old. Avian Dis. J. 4:32-41. CUMMING, R. B. 1969. The control ofavian infectious bronchitis Virus Nephrosis in Australian. Austr. Vet. Jour. 45:200-203. DI FABIO, J., L. I. ROSSINI, S. J. ORBELL, G PAUL, M. B. HUGGINS, A. MALO, B. G M. SILVA and J. K. A. COOK. 2000. Characterization of infectious bronchitis viruses isolated from outbreaks in cornmercial flocks in Brazil. Avian Dis. 44:582-589. ERBECK, D. H. andB. L. McMURRAY. 1998. IsolationofGA Variant. (Georgia isolated 1992) Infectious Bronchitis Virus but not Omithobacterium rinotracheale from Kentucky broiler complex. Avian Dis. EL-HOUADFI, MD., R. C. JONES, J. K. A. COOK and A. G AMBALI. 1986. The isolation and characterization of six avian infectious bronchitis viruses isolated in Morocco. Avian Pat. 15:93-105. FULTON, R. M., W. M. REED and H. L. THACKER. 1993. Cellular response of the respiratory tract of chickens to infection with Massachusetts 41 and Australian T Infectious Bronchitis Viruses. Avian Dis.37:951-960. GELB, Jr., J. B WOLFF and C. MORAN. 1991. Variant Serotypes of Infectious Bronchitis Virus isolated from cornmerciallayer and broiler chickens. Avian Dis. 35:82-87. GELB, J .Jr, C. KEELER, W. NIX, J. ROSENBERGER and S. CLOUD. 1997. Antigenic and S-1 genomic characterization of the Delaware variant serotype of infectious bronchitis virus. Avian Dis. 41 :661-669. GELB, J. Jr. and M. W. JACKWOOD. 1998. Infectious Bronchitis In: A Laboratory Manual for the isolation and identification of avian pathogens. Fourth edition. Published by The American Association of Avian Pathologists. 169-174. GORYO, M., T. UMEMURA and C. ITAKURA. 1984. Concurrence of nephrosis-nephritis due to infectious bronchitis virus and infectious bursal disease in broiler chickens. Avian Pat. 13:191-200. JACKWOOD, D. and M. JACKWOOD. 1998. Molecular identification procedures In: A Laboratory Manual For the Isolation and Identification of Avian Pathogens. Fourth Edition. AAAP. 267-269. JACKWOOD, M. W. 1999. Advanced diagnostic techniques and new developments: Infectious bronchitis virus. Memorias del Mondial Vet. Lyon, France. 23-26. HA, WEI, S. P. MONDAL and S. A. NAQI. 2002. Genetic and antigenic diversity in avian infectious bronchitis virus isolates of the 1940s. KEELER, C. L. Jr, K. L. REED, W. A. NIX and J. Jr. GELB. 1998. Serotype identification of Avian Infectious Bronchitis Virus by RT-PCR of the peplomer (S-I) gene. Avian Dis. 42:275-284. KINDE, H., B. DAFT, A. CASTRO, A. BICKFORD, J. GELB Jr and REYNOLDS. 1991. Viral pathogenesis of a neprhotopic infectious bronchitis virus iso lated from cornmercial pullets. A vian Dis. 35:415-421. KINGHAM, B. F., C. L. KEELER Jr, W. A. NIX, B. S. LADMAN and J. GELB Jr. 2000. Identification of infectious bronchitis virus by direct automated cyc1e sequencing ofthe SI gene. Avian Dis. 44:325-335. KWON, H. M., M. W. JACKWOOD and J. GELB Jr. 1993. DifIerentiation ofInfectious Bronchitis Virus serotypes using polymerase chain reaction and restriction fragment length polymorphism analysis. Avian Dis. 37: 194-202. KWON, H. M. and M. W. JACKWOOD. 1995. Molecular c10ning and sequence comparison of the SI glycoprotein of the gray and JMK strains of avian infectious bronchitis virus. Virus Genes 9:3,219-229. LEE, C.W., D. A. HILT and M. JACKWOOD. 2001. Identification and analysis of the Georgia 98 serotype, a new serotype of infectious bronchitis virus. Avian Dis. 45:164-172. McDONALD, J. and D. McMARTIN. 1976. Observation on fue effects of the H52 and H120 vaccine strains of the IBV in the domestic fowl. Avian Pat.5:157-173. NAQI, S., G THOMPSON, R. RAUMAN and H. MOHAMMED. 2001. The Exacerbating effect of infectious bronchitis virus infection on the infectious bursal disease virus induced suppression of opsonization by Escherichia co/i antibody in chickens. Avian Dis. 45:52-62. NIX, W. A., D. S. TROEBER, B. F. KINGHAN, C. L. KEELER and J. GELB Jr. 2000. Emergence of subtype strain of the Arkansas serotype of infectious bronchitis virus in Delmarva broiler chickens. Avian Dis. 44:568-581. PURCELL, D. A., V. THAM and P. SURMAN.1976. Thehistopathology of infectious bronchitis in fowls infected with a nephrotropic T strain of virus. Aust. Vet. J. 52:85-91. SAPATS, S., F. ASHTON, P. WRIGTH and J. IGNJATOVIC. 1996. Sequence analysis of the S1 glycoprotein ofinfectious bronchitis virus: identification of a novel genotypic group in Australia. Jour of Gen. Virol. 77:413-418. SHI, Q., C. WANG and R. W. KEIRS. 2000. Genetic relationship of infectious bronchitis virus iso late s from Mississippi broilers. Avian Dis. 44:66-73. UENAKA, T.; T. KISHIMOTO, T. UEMURA, T. ITO, T. UMEMURA and K. OTSUKI. 1998. Cloacal inoculation with the Connecticut strain of avian infectious bronchitis virus: an attempt to produce nethropathogenic virus by in vivo passage using cloacal inoculation. J. Vet. Med. Sci. 60:495-502. VILLEGAS, PEDRO. 1998. Miscellaneous virology techniques in: Laboratory Manual Avian Virus Diseases (AVMD 8050). College of veterinary medicine. University ofGeorgia. p. 59. WANG, C. H., M. C. HSIEH and P. C. CHANG. 1996. Isolation, pathogenicity, and H-120 protection efficacy of Infectious Bronchitis Viruses isolated in Taiwan. Avian Dis. 40:620-625. WANG, C. H., B. MIGUEL; W. AUSTIN AND R. KEIRS. 1999. Comparison of the immunofluorescent assay and reverse transcription polymerase chain reaction to detect and type Infectious Bronchitis Virus. Avian Dis. 43:590-596. ZANELLA, A, A LAVAZZA, R. MARCHI, A MORENO MARTÍN and F. PAGANELLI. 2003. Avian infectious bronchitis: characterization ofnew isolate from Italy. Avian Dis. 47:180-185. ZIEGLER, A F., B. S. LADMAN, P. A. DUNN, A. SCHNEIDER, S. DAVISON, P. G MILLER, H. LU, D. WEINSTOCK, M. SALEM, R. J. ECKROADE and J. GELB Jr. 2002. Nepropathogenic infectious bronchitis in Pennsylvania chickens 1997-2000. Avian Dis. 46:847-858. |