|
Veterinaria Tropical > Colección > Sumario > Volumen 28 > Articulo |
Veterinaria Trop. 28(1):25-36. 2003 MODIFICACIÓN DE LA PRUEBA DE PRECIPITACIÓN CIRCUMOVAL PARA EL DIAGNÓSTICO INMUNOLÓGICO DE Fasciola hepatica Espartaco
Sandoval*, Gustavo Morales**, Delia
Jiménez***, Luz A. Pino** *Investigador. INIA. ****Investigadora. Recibido: abril 01,2004. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
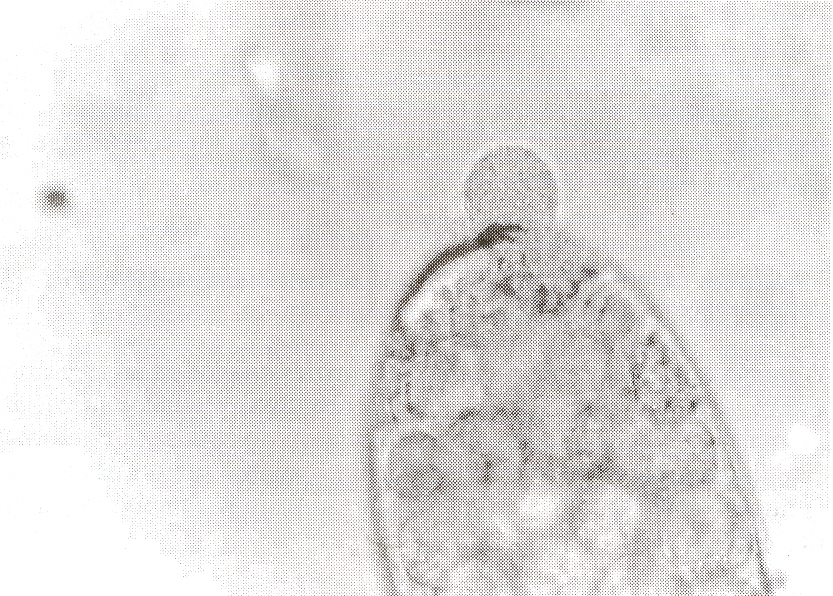
RESUMEN Con el objeto de adaptar la técnica de Precipitación Circumoval (PPCO) para el diagnóstico inmunológico de Fasciola hepatica, 100 muestras de sueros bovinos provenientes de un área con una prevalencia moderada al parásito, fueron retados con huevos de dicho parásito obtenidos mediante necropsia de un ovino positivo y sometidos a O, 8, 10 Y 12 días de incubación a 37°C. Los mejores resultados se obtuvieron cuando se emplearon huevos de F. hepatica incubados durante 10 d. Los resultados obtenidos con la PPCO fueron comparados con los resultados de la prueba coproparasitológica de sedimentación de Benedek, obteniéndose 75% de coincidencia entre ambas prue6as, no observándose diferencias estadísticamente significativas entre ambas técnicas parasitológicas. Los valores de sensibilidad, especificidad y valor predictivo fueron de 74%, 24% y 76%, respectivamente. Lo que permite proponer el uso de esta prueba, como una alternativa de bajo costo para el diagnóstico de esta parasitosis. Palabras Clave: Fasciola hepatica; prueba precipitación circumoval; diagnóstico; inmunológico; bovinos. INTRODUCCIÓN La distomatosis hepática es una afección parasitaria de amplia difusión mundial (Gaasenbeek et al., 2001) Y de particular importancia en la región centro-occidental de Venezuela (Morales et al., 1985). Es causada por el trematodo Fasciola hepatica, pudiendo afectar a diferentes especies de mamíferos domésticos tales como ovinos, caprinos, bovinos (Díaz, 1971) Y ocasionalmente a equinos (Yépez y Sánchez, 1981), mamíferos silvestres e incluso al hombre. Existen evidencias que señalan que esta patología provoca en bovinos, disminución en la producción de leche y carne, baja eficiencia reproductiva y retraso en el crecimiento (Chirinos y Chirinos, 1993; Oakley et al., 1979; Sinclair, 1972). A pesar de disponer en el país de un amplio número de antiparasitarios, la infección no parece ser controlada por esta vía, ya que el control también debe considerar estudios de los factores biológicos, climáticos y topográficos que favorezcan la presencia del parásito (Valenzuela, 1994). Esta situación señala la necesidad de contar con métodos de diagnóstico, que faciliten la realización de estudios, que contemplen la distribución, cuantificación y biología del parásito en las diferentes regiones del país, de manera que la información obtenida, represente el principal insumo para el diseño e implementación de programas de control. Los principales procedimientos diagnósticos empleados en nuestro medio, están basados en la búsqueda e identificación de los huevos del parásito, a través de exámenes coprológicos de sedimentación, los cuales resultan sencillos y de bajo costo, pero no totalmente eficientes al ser incapaces de detectar infecciones tempranas, cuando los parásitos son aún inmaduro s y no producen huevos, además de que cuando las infecciones son con bajas cargas parasitarias es frecuente dar como negativos a animales positivos. La detección precoz de la infección es vital para controlar y evitar la diseminación ambiental de los huevos del parásito, permitiendo inclusive instaurar tratamientos antes de la patencia de la enfermedad (Gorman et al., 2000) y de esta manera disminuir tanto los efectos detrimentales en el hospedador como la difusión de la enfermedad. En esta investigación se planteó la necesidad de mejorar las posibilidades de diagnóstico de F. hepática, a través de la adaptación de la Prueba de Precipitación Circumoval (PPCO) de amplio uso en Schistosomiasis mansoni (Incari et al., 1987) y comparar sus resultados con los de la prueba de sedimentación de Benedek (Nemescri y Hollo, 1965), técnica clásica en medicina veterinaria para el diagnóstico de la distomatosis hepática. MATERIALES Y MÉTODOS Para la realización de este ensayo, se tomó al azar una alícuota de 100 muestras (heces y sueros), de un total de 971 extraídas previamente de bovinos, ubicados en una unidad agroeco1ógica identificada con una moderada preva1ecia a F. hepatica. Con fines de diagnóstico copro1ógico, las heces fueron extraídas directamente del recto, empleando una bolsa plástica a manera de guante. Las mismas eran identificadas y refrigeradas hasta su procesamiento en el laboratorio por medio de la técnica de sedimentación de Benedek (Nemescri y Hollo, 1965). Para la obtención de los sueros sanguíneos se extrajo asépticamente de la vena yugular, sangre completa sin anticoagu1ante, dejándose reposar hasta la formación del coagulo, por su posterior centrifugación y conservación bajo congelación. Para la modificación de la PPCO (Incari et al., 1987) se seleccionaron 50 sueros de animales negativos a la prueba coproparasito1ógica de sedimentación y 50 positivos. Además, se emplearon 20 sueros de animales criados en un área libre de F. hepatica, para disponer de controles negativos, y con los sueros de 50 animales que coproscopicamente resultaron positivos, se conformó el lote de controles positivos; estos mismos sueros fueron usados como controles positivos y negativos. Posteriormente se inactivaron en baño de María, a 56°C x 30’. Obtención de los huevos de F. hepatica Los huevos de F. hepatica, fueron obtenidos por necropsia de un ovino infestado en condiciones naturales mediante la técnica preconizada por Euzeby (1982). Luego se procedió a su incubación a O, 8, 10 y 12 días en estufa a 37°C. Al final de cada período de incubación se realizaba una suspensión de huevos, la cual se diluía o se concentraba, según era el caso, hasta obtener una concentración de por lo menos 50 huevos maduros, por cada gota de pipeta Pasteur (aprox. 50 μl). Se procedió a colocar una gota de la suspensión en una lámina portaobjetos y dos del suero problema, mezclando con una pipeta Pasteur. Se colocó un cubre objeto y con un aplicador de madera fueron sellados los bordes de la lámina con una mezcla previamente calentada de parafina glicerina (v/v). Las láminas se colocaron en cámara húmeda y se guardaron en estufa a 37°C por 48 horas, posteriormente se observaron en un microscopio de luz a un aumento de 100x. Los huevos considerados positivos presentan un precipitado en su superficie (ver Figura).
La comparación de los resultados de la PPCO con diferentes tiempos de incubación de huevos frescos de F. hepatiea usados como antígeno y la comparación de los resultados de las dos técnicas, se efectuó por medio de la prueba de Kruskal Wallis. Para determinar si existían diferencias en el valor diagnóstico entre las técnicas, se empleó la prueba de comparación de dos proporciones de McNemar (Morales y Pino, 1995) y para el procesamiento estadístico de los datos se empleo el software Minitab, Inc. Release 13 (2000). El nivel preestablecido como nivel de significación en todos los análisis fue del 5%. RESULTADOS Y DISCUSIÓN Aunque las diferencias no son estadísticamente significativas, se observó que tanto desde el punto de vista cualitativo como cuantitativo, los mejores resultados se obtuvieron cuando se emplearon huevos de F. hepatiea con 10 días de incubación, tal como se observa en el Cuadro 1. En vista de estos resultados se decidió realizar la comparación con la prueba de sedimentación de Bennedek, empleando huevos de F. hepatiea, incubados por 10 días a 37 ºC, como antígenos en la PPCO.
La comparación de los resultados, clasificados como positivos y negativos entre las pruebas (Cuadro 2), refleja 38% y 37% de coincidencia entre animales negativos y positivos, respectivamente, a ambas pruebas, lo que da 75% de coincidencia general. En el sentido contrario, 13% de los animales resultaron negativos por coproscopia, pero, positivos a la PPCO, mientras que 12% resulta positivo a la coproscopia y negativo a la PPCO, lo que representa 25% de contradicción en la comparación de resultados.
La coincidencia de resultados es elevada, ya que independientemente, ambas pruebas detectan proporciones muy semejantes. Ante esta situación, se decidió realizar una prueba de comparación de dos proporciones de McNemar, para determinar si existen diferencias en el valor diagnóstico de estas pruebas. La prueba de sedimentación de Bennedek detectó 50% de los casos, mientras que la PPCO detecta 49% de los casos, no encontrándose diferencias estadísticamente significativas entre ambas pruebas. Los valores de sensibilidad, especificidad y valor predictivo, obtenidos en este estudio para esta prueba (PPCO) fueron de 74%, 24% Y 76%, respectivamente. Usualmente los métodos de diagnóstico directo a través de la identificación y contaje de los huevos del parásito, sólo son funcionales después del período de prepatencia de la enfermedad, de igual manera en estas etapas, infecciones leves (bajas cargas) pueden pasar desapercibidas y esos animales parasitados, pero, diagnosticados como negativos, pueden actuar como fuente de nuevas infecciones (Masake et al., 1978). Por otra parte, las pruebas coproparasitológicas a pesar de tener la ventaja de ser de bajo costo, tienen baja sensibilidad (Fredes et al., 1997). En este sentido, nuevas alternativas diagnósticas han surgido como es el caso de los métodos inmunológicos que detectan anticuerpo s, los que además de ser sensibles y específicos contra F. hepalica, permiten procesar un gran número de muestras en poco tiempo. Empleando estos métodos ha sido posible detectar el 100% de los infectados desde el 1,5 mes post infección (Pi), en animales experimentales, mientras que la coprología alcanza los mismos resultados a los tres meses pi (Gorman et al., 2000). Una de las grandes ventajas de estos métodos serológicos indirectos, es la capacidad de detectar IgG anti-F. hepatica desde la segunda semana pi, lo que representa un diagnóstico notablemente precoz de la enfermedad, sin embargo, la presencia de anticuerpo s no es indicativo de infecciones activas, ya que se ha demostrado que los títulos de anticuerpos pueden permanecer altos aún después del tratamiento del hospedador definitivo (Ibarra et al., 1998). Esa persistencia de anticuerpo s por largos períodos de tiempo, hace inapropiadas estas técnicas para la evaluación de quimioterapias (Castro et al., 2000; Rodríguez-Pérez y Hillyer, 1995). Otro procedimiento diagnóstico, pero inespecífico, es la medición de enzimas celulares tales como son las transaminasa glutámica oxalacética, la aspartato aminotransferasa y la sorbitol dehidrogenasa, cuyos niveles aumentan en el período prepatente de la infección, pudiendo dar una evidencia circunstancial y no específica sobre la presencia de F. hepatica (Ferre et al., 1994; Fredes et al., 1997). También se ha descrito como procedimiento diagnóstico inespecífico la medición de la respuesta inmune celular expresada por una eosinofilia periferica (Hillyer, 1993). Se ha demostrado que los mayores daños provocados por F. hepatica, ocurren durante su migración a través de la cavidad peritoneal y parénquima hepático. Durante esta fase migratoria de la infección, los antígenos están disponibles para el sistema inmune y son detectados por pruebas serológicas indirectas, pero, una vez que los parásitos se establecen en los conductos biliares la disponibilidad de estos disminuye y su detección debe ser directa en muestras de heces o bilis (Sánchez Andrade et al., 2000). La detección de antígenos circulantes en el suero, bilis o heces es de gran valor porque puede indicar infecciones activas recientes, lo cual puede reducir el efecto ditrimental del parásito, así como el progreso y transmisión de la infección (Duménigo et al., 1999). Pese al avance en los conocimientos epidemiológicos sobre fasciolosis y a la existencia de eficientes drogas para su tratamiento (Gaasenbeek et al., 2001), la distribución y prevalencia de la enfermedad en bovinos de diferentes regiones del país continua siendo alta. Es por esta razón que contar con un método de diagnóstico eficiente y oportuno constituye una herramienta fundamental para su control, al evitar que los parásitos puedan contaminar el hábitat de los caracoles hospedadores intermediarios con sus huevos. En este sentido, la PPCO cumple con los requisitos básicos de facilidad de implementación y escaso requerimiento de insumos y equipos, sin embargo, no resulta ser una prueba de rápida ejecución, además de presentar durante este estudio una moderada sensibilidad y una baja especificidad, en relación con otras pruebas inmunológicas como las diferentes modalidades de la técnica de ELISA. Sin embargo, al comparar la eficiencia en la detección de casos entre esta prueba (PPCO) y el examen coproparásitario con animales en fase patente de la infestación, no se encontraron diferencias, de ahí que sea necesario realizar ensayos con animales inoculados experimentalmente con la finalidad de evaluar su eficacia en infestaciones en fase pre-patente, en vista de la importancia de esta información para el desarrollo de estrategias de control de esta parasitosis (Morales y Pino, 2002). Un aspecto que pudiese estar influenciando estos resultados, se corresponde con los niveles de carga parasitaria, la cual resultó moderada en este estudio, lo que a su vez determinaría un bajo nivel de anticuerpos, ya que se ha observado que animales con mayor carga parasitaria tienden a presentar altos niveles de absorbancia en las pruebas colorimétricas (Gorman et al., 1998). Las infecciones experimentales generalmente administran un número significativo de metacercarias por animal (400->1000), lo que implicaría un estímulo antigénico con un reconocimiento inmune más potente (Gorman et al., 1995, 2000), respecto a lo que ocurriría en forma natural, como en el caso del presente estudio, donde las infecciones se producen gradualmente en el tiempo. Otra desventaja ha observarse en estos resultados, es la utilización de huevos crudos, condiciones de trabajo que podrían presentar una infinidad de epitopos, algunos compartidos con otros vermes y otros que ofrecerían reacciones inespecíficas, indicando que la pureza de los determinantes antigénicos puede ser esencial en el rendimiento de la prueba (Fredes et al., 1997). La PPCO a sido empleada con éxito en el diagnóstico de Schistosoma mansoni en humanos (Matinella, 2001), por lo que deben considerarse estos resultados como una primera aproximación de su adaptación para su uso en el diagnóstico de F. hepatica, presentándose como una alternativa de bajo costo ante técnicas sofisticadas que requieren mayor equipamiento y consumo de costosos insumos, tales como ELISA, IDR y WESTERN BLOT. CONCLUSIÓN
SUMMARY In order to improve the diagnosis of Fasciola hepatica infection, the precipitins circumoval test (PCT) was modified and adapted. One hundred samples of bovine sera coming from an area with moderate distomatosis prevalence were taken under aseptic conditions. Sera were challenged with eggs of F. hepatica obtained by means of autopsy from a positive sheep infected under natural conditions. Eggs were submitted to 0, 8, 10 and 12 days of incubation at 37 ºC. Best results were obtained when eggs of F. hepatica with 10 days of incubation were used. The statistical comparison between the PCT and the coproparasitological sedimentation test results was not significant. Sensibility, specificity and predictive values were respectively 74%, 24% and 76%. These results allow us to propose the use of PCT as a low cost alternative for the diagnosis ofliver fluke disease. Key Words: Fasciola hepatic; precipitins circumoval test; diagnosis; inmunologic; bovine. BIBLIOGRAFÍA CASTRO, E., A. FREYRE and Z. HERNÁNDEZ. 2000. Serological responses of cattle after treatment and during natural re-infection with Fasciola hepatica, as measured with a dot-ELISA system. Veterinary Parasitology. 90(3):201-208. CHIRINOS, A. y N. de CHIRINOS. 1993. Evaluación de los efectos de la distomatosis hepática bovina sobre la eficiencia reproductiva y producción lechera. Revista Científica. 3(1):35-45. DÍAZ, C. 1971 Parasitología de los animales domésticos. Universidad del Zulia. 1:830-838. DUMÉNIGO, B., A. ESPINO, C. FINLAY and M. MEZO. 1999. Kinetics of antibody-based antigen detection in serum and faeces of sheep experimentally infected with Fasciola hepatica. Veterinary Parasito1ogy. 86(1):23-31. EUZEBY, J. 1982. Diagnostic experimental des helminthoses animales. Tome 2. Informations Techniques des Services Vetérinaires. Ministere de l’Agriculture, París. 364 pp. FERRE, Y., J. BARRIO, J. GONZÁLES and F. ROJO. 1994. Appetite depresión in sheep experimentally infected with Fasciola hepatica. Veterinary Parasitology. 55(1):71-79. FREDES, F., C. SÁNCHEZ, T. GORMAN y H. ALCAINO. 2001. Purificación de antígenos de Fasciola hepatica mediante electroelución y su aplicación inmunodiagnóstica mediante Western Blot en la infección animal. Parasitología al Día. 25(1-2):19-23. FREDES, F., T. GORMAN, M. SILVA y H. ALCAINO. 1997. Evaluación diagnóstica de fracciones cromatográficas de Fasciola hepatica mediante Western Blot y ELISA en animales infectados. Archivos de Medicina Veterinaria. 29(2):283-294. GAASENBEEK, C., L. MOLL, J. CORNELISSEN, P. VELLEMA and F. BORGSTEEDE. 2001. An experimental study on triclabendazole resistance of Fasciola hepatica in sheep. Veterinary Parasitology. 95(1):37-43. GORMAN, T., C. LÓPEZ, F. FREDES y H. ALCAINO. 2000. Monitoreo inmunológico del éxito terapéutico en fasciolosis empleando un antígeno semipurificado de <30KDA. Parasitología al día. 24( 1-2): 16-26. GORMAN, T., R. SÁNCHEZ, F. FREDES y H. ALCAINO: 1998.Inmunodiagnóstico de fasciolosis bovina mediante ELISA y Wester Blot. Parasitología al día. 22(1-2):16-24. GORMAN, T., A. VALDES y F. FREDES. 1995. Reconocimiento antigénico de ovinos naturalmente infectados con Fasciola hepatica, monitoreado a través de inmunoelectrotransferencia enzimatica (Westem Blotting). Archivos de Medicina Veterinaria. 27 (1):33-40. HILLYER, G. 1993. Serological diagnosis of Fasciola hepatica. Parasitología al Día. 17(3-4):130-136. IBARRA, F., N. MONTENEGRO, Y. VERA, CH. BOULARD, H. QUIROZ, J. FLORES and P. OCHOA. 1998. Comparison ofthree ELISA test for seroepidemiology of bovine fascioliosis. Veterinary Parasitology. 77(4):229-236. INCARI, R., O. NOYA, P. CHROCIECHOWSKI, C. BALZÁN, T. CAMEJO, M. MAZZARI y F. PUJOL. 1.987. Esquistosomiasis mansoni diagnóstico y control. Manual de campo y laboratorio. Caracas, Venezuela. Ed. Cesari, I.; Alarcon, B. Centro de Estudios Avanzados, Instituto Venezolano de Investigaciones Científicas. 194 p. MASAKE, R., R. WESCOTT, a SPENCER and R. LANG 1978. The pathogenesis of primary and secondary infection with F asciola hepatica in mice. Veterinary Pathology. 15:763-769. MATINELLA, L. 2001. Manual de normas y procedimientos del laboratorio malacológico Ministerio de Salud y Desarrollo Social. Maracay, Venezuela. p. 47-50. MINITAB. INC. 2000. Data analisis and quality tools. Release 13 for windowsAdobe Systems Incorporated .State College, Pensilvania, U.S.A. MORALES, G. y L. PINO. 1995. Parasitometria. Ed. Universidad de Carabobo. Valencia Venezuela. 224 p. MORALES, G., J. MORALES, A. CARREÑO, L. A. PINO y L. PERDOMO. 1985. Fasciolasis hepatica en bovinos del estado Trujillo, Venezuela. Boletín de la dirección de Malariología y Saneamiento Ambiental. 25(3-4):108-115. MORALES, G y L. A. PINO. 2002. Distomatosis hepatica bovina. Agroservicios 3(7):12-15. NEMESCRI, L. y L. HOLLO. 1965. Diagnóstico parasitológico veterinario. Editorial Acribia, España. 303 pp. OAKLEY, G. B. OWE and N. KNAPP. 1979. Production effects of subclinical liver, fluke infection in growing dairy heifers. Veterinary Record. 104:503-507. RODRÍGUEZ-PÉREZ, J. and G. HILLYER. 1995. Detection of excretory-secretory circulating antigens in sheep infected with Fasciola hepatica and Schistosoma mansoni and Fasciola hepatica. Veterinary Parasitology. 56(1):57 -66. SÁNCHEZ-ANDRADE, R., A. PAZ, J. SUÁREZ, R. PANADERO, P. DÍEZ, P. MORRONDO. 2000. Use of a sándwich-enzyme-linked immunosorbent assay (SEA) for the diagnosis of natural Fasciola hepatica infection in cattle from Galicia (NW Spain). Veterinary Parasitology. 93(1):39-46. SINCLAIR, K. 1972. The patogenecity of Fasciola hepatica in pregnant sheep. Brithis Veterinary Journal. 128:249-259. VALENZUELA, G. 1994. Terapéutica de distomatosis. Archivos Médicos Veterinarios. Suplemento 1:134-139. YÉPEZ, M. y J. SÁNCHEZ. 1981. Fasciola hepatica en un equino de Sanare - Venezuela. Veterinaria Tropical. 6(1):67-68. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||