|
Veterinaria Tropical 05: 43-50. 1980 RESULTADOS DE UN MUESTREO SOBRE TRIPANOSOMIASIS BOVINA MEDIANTE TÉCNICAS SEROLÓGICAS MANUEL TORO
BENITEZ*, EDGAR LEON ARENAS*, ROGER LOPEZ BOYER*, *FONAIAP |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
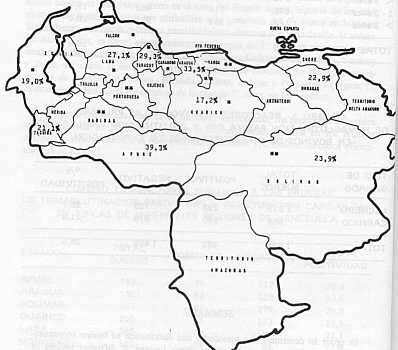
RESUMEN Con el objeto de determinar la prevalencia y distribución de la tripanosomiasis bovina en Venezuela, se analizaron mediante las técnicas de Hemaglutinación Pasiva (HP) y Aglutinación Capilar (AC) muestras séricas provenientes de fincas ubicadas en diferentes regiones geográficas del país. De 1884 muestras examinadas, 482 (25,5%) resultaron positivas. Los resultados mostraron que la infección tripanosómica está ampliamente difundida y que afecta a bovinos de diferentes edades, raza y tipo de explotación. INTRODUCCION La tripanosomiasis bovina es una enfermedad parasitaria crónica caracterizada clínicamente por caquexia progresiva, fiebre intermitente, anemia y trastornos de la locomoción. Su agente etiológico, el Trypanosoma vivax ZIEMANN (1905) fue señalado por primera vez en bovinos de Venezuela por TEJERA18 con el nombre de T. cazalboui Su morfología es muy similar a la del T. vivax africano y se ha sugerido que la especie suramericana, no transmisible cíclicamente, sea considerada como una sub-especie, T. vivax viennei LAVIER (1921)8. Posteriormente, otros investigadores informan sobre su presencia en caprinos2 y cérvidos6. KUBES9 describe la morfología del parásito y los síntomas clínicos de la enfermedad y FERNÁNDEZ 5 estudia una epizootia en bóvidos de los llanos. Sin embargo, las investigaciones realizadas hasta la fecha no aportan datos concisos sobre su epizootiología y, en consecuencia, no se dispone de datos precisos sobre la prevalencia y distribución de la tripanosomiasis bovina en Venezuela3. En este trabajo se presentan los resultados obtenidos en un muestreo realizado en fincas con bovinos de carne y leche, ubicadas en diferentes regiones geográficas del país, mediante la utilización de técnicas serológicas. MATERIALES Y METODOS Se utilizaron los sueros recolectados durante el lapso 1976-79, procedentes de bovinos de diferentes edades, raza y tipo de explotación. Las muestras procedían de un total de 39 fincas localizadas en los estados Apure, Aragua, Bolívar, Guárico, Lara, Monagas, Táchira, Yaracuy y Zulia, y se mantuvieron sin aditivos a -20 °C hasta el momento de su procesamiento mediante las técnicas de Hemaglutinación Pasiva (HP) y Aglutinación Capilar (AC). El antígeno utilizado en las técnicas señalada se preparó con tripanosomas provenientes de ratas infectadas experimentalmente con Trypanosoma evansi (= venezuelense) y obtenidos en forma pura mediante filtración a través de columnas de dietil-amino-etil-celulosa (DEAE)11 .Los tripanosomas lavados y compactados por centrifugación a 10000 g, durante 10 minutos, se resuspendieron en solución fosfatada glucosada buffer (PSG pH 8,0) y se trataron con ultrasonido a una intensidad de 90 W durante 5 minutos (Sonicador Bransom modelo B-12). El material sonicado se preservó en congelación a -20°C y se utilizó para recubrir eritrocitos ovinos previamente tratados con ácido tánico 1 :40000, los cuales se usaron resuspendidos al 1,5% en solución fosfatada buffer (PBS pH 7,4 ) como portadores pasivos (células antígeno) en la reacción HP . La prueba HP se realizó de acuerdo al método descrito para el diagnóstico de la tripanosomiasis equina7 modificada: se aplicó una microtecnia utilizando microplacas en "U", en las cuales los sueros inactivados, absorbidos y diluidos se pusieron en contacto con células antígeno y células controles. La reacción se mantuvo a temperatura ambiente y la lectura final se hizo a las 24 horas. En la preparación del antígeno capilaro-aglutinante16, el material sonicado se centrifugó a 90000 g durante 30 minutos a 4°C (ultracentrífuga Sorvall modelo OTD-2) y el sedimento se resuspendió en 2 a 3 volúmenes de solución buffer de veronal (VBS pH 7,2), se homogeneizó y preservó con 0,2% de formalina. La prueba AC se efectuó de acuerdo al método descrito para la anaplasmosis15, utilizando tubos capilares de 75 X 1,1 mm, en los cuales los sueros problemas inactivados a 56°C durante 30 minutos se pusieron en contacto con el antígeno en una proporción de 3:1. Los tubos sellados y en posición vertical se mantuvieron a temperatura ambiente y la lectura final, basada en la intensidad y cantidad de grumos de aglutinación presentes, se hizo a las 18 horas. Una evaluación previa de los métodos HP y AC demostró su especificidad en la detección de anticuerpos de Trypanosoma en los sueros de bovinos y ovinos infectados con T.vivax y/o T. evansi19. RESULTADOS Y DISCUSIÓN Los resultados del análisis de I 884 muestras de sueros bovinos, procedentes de fincas ubicadas en diferentes regiones geográficas del país, realizado mediante las técnicas HP (687 sueros) y AC (1197 sueros), se muestran en los Cuadros 1, 2 y 3. En el total de muestras examinadas, se observó un promedio de reactores positivos del 25,5 %, oscilando el porcentaje de bovinos infectados con Trypanosoma entre 17,2% (Estado Guárico) y 39,3% (Estado Apure) (Cuadro 1 y Figura 1 ). En general, no se comprobó la existencia de zonas libres de reactores aunque en algunas fincas ubicadas en los estados Bolívar, Guárico y Monagas todas las muestras resultaron negativas (125 sueros de explotaciones de carne ubicadas en Upata, San José de Guaribe y Maturín). En los diferentes grupos etarios examinados, se constató un 25,3%de bovinos reactores en el grupo de animales menores de un año; un 19,7% en bovinos de 1 a 3 años de edad y un 28, 7% en animales mayores de 3 años; observándose una diferencia significativa (d > 1,96; p = 0,05) entre el grupo de animales adultos y los grupos de bovinos menores de 3 años (Cuadro 2). La prevalencia de la infección en los diferentes tipos de explotación fue de 28,7 0/0 en fincas lecheras y de 21,8% en fincas destinadas a la producción de carne (Cuadro 3), siendo considerada la diferencia como significativa (d > 1,96; p=0,05). La tripanosomiasis bovina es una enfermedad conocida en Sur y Centro América desde el siglo pasado y su agente causal ha sido señalado en diferentes países del continentes1/4/9/12/13/14/17/18. Los resultados obtenidos en el muestreo serológico realizado indican que la infección tripanosómica está ampliamente diseminada en el país y que afecta indistintamente a los bovinos de diferentes grupos etarios, raza y tipo. Se utilizó la especie T. evansi para la preparación del antígeno no utilizado en el muestreo, dada la comunidad antigénica existente entre el T. evansi y el T. vivax , demostrada por la reacción serológica cruzada, observada en las pruebas HP y AC, en las cuales el antígeno preparado con T. evansi reaccionó con sueros provenientes de bovinos infectados con T. evansi y/o T. vivax19, y además, por la facilidad de manejo en condiciones de laboratorio (mantenimiento en roedores, producción de altas parasitemias en ratas, filtrabilidad en columnas de celulosa). Así, en algunas zonas del país y particularmente en aquellas donde la tripanosomiasis equina es enzoótica, como es el caso del Estado Apure, algunas de las reacciones observadas podrían ser atribuídas a la presencia del T. evansi en bovinos. Sin embargo, mediante métodos parasitológicos directos y la inoculación de animales susceptibles, se logró el aislamiento de 6 cepas de T. vivax en muestras procedentes de fincas ubicadas en los estados Carabobo, Guárico, Falcón, Lara, Yaracuy y Zulia, así como la detección parasitológica de la infección en muestras provenientes de los estados Aragua, Miranda, Barinas, Bolívar y Portuguesa (Figura 1 ), lo cual parece indicar el predominio de la especie T. vivax en los bovinos. A pesar del escaso número de muestras examinadas, los resultados obtenidos son indicativos de la importancia de la tripanosomiasis bovina en los rebaños del país y señalan además la necesidad de desarrollar y/o evaluar métodos eficientes para su control.
SUMMARY In order to detennine fue prevalence and distribution of bovine trypanosomiasis in Venezuela, serum samples from fanns located at different regions of fue country were tested by fue Pasive Haemagglutination (HA) and Capillary Agglutination (CA) techniques. Out of 1,884 samples examined, 482 (25.5%) were positive reactors. Results showed fuat trypanosomal infection is widespread throughout fue country and that cattle of all ages, breeds and type of explotation are affected. BIBLIOGRAFÍA 1.- ADAMS, A. R. D. Trypanosomiasis in Stock of Mauritius. l. Trypanosoma vivax , a parasite of local stock. Ann. Trop. Med. Parasit., 29: 1, 1935. 2.. BORSOTTI, J. Comunicación personal, citado por DlAZ-UNGRIA en Parasitología Venezolana, Fundación La Salle de Ciencias Naturales (Editorial Sucre), Caracas, Vol. 1 Pág.305. 1960. 3.- CLARKSON, M. J.; Mc CABE,. W. H. S.; COLINA, H. E. Bovine Trypanosomiasis in Venezuela. Trans. R. Soc. Trop. Med. Hyg., 65: 257-258. 1971. 4.- FABRE, H.; BERNARD, M. Sur un nouveau foyer de Trypanosomiase Bovine observé a la Guadaloupe. Bull. Soc. Path. Exot., 19: 435-437. 1926. 5.- FERNANDEZ, A. J. Tripanosomiasis de los bovídeos de Venezuela. Gaceta Médica de Caracas, 38: 16. 1931. 6.- FIASSON, R.; MAYER, M.; PIFANO, F. El ciervo (Odoicoileus gymnotis) portador de T. vivax en Venezuela. Rev. Grancolombiana de Zootecnia, Higiene y Medicina Veterinaria., 2: 944-946. 1948. 7.- GILL, B. S. A procedure for the Indirect Haemagglutination test for the study of experimental Trypanosoma evansi infections. Ann. Trop. Med. Parasit., 58: 473-480. 1964. 8.- HOARE, A. C. Evolutionary trends in mammalian Trypanosomes. Advances in Parasitology, 5:47.1967. 9.- JOHNSON, C. M. Bovine Trypanosomiasis in Panamá. Ann.J. Trop. Med., 21: 289-297. 1941. 10.- KUBES, V. El Trypanosoma vivax americano, agente de la tripanosomiasis bovina en Venezuela, su comparación con el de África. III Conferencia Interamericana de Agricultura. (Ed. Grafolit), Caracas, No. 1, 1944. 124 p. 11.- LANHAM, S. M. Separation of trypanosomes from the blood of infected rats and mice by Anion-Exchangers. Nature, 218: 1273-1274. 1968. 12.- LEGER, A.; VIENNE, M. Epizootic á Trypanosomes chez les bovides de la Guyane Francaise. Bull. Soc. Path. Exot., 12: 258-266. 1919. 13.- NIESCHULZ, O. Ueber Trypanosoma viennei ein Rinder Trypanosoma aus Süd-Amerika. Acta Convent. III. Trop. Malar. Morb., Amsterdam, 1938, 1: 707. 1939. 14.- PLATA, R.
Tripanosoma tipo cazalboui en ganado de la Costa Atlántica. Rev. Med.
Vet., S: 181-184.1931. 16.- ROSS. J. P. J. The detection of circulaling Trypanosomal antibodies by capillary-tube agglutination Test. Ann. Trop. Med. Parasit., 65: 327-33g. 1971. 17. SHAW, J. J.; LAlNSON, R. Trypanosoma vivax in Brazil. Ann. Trop. Med. Parasit., 66: 25-32. 1972. 18.- TEJERA, E. Tripanosomiasis animales au Venezuela. Bull Soc. Palh. Exol., 13: 297-305. 1920. 19.- TORO, M.; LEON RIVAS, C. E.; ARAQUE, W.; LOPEZ, R. Diagnóstico Serológico de la Tripanosomiasis Bovina. Jornadas Veterinarias, Maracay, Memorias, Pág. 49. 1974. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||