|
Zootecnia Tropical, 10(2):219-238. 1992 ALIMENTACIÓN DE LA LISA (Mugil curema) DEL GOLFO DE CARIACO-ESTADO SUCHE, VENEZUELA Luisa Franco1 y K. M. B. Bashirullah2 1FONAIAP -Estación Experimental Falcón.
Campo Experimental Las Piedras, estado Falcón. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
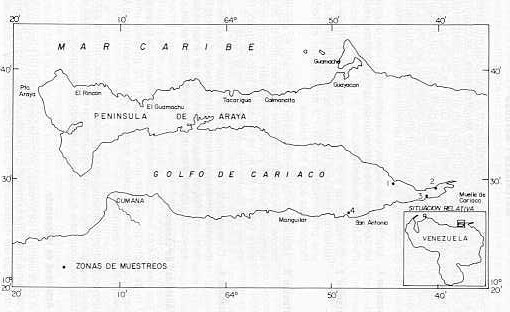
INTRODUCCIÓN Mugil curema (Valenciennes, 1836), conocida en Venezuela como lisa, se encuentra ubicada taxonómicamente en el orden Mugiliformes, suborden Mugiloidei, familia Mugilidae. Es de amplia distribución geográfica en aguas costeras y estuarinas, comprende las regiones situadas entre latitud 42°N y 42°S. Es un pez pelágico-costanero (6). A raíz de su comportamiento biológico, tamaño y valor nutritivo se considera que las lisas ocupan un nicho biológico clave entre aguas dulces yaguas saladas. Los caracteres eurihalinos y euritérmicos de los mugílidos facilitan su desplazamiento entre cuerpos de aguas marinas, estuarinas y continentales, lo que permite su utilización en operaciones de mugilicultura extensiva y semi-intensiva. En Brasil, Colombia y Cuba se le está dando un carácter prioritario al cultivo de especies autóctonas como fuente de proteína animal para el consumo humano. Una de las principales características que definen el comportamiento alimentario de los mugílidos es su facilidad para adaptarse a subsistir con alimento del más diverso origen, ajustando sus hábitos alimenticios según las condiciones en que se desarrolla su ciclo vital, por lo que han sido considerados por diversos autores como detritívoros, iliófagos, vegetarianos, omnívoros, fitáfagos y zooplantáfagos. Son capaces de alimentarse de algas uni y pluricelulares (5), con lo que obtienen su energía del primer nivel tráfico y también pueden adaptarse a vivir con material alimentario de muy baja calidad, no utilizado por otras especies (10). En particular, la alimentación y hábitos alimenticios de una especie muy afín a Mugil curema, como es M. cephalus, ha sido bien estudiada (3, 4, 7, 18, 19), verificando que esta especie se alimenta fundamentalmente de la capa superficial del fondo seleccionando partículas finas, incluyendo diatomeas bentónicas, algas filamentosas, detritus vegetal y sedimentos inorgánicos. Jacot ( 13) ha señalado que M. curema tiene hábítos alimenticios similares de M. cephalus, y los pequeños juveniles no comen crustáceos como otras especies del género, sino que sus estómagos se encuentran llenos de fango y materia orgánica. Thompson (21) estudió la alimentación de M. dobula, de aguas australianas, encontrando detritus, diatomeas, algas filamentosas y microfauna de moluscos en el contenido estomacal. Drake et al (8) estudiaron los hábitos alimenticios y su relación con la morfometría del aparato digestivo en M. cephalus, M. capitto, M. aurantus y M. saliens de las salinas de San Fernando (Cádiz) y concluyeron que existe una estrecha correlación entre las características morfométricas del aparato digestivo de los mugílidos y la naturaleza del alimento ingerido. En el Golfo de Cariaco no existe ninguna información sobre esta especie y por consiguiente, esta investigación representa una contribución sobre el conocimiento de algunos aspectos biológicos generales de la misma. La falta de información en nuestro país sobre la especie en estudio, Junto con la importancia comercial y el valor que tiene el conocimiento de aspectos biológicos de las especies para la piscicultura, propició la realización de un estudio que abarcara un análisis completo del contenido estomacal, con el objeto de determinar los hábitos tróficos de la especie y la variación de los diferentes índices implicados en ello. MATERIALES Y MÉTODOS Para el estudio del contenido estomacal se realizaron muestreos mensuales de juveniles y adultos de Mugil curema. Las capturas de los especimenes fueron realizadas en el período comprendió entre enero - diciembre de 1985, en el Golfo de Cariaco, estado Sucre. Se fijaron cuatro estaciones en la parte norte y sur del Golfo (Figura 1), estas zonas fueron seleccionadas por ser áreas frecuentadas por la especie. Se midió mensualmente la temperatura y salinidad de cada estación, con un termómetro y un salinómetro. Estación 1. Ubicada en la región de Guacarapo. El sitio de recolección tiene una extensión de aproximadamente 80 m. El fondo es fangoso. Estación 2. Corresponde a la región de Chiguana. El lugar de muestreo tiene una extensión aproximada de 40 m y una profundidad entre 0 -3 m. El fondo es lodo fangoso, las aguas son turbias. Estación 3. Ubicada en la región Muelle de Cariaco. El sitio de recolección del material tiene una extensión de 30 m aproximadamente y una profundidad comprendida entre 0, 70 y 1 ,50 m. el fondo es lodo-fangoso, las aguas son turbias. Hay manglares en la costa. Estación 4. Corresponde a la región de Curumuntal. La zona de muestreo tiene una extensión de aproximadamente 60 m. Hay manglares en la costa, el fondo es fangoso. Las aguas son más cal ras que en la estación anterior. Actividad de campo Los ejemplares fueron capturados con chinchorro de playa de 30 m de ancho por 3 m de alto y malla de 1 1/2 pulgada entre nudos. Se identificaron aquellas especies que acompañaron a M. curema al ser capturados. Inmediatamente después de obtenidos los especimenes, estos fueron lavados y preservados en formalina neutralizada al 10% en bolsas plásticas para su posterior traslado al laboratorio. Actividad de laboratorio A cada ejemplar se le realizó un corte ventral con un bisturí o tijera de punta fina, para extraer el contenido visceral, luego se separó el estómago del intestino a nivel de la región pilórica. Cada estómago se pesó lleno y vacío para calcular por diferencia el peso del contenido estomacal (Pce) en gramos. Este contenido se conservó en formalina neutralizada al 5%, hasta su posterior identificación y estimación con ayuda de un microscopio y de una lupa estereoscópica, mediante observación directa, según el grado de digestión en que se encontraban los alimentos.
Para el análisis del contenido estomacal y hábitos alimenticios se utilizaron los siguientes métodos, con el fin de hacer una mejor evaluación de las dietas. Métodos cualitativos a. Frecuencia de ocurrencia (f), citado por Ricker (20).
Este método indica las posibles preferencias alimenticias. Mediante los porcentajes obtenidos por esta fórmula se pueden distinguir tres categorías de presas: Accidentales f < 10 b. Ocurrencia numérica. Propuesto por Holden y Raitt (11)
Las diferencias mensuales y entre los renglones alimenticios se determinaron por análisis de varianza. Métodos cuantitativos a. Índice de repleción (IR), según Berhaut (2)
Se tomó en cuenta la siguiente escala: IR < 0,5 estómagos vacíos b. Índice de vacuidad (IV), citado por Hureau (12)
c. Índice intestinal (l1) De acuerdo con Nikolski (17), es la relación de 1a longitud del intestino con los hábitos alimenticios de la especie.
De acuerdo con los resultados puede interpretarse lo siguiente: l1 < 1 los peces son carnívoros La relación entre la longitud del pez y la longitud del intestino se determinó mediante un análisis de regresión. RESULTADOS Parámetros ambientales En todas las caladas efectuadas mensualmente se obtuvieron ejemplares de Mugil curema, con excepción de los meses agosto y septiembre. Las estaciones estudiadas son de fondo fangoso. En cuanto a los parámetros fisicoquímicos, se observó que las menores temperaturas se registraron en enero (22°C) en la estación de Guacarapo y en diciembre (24°C) en Chiguana y Curumuntal. Las mayores temperaturas se obtuvieron durante febrero, marzo, mayo y julio, siendo 29°C, en Curumuntal. Chiguana, Muelle de Cariaco y Guacarapo, respectivamente. En cuanto a la salinidad no se observó variación entre los valores de cada mes en cada estación; en Curumuntal y Guacarapo se mantuvo entre 35 y 36%, en Muelle de Cariaco y Chiguana entre 34 y 36%. No se establecieron diferencias estadísticas para estos parámetros entre estaciones, ya que eran medidos en horas diferentes para cada una de ellas. Análisis del contenido estomacal El estudio de los renglones alimenticios contenidos en el estómago se basó en el examen de 286 contenidos estomacales provenientes de organismos juveniles y 120 ejemplares adultos. Los renglones alimenticios presentes en el contenido estomacal de esos ejemplares fueron:
Para el análisis detallado del contenido estomacal se utilizaron los siguientes métodos: 1. Composición cualitativa Según el método de frecuencia de ocurrencia, los elementos preferenciales o principales para los ejemplares juveniles son las diatomeas bentónicias y los dinoflagelados con f> 50, los cuales por lo general mantuvieron su categoría durante los meses muestreados; los copépodos estuvieron dentro del grupo de secundarios con 10< f< 50, mientras que el otro renglón alimenticio (cocolitofóridos) se ubica como alimento accidental por presentar f< 10. Con respecto a los renglones preferenciales, se encontró que no existen diferencias mensuales significativas en la dieta. El espectro trófico total de la población de M. curema indica que el principal alimento de la población está formado por las diatomeas bentónicas (céntricas y pinnuladas), restos orgánicos (detritus y restos vegetales) y sedimentos inorgánicos finos con un 100% de frecuencia. Los dinoflagelados (Ceratium,Gymnodinium, Protoceratium, Atecales) se presentan en un 98% de los estómagos analizados, mientras que los copépodos y cocolitofóridos se encontraron en un 14,9 y 2,99%, respectivamente, en los estómagos analizados (Cuadro 1). Resultado similares se obtuvieron en el análisis del contenido estomacal, mediante el método de ocurrencia numérica. donde se observa que para formas juveniles de M. curema, las diatomeas se presentaron con un porcentaje de ocurrencia de 75%, seguidos por dinoflagelados con un 24% del total de renglones alimenticios ingeridos y los copépodos y cocolitofóridos con bajos porcentajes de 0,85 y 0,04%, respectivamente (Cuadro 1). En febrero y mayo las diatomeas tuvieron su más alto índice de ocurrencia y en abril los dinoflagelados, pero nunca llegaron a ocupar el primer orden de importancia. En juveniles y adultos no hubo diferencias mensuales significativas en la dieta, mientras que entre renglones las diferencias son altamente significativas (P< 0,001 ). Las diatomeas forman un primer grupo seguido de dinoflagelados, en un segundo grupo y en un tercer grupo aparecen los copépodos y cocolitofóridos.
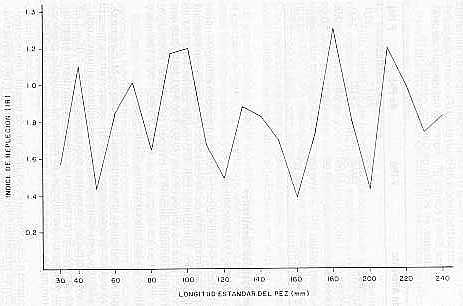
2. Composición Cuantitativa a. Índice de Repleción (IR) Las variaciones del índice de repleción pueden estimar la intensidad de la alimentación de las especies. De acuerdo con la escala establecida, los ejemplares con estómagos vacíos (IR < 0,5) se observaron para los rangos de talla de 50, 120, 160, 200 y 240 mm de longitud estándar durante el período de estudio; estómagos llenos (IR > 1) en los rangos de tallas 40, 70, 90, 100 y 180 mm y semi llenos en las tallas restantes (Gráfico 1 ). Según este índice, en los ejemplares juveniles de M. curema se observó que los estómagos vacíos se presentaron en los meses: enero y febrero, y los estómagos llenos se ubicaron en mayo, octubre y noviembre, con los valores promedios de 1,45; 1,06 y 1,28 respectivamente. En los meses restantes se encontraron ejemplares con estómagos semillenos. El índice de repleción presentó variación mensual significativa para estos ejemplares (P < 0,05). En cuanto a los ejemplares adultos, en los meses: febrero, marzo y octubre presentaron medias de 0,43; 0,40 y 0,36, respectivamente, quedando así incluido en el promedio de estómagos vacíos, enero-abril-julio-octubre con promedios que, de acuerdo con la escala, entran en estómagos semillenos; los estómagos llenos se ubicaron en mayo (1,25), junio (1,59), noviembre (1,77) y diciembre (1 ,84). Se determinó que no existe relación entre la talla de los ejemplares y el índice de reproducción, por lo tanto, no hay diferencia entre Juveniles y adultos.
b. Índice de Vacuidad El número de estómagos vacíos con relación al total de estómagos examinados se expresa, mediante el índice de vacuidad. En el presente estudio los estómagos vacíos tuvieron un porcentaje anual para juveniles de 25, 19% y para adultos de 34, 15%. La variación mensual del índice de vacuidad fue notoria, observándose que en ejemplares juveniles en los meses, enero y febrero se presentó el mayor porcentaje de estómagos vacíos, mientras que en noviembre y diciembre no se obtuvieron estómagos en estas condiciones. Para ejemplares adultos de M. curema, en octubre se presentó el mayor índice de vacuidad y no se encontraron ejemplares con estómagos vacíos en diciembre (Cuadro 2).
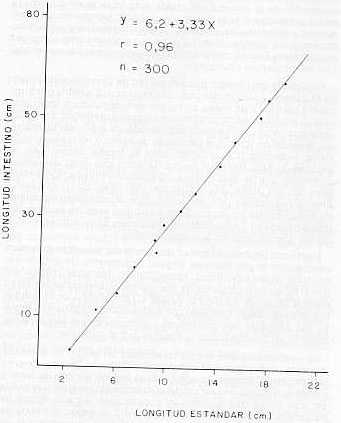
c. Índice Intestinal Constituye otro de los aspectos para determinar hábitos alimenticios de las especies. Así, se tiene que para ejemplares juveniles este índice oscila entre 2, 15 y 2,99 y en los adultos de M. curema entre 2, 15 y 2,99 y en los adultos de M. curema entre 3,5 y 4,27, lo cual permite ubicar a la especie dentro de la categoría de los peces herbívoros, de acuerdo con la clasificación propuesta por Nikolkski (17). Para verificar la posible relación entre el índice intestinal (li) y la longitud estándar del cuerpo del pez, se hizo un análisis de regresión. La ecuación Y = 6,2 + 3,33 X, establece la relación encontrada entre el índice intestinal (Y) y la longitud estándar (X) para el total de los ejemplares estudiados, comprobándose una relación positiva (Gráfico 2). DISCUSIÓN El Golfo de Cariaco es una de las principales áreas del oriente de Venezuela, y está afectada por fenómeno de afloramiento o surgencia inducido por el viento (noviembre-abril), siendo el mecanismo fertilizante responsable de la producción biológica relativamente alta que se observa en el Golfo y las áreas adyacentes, que albergan el recurso en que se basa la pesca de las diferentes especies que habitan esa región. El afloramiento se caracteriza por bajas temperaturas y altas salinidades. En el presente estudio las bajas temperaturas no fueron muy notorias en los meses en que se presenta dicho fenómeno y las salinidades no parecen variar mucho en la zona estudiada y se mantiene más bien alta. De la misma manera, estos parámetros no parecen relacionarse con la ocurrencia de estómagos vacíos, ni con el índice de repleción de M. curema, al menos en los meses donde se dispone de dicha información. Esto tal vez ocurre así por alimentarse esta especie de organismos contenidos en el fondo. La alta productividad del ecosistema y la diferencia de hábitos alimenticios es lo que permite la gran diversidad de especies en el medio, por lo que no puede pensarse en la existencia de posible competencia por el alimento entre la lisa y las demás especies acompañantes, según la naturaleza del alimento ingerido y a la categoría particular del mismo. M. curema se ubica dentro de los organismos detritivoros vegetal, confiriéndole en la cadena trófica el lugar correspondiente a un consumidor primario. Este tipo de alimentación representa un patrón relativamente definido y constante que, sin embargo, puede sufrir variaciones de acuerdo con la zona o lugar, estacionalidad, disponibilidad del alimento, edad o sexo. En Venezuela, en el Golfo de Cariaco del estado Sucre, la alimentación de la especie estudiada está basada en diatomeas, restos orgánicos y sedimentos inorgánicos, siendo éstos los alimentos preferenciales, seguido de dinoflagelados y por último, copépodos y cocolitofóridos que se consideran como alimentos accidentales. Esto se comprobó por los métodos usados en el análisis del contenido estomacal.
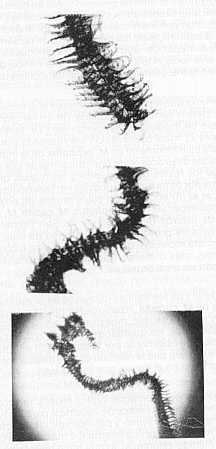
Furtado (9) en la determinación del tipo de alimento en juveniles de M. curema de las costas de Brasil, encontró Que había predominancia para las diatomeas, como alimento secundario los crustáceos planctónicos y como ocasional algunos protozoos. Este autor consigna como una ingestión accidental la de espículas de esponjas, esporas de hongos y partículas de arena y no las cuantifica. Yanez-Arancibia (23) encontró para la misma especie en las lagunas de Tres Palos y Coyuca (México) una dieta alimenticia constituida por detritos, materia orgánica, microflora y restos vegetales en un 100% de frecuencia. Mientras Que González y Alvarez-Lajonchere (10) encontraron en el contenido estomacal de la especie de aguas cubanas, partículas finas de sedimentos, restos orgánicos y cantidades de diatomeas. Estos datos corroboran los encontrados en el presente trabajo. Los restos orgánicos reconocibles en el detritus están formados esencialmente por material vegetal proveniente de vegetación acuática (algas clorofíceas, fanerógamas). Margalef (16) señaló Que el fango en las lagunas de manglares es relativamente rico en materia orgánica. Asimismo, Angell (1) demostró que el detritus puede presentarse mezclado con sedimentos inorgánicos y éste a su vez asociado con microfauna ; y microflora, que puede ser el material aprovechado por la especie que lo consume. Se encontraron diferencias cualitativas en el tipo de alimento ingerido por la especie M. curema en el Golfo de Cariaco, pero no se detectaron diferencias significativas en relación con las tallas y meses analizados en función del alimento. Esto hace pensar que la especie no cambia su dieta en el transcurso de sus etapas de desarrollo de juveniles a adultos; es decir, el espectro trófico de esta área indica una constancia en el patrón de alimentación. En una zona de alta productividad. como el Golfo de Cariaco, podría pensarse que en el período de surgencia la frecuencia y cantidad de organismos fitoplanctónicos encontrados en los estómagos de los peces analizados fuera mayor, sobre todo si se considera que tanto las diatomeas como los dinoflagelados resultaron pertenecientes al grupo de alimentos preferenciales en base a los contenidos estomacales examinados, pero esta suposición no encuentra base de acuerdo con los resultados obtenidos al determinar la frecuencia y la ocurrencia de los diferentes tipos de alimentos en los contenidos alimenticios. Quizás por la misma riqueza, que es apreciable durante todo el año, no se observen ritmos de ascenso y descenso en la frecuencia y ocurrencia del contenido estomacal. Un fenómeno que llamó poderosamente la atención fue la presencia, en ciertos ejemplares adultos, de un renglón alimenticio que consiste en mudas de branquispinas ( Dr. Molla Huq., com. pers.) (Figura 2). Igual observación fue realizada por Luther (15), quien señala este fenómeno en M. cephalus de la India, con grandes cantidades de procesos de branquispinas en sus estómagos y señala que los restos de poliquetos y las mudas de poliquetos consignados por otros autores, podrían ser realmente estos procesos, Dráke et al (8) encontraron estas mudas de procesos branquiales en las especies de M. cephalus, M. capíto, M. auratus y M. chelo en los esteros de las salinas de San Fernando (Cádiz). Estos procesos se presentan bien en forma de tiras, correspondiente a la muda individual de una branquispina, o como estructuras complejas, más o menos fragmentadas, pertenecientes a la muda de todo un arco branquial. Los resultados de los índices utilizados en el estudio de la ecología trófica de M. curema, relacionados con la intensidad de alimentación y su selectividad, muestran un índice de repleción con pocas fluctuaciones, no guardando relación con la talla del pez, igual resultado fue observado por Villarroel (22) en Anchoa cubana. Esto lleva a inferir que la relación es más directa con la disponibiliad de alimento en el medio que con la talla. El número total de estómagos vacíos en relación con el total de estómagos examinados (índice de vacuidas) para los juveniles fue mayor en enero, febrero y julio, y para los adultos en octubre, febrero y marzo. Asimismo, se registraron los menores valores para el peso del contenido estomacal, lo que hace pensar que para esas épocas el alimento escasea en el medio. En general, el total de estómagos vacíos no supera el 29,67%, indicando por lo tanto, que la especie está en constante actividad trófica.
Se ha establecido que el largo del tubo digestivo está relacionado con el tipo de alimento y que la longitud del intestino en peces carnívoros es menor que el 100% del largo del cuerpo y más del 100% en los herbívoros. Kapor (14), indica que aquellos peces que consumen alimento con una alta proporción de material indigerible (siendo el caso de los macrófagos y herbívoros) tienen un intestino relativamente más largo que los carnívoros. De acuerdo con esto, el índice intestinal encontrado en M. curema indica un comportamiento alimenticio estrictamente herbívoro, lo que se verifica a través de los resultados del análisis del contenido estomacal. Además se observó que existe una relación lineal positiva entre la longitud del intestino y la del pez, lo que indica un incremento del órgano a medida que crece el organismo. CONCLUSIONES La población estudiada está conformada por ejemplares de diferentes grupos de talla, con predominio de 80 - 1 00 mm de longitud estándar para juveniles y 190 - 200 mm para los adultos. La alimentación está constituida por diatomeas bentónicas, dinoflagelados, restos orgánicos (detritus y restos vegetales) y sedimentos inorgánicos, tanto en juveniles como adultos. Este espectro trófico de M. curema indica su posición de consumidor primario en la cadena alimenticia. El análisis del contenido estomacal y el alto índice intestinal (>2) ratifican el hábito alimenticio herbívoro-detritívoro de esta especie. Los valores del índice de repleción (IR) obtenidos, tanto en juveniles como en adultos, indican un grado de condición fisiológica excelente durante todo el año de muestreo. La relación entre la longitud del intestino y la del pez, es del tipo lineal. RESUMEN Una muestra de 468 ejemplares de Mugil curema Valenciennes, en el Golfo de Cariaco, estado Sucre, Venezuela, fue estudiada para conocer sus hábitos alimenticios. La muestra estuvo comprendida por ejemplares de diferentes grupos de tallas con promedio de 8 - 1 00 mm de longitud estándar para juveniles y de 1 90 - 200 mm de longitud estándar para los ejemplares adultos. Esta especie se alimenta preferentemente de diatomeas bentónicas, restos orgánicos. sedimentos finos inorgánicos y dinoflagelados; en consecuencia, su espectro trófico señala que es una especie detritívora vegetal correspondiendo a un consumidor primario. El índice de repleción (IR) se relaciona directamente con el factor de condición (K), inversamente con el índice de vacuidad (IV) y no se encontró relación con la talla del pez. SUMMARY A total of 486 individuals of Mugil curema Valenciennes in the Cariaco Gulf, Venezuela, were examined by know the feedin biology. The sample was composed by individual of different groups of sizes with a mean value ranging from 8 -100 m m standar lenght juveniles and 190- 200 mm for the adults. Thespecie feeds on benthie diatons, organic debris, fine inorganic sedimentss and dinoflagelates preferable. In consequence the trofic spectrum indicates that the specie is detritus-hervivorous which places it as a primary consumer. The repletion index is directly related to the condition factor (K) and inversely related to the vacuity index (IV). No relation to the size of the fish was found. BIBLIOGRAFÍA 1. ANGELL, CH. L. Algunos aspectos de la biología de la lisa Mugil curema Valenciennes, en aguas hipersalinas del Nor-oriente de Venezuela. Mem. Soc. Cienc. Nat. La Salle, 33 (96): 223-238. 1973. 2. BERHAUT, J. A. Biologíe des stades juveniles de Teleosteens Mugilidae mugil auratus Risso, 19810; Mugil capito Cuvier, 1829 et al Mugil salines Risso, 1810. Aquaculture 2: 251-266. 1973. 3. BLABBER, S. J. M. The food and feeding ecology.I mugilidae in the St. Lucia Lake Systm. Biol. J. Linn. Soc., 8: 267 - 277. 1976. 4. BLABBER, S. J. M. The feeding ecology and relative abundance of mullet in natal. Biol. J. Linn. Soc., 9: 254-275. 1977. 5. BRUSLE, J. Food and feeding ini let. In: Aquaculture of grey mullet, Ed.O.H. Oren Cambridge University Press. 507 p. 1981. 6. CERVIGON, F. Los peces marinos de Venezuela. Tomo I. Est. Inv. Mar. Margarita. Fund. de Cienc. Nat. la Salle. 1966. 7. DRANELL, A. M. Organic detritus in relation to the estuarine ecosystem. In: Estuaries (G. H. Lauff, ed.). Publ. Amer. Assoc. Adv. Sci., (3): 376-383.1967. 8. DRAKE, P.; A. M. ARIAS y L. GALLEGO. Biología de los mugílidos (Osteichthyses, Mugilidae) en los esteros de las salinas de San Fernando (Cádiz). III. Hábitos alimenticios y su relación con la morfometría del aparato digestivo. lnv. Pesq. 48 (2): 337-367.1984. 9. FURTADO, E. Algunos datos sobre alimentacao de jovenes do genero Mugil Linn. no Estado de Ceará. Arq. Est. Biol. Mar. Univ. Ceará 8 (2): 173-176.1968. 10. HICKLING, C. F. Estuarine fish farming Adv. Mar. Biol. 8: 119- 213. 1970. 11. HOLDEN,M,J. and D.F. S. RAITT. Manual of fishery science. Part. II. Methods of resource investigation and their aplications. FAO. Tec. Paper 115. Revisión, 1: 35-43. 1974. 12. HUREAU. J. C. Biologie compareé de qulques poisson antartitoques (Ntotheniidae). Bull. Inst. Oceanogr. Mónaco. 68 (1391): 250 p. 1968. 13. HACOT, A. P. Age, growth and scale characters of the mullets. Mugil cephalus and Mugil curema. Trans. Amer. Microsc. Soc., 39 (3): 119-229. 1.920. 14. KAPOOR, B. G. The alimentary canal and digestion in teleost. Adv. Mar. Biol.. 13: 109-239. 1975. 15. LUTHER. G. The fords habits of liza macrolepis (Smith) and Mugil cephalus (L.) (Mugilidae). Indian J. Fish. 9 (2): 604-624. 1962. 16. MARGALEF, R. Ecología. Omega, S. A. Barcelona, Esp. 951 p. 1977. 17. NIKOLSKI, C. V. The ecology of fishes. Academic Press, London-New York. 352 p. 1963. 18. ODUM, W. E. Ecological significance of fine particle selection Mugil cephalus Limnol. Oceanogr., 13 (1): 92-98. 1968. 19. ODUM, W. E. Utilization of the direct grazing and plant detritus food chains by the stripep mullet Mugil cephalus. Proc. Symposium Chains. J. H. Steele (Ed.). 220-240. p. 1970. 20. RICKER, W. E. Methods for assesment of fish production in freshwater. International Biological Programme. Hand Book No.3. Blackwell Scientific Publications. Oxford and Edimburg. 348 p. 1971. 21. THOMPSON, J. M. The organs of feeding and food of some Australian mullet. Aust. J. Mar. Freshwat. Res., 5: 469- 485, 1954. 22. VILLARROEL, C. Algunos aspectos de la biología y ecología de la camaiguana anchoa cubana (Poey) (Pisces: Engraulidae) del Golfo de Cariaco, estado Sucre, Venezuela. Tesis UDO. Cumaná, Ven. 1981. 23. TANEZ-ARANCIBIA, L. A. Observaciones sobre Mugil curema Valenciennes en áreas naturales de crianza. México: Alimentación, crecimiento, madurez y relaciones ecológicas. An. Centro de Ciencias del Mar y Limnol. Univ. Nac. Auton. México. 3 (1): 93-124.1976. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||