|
Zootecnia Tropical, 15(1):3-16. 1997 ASPECTOS REPRODUCTIVOS DE LA PETOTA,
Umbrina coroides (Cuvier, 1830) G. Gómez y R. Guzrnán FONAIAP. Centro de Investigaciones Agropecuarias/Sucre-Nva. |
|||||||||||||||||||||||||||||||||
Umbrina coroides, es un pez bentónico de la plataforma continental, que habita sobre fondos fangosos y/o arenofangosos; comúnmente entre los 20 y 60 m de profundidad (2,9). Su distribución comprende el Atlántico Occidental, desde México hasta Brasil, incluyendo las Antillas mayores ( 2,4,8). En Venezuela es una especie muy común en todas las playas de la región nororiental, de preferencia en las protegidas más que en las de fuerte oleaje. No es frecuente en las áreas insulares oceánicas. También se ha capturado en el Golfo de Venezuela (3). Esta especie, constituye un importante componente de la captura comercial de la flota pesquera de arrastre que opera en la región Nororiental de Venezuela. No obstante a esta importancia, la información sobre su biología en el país es escasa; por ello, se creyó conveniente realizar un estudio basado en algunos aspectos reproductivos; importantes para la administración y manejo de recursos en explotación. MATERIALES Y MÉTODOS Las muestras se colectaron de enero a diciembre de 1989, durante labores de pesca comercial, realizadas por embarcaciones de arrastre que operan al norte de la Península de Paria (Figura 1); entre Saucedo (10°43' N y 63° 36' W ) y el promontorio de Paria (10° 30' N y 61° 58' W ).
Los ejemplares se preservaron en hielo para su traslado al laboratorio, en donde se les determinó el peso total (pt, g) en una balanza de 1 9 de Apreciación y la longitud total (Lt, mm) con un ictiómetro de 1 mm de precisión. Observaciones macroscópicas de la morfología externa y de coloración de las gónadas permitió determinar el sexo. La madurez sexual, se estudió de acuerdo a la escala indicada por Holden y Raitt (10) para reproductores parciales y modificada por Colassaco (6).La proporción de sexos se analizó a través de un Ji cuadrado (18) El peso de las gónadas se determinó en una balanza de
0,01 9 de apreciación; esta información se usó para calcular el índice gonadal,
mediante la relación
La fecundidad se determinó en hembras maduras (estadío IV) mediante el método gravimétrico (1) y posterior aplicación de la fórmula de Joseph (12).
Para ello, de la parte central de cada gónada se tomó una muestra y se fijó en solución de formol salino al 5%, para facilitar el desprendimiento del tejido conectivo. Los valores de fecundidad se relacionaron con la
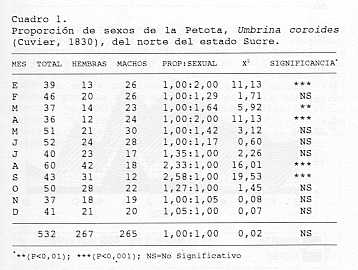
longitud total y con el peso, mediante la ecuación indicada por El diámetro de los ovocitos permitió elaborar un histograma de frecuencias, con intervalos de 0,04 mm; lo cual sirvió para inferir sobre el tipo de desove de la especie. RESULTADOS Y DISCUSIÓN Los resultados se obtuvieron en base al estudio de una muestra de 532 ejemplares, en la cual la longitud total de las hembras osciló entre 209 y 356 mm con una media de 281 mm y un peso entre 127-590 g, con promedio de 308 g. En los machos, la longitud total varió entre 204-363 mm cuya media fue de 283 mm, con pesos que oscilaron entre 112-680 g, con promedio de 296 g. Trabajos sobre la especie reportan tallas y pesos inferiores a los máximos indicados en el presente estudio. Al respecto, Cervigón (2) señaló una talla máxima de 300 mm de longitud total, con un peso de 380 g, y Fischer (8) reportó una talla máxima de 350 mm de longitud total. Por otra parte, Cervigón y Fischer (4) indicaron una talla media de 250 mm de longitud total. Tales diferencias pudieran estar asociadas con el sistema de pesca y/o arte de pesca utilizado y con las características del área de distribución y pesca de la especie. Proporción de Sexos: Del total de ejemplares examinados, 267 ( 50,19% ) resultaron hembras y 265 (49,81% ), machos. El Cuadro 1 muestra que esta proporción; durante agosto y septiembre se alejó significativamente a favor de las hembras, y de igual forma durante enero, marzo y abril a favor de los machos. No obstante, la proporción total no se desvió significativamente de la esperada 1:1 (P > 0,05). Nikolsky (17) señaló que la proporción de sexos puede variar considerablemente entre las especies y diferir de una población a otra, e incluso de un año a otro dentro de una misma población; agrega sin embargo, que en la mayoría de ellas, la proporción de sexos tiende a ser de 1:1. Margalef (16) señala que la relación entre el número de machos y hembras está influenciado por mecanismos gen éticos y de regulación ambiental. Por su parte, Christiansen y Couseau (7) señalan que la proporción de sexos, puede experimentar cambios con el período reproductivo y con los grupos de tallas. La diferencia en la proporción de sexos, observada en este trabajo en algunos meses del año, pudiera ser atribuible a algunas de las causas señaladas o también guardar alguna relación con situaciones del muestreo durante el período de estudio; como consecuencia del comportamiento de la flota pesquera en cierta época del año, en la que dirige sus operaciones a áreas específicas.
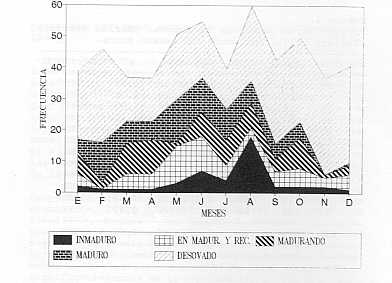
Madurez sexual: Los estadíos de madurez sexual y su variación se muestran en el Gráfico 1. Se observa la presencia de individuos maduros y desovados durante todo el año, lo que evidencia que u. coroides tiene una actividad reproductiva continua y prolongada que se intensifica entre mayo y agosto. La actividad reproductiva prolongada en Sciaenidos ha sido reportada por varios investigadores, siendo que Zaneti (23) para u. canosai de Brasil, señala que el desove ocurre en primavera y verano, en aguas costeras de salinidad y temperaturas bajas. Isaac y Vazzoler (11) indicaron para Micropogonias furnieri, tres períodos de desove durante el año; uno en otoño (entre abril y junio), otro en invierno (agosto y septiembre) y un tercero en primavera y verano (noviembre y febrero). Por su parte, Lowe-McConnell (14), señaló para M. furnieri de las costas de Guayana una reproducción continua; en virtud de la ocurrencia de hembras maduras y de alevines durante todo el año.
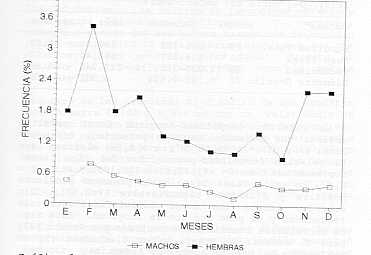
Los resultados obtenidos para U. coroides guardan relación con los obtenidos para otros Sciaenidos, e inducen a pensar que las especies de esta familia tienen un patrón reproductivo común; cuya mayor actividad gonadal pareciera tener lugar hacia el segundo semestre del año. Índice Gonadosomático: La razón gonadosomática de u. coroides, se presenta en el Gráfico 2. Para las hembras, los valores mensuales oscilaron entre 0,91% y 3,43% (octubre y febrero) y para los machos, entre 0,13% y 0,77% (agosto y febrero). En ambos casos se observó un incremento en la actividad gonadal a partir del mes de febrero. La razón gonadosomática en Sciaenidos, ha sido estudiada por otros investigadores. Al respecto, Colassaco (6) señaló variaciones mensuales en este índice para Cynosción jamaicensis de la plataforma Piritu-Unare, Venezuela, indicando un período de madurez entre septiembre y febrero. Marcano (15) señala para la misma especie en el norte del estado Sucre, un máximo desarrollo gonadal entre agosto y enero; mientras que Vazzoler y Braga (21) señalaron para C. jamaicensis de Brasil, un período de desove de septiembre a diciembre.
Los valores del índice gonadosomático observados para U. coroides durante el estudio, indican una actividad reproductiva prolongada, y guardan relación con los reportes de los autores mencionados. Fecundidad: Se estableció en base a un total de 20 ejemplares sexualmente maduros. (Cuadro 2). Se determinó una fecundidad absoluta promedio de 213.246 ovocitos, con valores entre 77.025 y 380.132 ovocitos, para ejemplares de tallas entre 221 y 352 mm de longitud total.
La relación fecundidad-longitud total
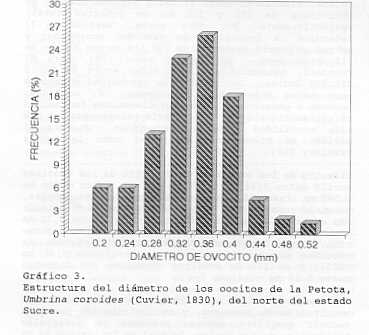
permitió obtener una ecuación de tipo potencial, expresada como: A través de La fecundidad se puede determinar el potencial reproductivo de una población; así como también, inferir sobre la supervivencia en la fase temprana de vida y sobre la capacidad de recuperación de una población; una vez disminuida en su densidad por efectos de la actividad pesquera y/o por alteraciones ambientales (10). Estudios de fecundidad en Sciaenidos señalan para U. canosai de Brasil, una fecundidad media de 183.618 Óvulos, con valores de hasta 716.705 óvulos en un ejemplar de 288 mm de Lt y 335 9 de peso (22). Para C. jamaicens (15) reportó una fecundidad media de 248.000 óvulos, fluctuando entre 46.354 y 554.000 huevos, en individuos de 215 y 312 mm de longitud total, respectivamente. Por otra parte, Vazzo1er (19) determinó la fecundidad de Macrodon ancyclodon y estimó un número de óvulos de 178.114 en una hembra de 510 9 de peso. Este mismo autor (20), para M. furnieri, determinó una fecundidad entre 44.733 y 776.000 óvulos. LoS valores de fecundidad obtenidos para estos Sciaenidos, incluyendo u. coroides, inducen a pensar que loS mismos tienen una fecundidad relativamente alta la cual estaría relacionada con una alta mortalidad natural; sobre todo durante el período de Huevos y larvas; tal como lo señala Nikolsky (17). Diámetro de los ovocitos: El diámetro de los ovocitos osciló entre 0,180 y 0,504 mm con un valor medio de 0,342 mm (Cuadro 2). Una distribución de frecuencias, permitió separar tres grupos de ovocitos en el estadío más avanzado de madurez; en donde el grupo de 0,32 mm clasificado arbitrariamente como ovocitos en maduración, estuvo representado en un 23%, seguido de ovocitos maduros con diámetro a partir de 0,36 mm (52%), y un 25% de ovocitos inmaduros con diámetro hasta 0,28 mm (Gráfico 3). La heterogeneidad encontrada en el diámetro de los ovocitos de U. coroides, y su distribución permiten deducir que esta especie presenta un desarrollo asincrónico de sus óvulos, lo cual es indicativo de un desove parcelado. Este tipo de desove, ha sido indicado para otros Sciaenidos corno c. jamaicensis del Norte de Sucre, Venezuela, (15); de igual forma, en Brasil, para M. ancyclodon (19,20,22) y para u. . canosa.! ( 23) .,'-" En cuanto al desove fraccionado algunos autores, entre ellos Nikolsky (17), señalan que el mismo es característico de las especies tropicales y probablemente actúa como un mecanismo de defensa; por cuanto el potencial reproductivo total estaría distribuido en diferentes intervalos del año.
CONCLUSIONES
RESUMEN Umbrina coroides, constituye un importante componente de la captura comercial de la flota pesquera que opera en el oriente del país. En este trabajo se analizó una muestra de 532 ejemplares, obtenidos de la pesca de arrastre en el norte del Estado Sucre, durante el período enero diciembre de 1989. Los resultados indican que la proporción de sexos no difiere (p> 0,05) de la esperada 1:1. La especie se reproduce durante todo el año, con una mayor intensidad entre abril y agosto. Su fecundidad absoluta promedio estimada en 213.246 ovocitos se considera alta y se incrementa con la longitud y el peso. Palabras Clave: Umbrina coroides, Fecundidad, Razón gonadosomática, Estadios de madurez, proporción de sexos REPRODUCTION OF umbrina coroides (CUVIER,
1830) IN THE NORTH OF SUCRE STATE, VENEZUELA SUMMARY Umbrina coroides, is a very irnportant specie frorn the cornrnercial capture of the fleet flshing operating in the eastern area of the country. In this work a sarnple of 532 specirnens, frorn the trawling fishing in the north of Sucre state (Venezuela), during january decernber 1989, was analized. There are no significant difference (P>O.O5)among the sex ratio and the expected value (1:1) .The specie reproduction occur during all year, with a greater intensity between april and august. The average absolut fecundity was estimated in 213,246 ovocites, this is hight and also increase respect to length and weight. Key Words: Umbrina coroides, Fecundity, Madurity stage, Sex ratio Gopadosomatic Ratio. BIBLIOGRAFÍA
|
|||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||