|
Caña de azúcar, Vol. 04(01): 65-80
1986
Efraín Salazar y José G. Surga |
|||||||||||||||
|
RESUMEN Ápices caulinares de los cultivares de caña de azúcar V 64-10. B 6749, PR 61632 y PR 62258, provenientes del Banco de Germoplasma del CENIAP, Maracay, fueron cultivados en la solución mineral de Murashige y Skoog, solidificada con agar Difco (7 g/l) y suplementada con Tiamina HCL (0,1 mg/l), mio-inositol (100 mg/l) y sacarosa (30 g/l). A ese medio se le aplicó ácido naftalen acético (ANA), ácido indol butírico (AIB) o ácido indol acético (AIA) en dosis comprendidas entre 0,2 y 3,0 mg/l. El pH fue ajustado entre 5,6 y 5,8. Los explantes se sembraron en tubos de ensayo con 25 ce de medio de cultivo estéril. Luego de 10 a 12 días en la oscuridad, los explantes fueron colocados a luz con intensidad de 600 lux. La temperatura de la cámara de crecimiento fue de 28 ± 2°C. los resultados indicaron que para el cultivar V 64-10, la dosis de 3,0 mg/l de AIA indujo la formación de plantitas. Los meristemos de B 6749 mostraron un incremento en tamaño cuando se le aplico AIB, mientras que las auxinas AIA y ANA aparentemente no indujeron reacción en el explante. Los ápices de PR 61632 produjeron hojitas sin formación de callos, al aplicársela AIB en dosis de 1,0 y 3,0 mg/l. Iguales resultados fueron observados con 3,0 mg/l de AIA, con la ventaja de una mayor rizogénesis en menor tiempo. Para el cultivar PR 62258 se obtuvieron los mejores resultados al añadirle al medio de cultivo 3,0 mg/l de AIA, dosis con la cual se logró regenerar plantitas. APPLICATION OF IN VITRO MERISTEMATIC TISSUE CULTURE TECHNIQUE TO FOUR SUGARCANE (Saccharum spp) VARIETIES* ABSTRACT Shoot tips of V 64-10, B 6749, PR 61632 and PR 62258 sugarcane varieties, from the CENIAP Sugarcane Varieties Collection at Maracay, were grown into Murashige and Skoog mineral solution. This solution wa3 solidified with DIFCO agar (7 g/l) and supplemented with Thiamina HCI (0.1 mg/ I), Myoinositol (100 mg/l) and Sucrose (30 g/l). Napththalen Acetic Acid (NAA) Indol Butyric Acid (IBA) or Indol Acetic Acid (IAA) was added to the culture medium in a dose range of 0.2-0.3 mg/l. The pH varied between 5.6 and 5.8. The explants were placed in test tubes containing 25 ml of sterile culture medium. After 10-12 days in darkness, the tubes were placed under 600 lux intensity light at 28 + 2°C. The results showed that 3.0 mg/l IAA induced regeneration of plants in V 64-10. The meristems of B 6749 increased size when IBA was applied, while IAA and NAA induced no reaction. Small leaves without callus formation were observed after 1.0 and 3.0 mg/l IBA application in PR 61632. Similar results were observed with 3.0 mg/1 IAA, with the additional advantage of a greater rhizogenesis in less time. For PR 62258 the best results were found by adding 3.0 mg/1 IAA to the culture medium, thus, achieving the regeneration of plants
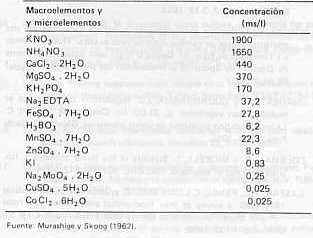
La propagación comercial de la caña de azúcar (Saccharum spp) se realiza asexualmente, mediante la siembra de esquejes, garantizando la regeneración de plantas exactas a la planta madre. En este sentido, el cultivo de tejido meristemático in vitro se presenta como una posibilidad de propagación asexual en forma acelerada y de un excelente estado sanitario, convirtiéndose además, en una herramienta muy útil para el mejorador (Krishnamurthi, 1977, 1982; Liu y Chen 1974; Nickell y Torrey, 1969). Esta técnica se aplicó a caña de azúcar por primera vez por Coleman y Nickell (1964), posteriormente se ha utilizado, tanto para la propagación acelerada de las plantas, como para la obtención de plantas libres de patógenos, especialmente virus (Hendre et al, 1975; Leu, 1972). Barba y Nickell (1969) determinaron la necesidad de añadir ex6genamente una auxina al medio de cultivo, para el éxito de la aplicación de cualquier técnica de cultivo de tejido in vitro en caña de azúcar. En este orden de ideas, Bonnell (1980) señaló la dificultad de los tejidos de monocotiledóneas para responder a la aplicación de auxinas; mientras que Levan (1939) y Pizzolato y Reglter (1979) establecieron la baja capacidad de los meristemas de caña de azúcar en reaccionar a las aplicaciones exógenas de estas sustancias de crecimiento; por tal motivo, en este trabajo se intentó afinar la técnica del cultivo de tejido meristemático in vitro en caña de azúcar, al tratar de propagar variedades de interés comercial a partir del cultivo in vitro de meristemas caulinares y determinar cuál auxina y en qué concentración fue la más adecuada para el mejor desarrollo de los explantes. MATERIALES Y MÉTODOS Se extrajeron yemas de cuatro cultivares de caña de azúcar (V 64-10, B 6749, PR 61632 y PR 62258), provenientes del banco de germoplasrna del CENIAP, las cuales fueron lavadas con un detergente comercial durante varios minutos, removiéndose el exceso del mismo con agua potable. Posteriormente, se colocaron en baño de María a una temperatura de 500C durante una hora, sumergiéndose seguidamente en una solución de hipoclorito de sodio al 10% por 60 minutos, inmediatamente fueron trasladadas a la cámara de flujo laminar para su posterior siembra en un medio de cultivo, siempre respetando las condiciones de rigurosa asepsia. El medio de cultivo utilizado contenía los nutrimentos de Murashige y Skoog (MS) (1962) (Anexo 1) enriquecido con Tiamina HCI (0,1 mg/l), míoinositol (100 mg/l) y sacarosa (30 911). Se aplicó AIA (ácido indol acético), AIB (ácido indol butírico) o ANA (ácido naftalen acético) a concentraciones de 0,2, 1,0 6 3,0 mg/l según el tratamiento. El pH se ajustó entre 5,6 y 5,8 y se solidificó el medio con 7 g/l de agar DIFCO. Se agregaron 25 mi de medio en tubos de ensayo, cerrándose el tubo con un tapón de algodón y un forro externo de papel aluminio. Los tubos con los medios se esterilizaron en un autoclave a 1200C durante 20 minutos y luego fueron llevados a la cámara de flujo laminar, la cual fue tratada con alcohol a 750. El material utilizado para la manipulación fue previamente esterilizado. Los meristemas caulinares se descubrieron mediante la remoción del prófílo de las yemas, y de los primordios foliares más externos, hasta obtener un explante de menos de 1 mm. Se extrajo el meristema y se sembró sobre el medio de cultivo seleccionado, agregándose unas gotas de antioxidante Dietil ditio carbamato de sodio (DIECA) a la concentración de 2 911,y aplicadas con filtro miliporo (22 µm). Los tubos sembrados se mantuvieron a una temperatura promedio de 28 ± 20C colocándolos a la oscuridad durante 10 a 12 días. Luego fueron trasladados a la luz, a una intensidad promedio de 600 lux, producida por lámparas fluorescentes. A intervalos de 21 días después de la siembra se medía el tamaño del explante para luego transferirlo a medio fresco y así sucesivamente, por el tiempo que duró la experiencia, siempre respetando las condiciones de rigurosa asepsia. Los meristemas en los cuales se produjo solamente la organogénesis se trasladaron a un medio sin suplementación hormonal, favoreciendo la rizogénesis. Una vez obtenido el explante foliado (3-4 hojas) y enraizado, se transplantó a una maceta con tierra estéril, humedeciendo el suelo con las sales minerales utilizadas, diluidas en la proporción 4:1 con agua destilada estéril. Se cubrió la maceta con una bolsa plástica agujereada, la cual se retiró 15 días después del transplante. El suelo se humedeció con agua destilada cada tres días después del transplante y cada ocho días se humedeció con las sales mencionadas. Las plantas transplantadas se colocaron al aire libre, protegidas del sol directo, hasta que alcanzaron una altura aproximada de 20 cm cuando fueron trasladadas al campo. Para analizar los resultados, se utilizó el modelo completamente aleatorizado, en el cual se transformaron los datos reales mediante la expresión X + 0,5, donde x es la diferencia de altura a los 42 días. La transformación se hizo para normalizar la distribución de los datos y tener un mejor estimado para la varianza (Steel y Torrey, 1980). Se realizó el análisis para cada cultivar por separado, debido a la alta variabilidad genética existente entre ellos, lo cual hace casi imposible establecer comparaciones sobre la misma base. RESULTADOS Y DISCUSIÓN I. Cultivar V
64-10. Con 0,2 mg AIA/I se indujo la formación de callo, el cual no llegó a diferenciarse. Esta concentración estaría entre los rangos adecuados para la formación de callo). Así, el AIA iniciaría el proceso de la división celular, el cual se complementaría en su fase final con la acción de las citocininas endógenas (Kosthumus, 1971). Estas irán disminuyendo, al no haber reposición de las mismas, hasta un nivel en el cual el proceso no puede continuar y el callo detendrá su crecimiento. Los meristemas sembrados sobre el medio de cultivo conteniendo 3,0 mg AIA/I regeneraron plantitas enteras en el mismo medio, lo cual se consideran los mejores resultados. Con este medio se cumplió a cabalidad el proceso de la rizogénesis. Posiblemente la cantidad de auxinas sintetizadas en las hojas (principal sitio de síntesis), unida a la dosis de esta sustancia de crecimiento presente en el medio, van a ser suficientes para inducir la rizogénesis. El tratamiento con 1,0 mg ANA/I solamente desarrolló hojas y fue necesario transferir los explantes a un medio sin sustancia de crecimiento, para producir la rizogénesis. Esto confirma los resultados encontrados por Nadar y Heinz (1977), quienes encontraron un efecto inhibitorio del ANA sobre la rizogénesis. II. B 6749.
una coloración cremosa y de aspecto transparente. Esto pudo ser debido a la acción inhibitorio de los compuestos fenólicos presentes en este cultivar. Por otro lado, los meristemas caulinares de caña parecen ser poco sensibles a la aplicación de auxinas exógenas (Levan, 1939; Pizzolato y Reglter, 1979 y Bonnel, 1980). Esto hace pensar en el AIB como un factor importante para el éxito de la obtención de plantas a partir del cultivo de meristemas in vitro de este cultivar. Usando las concentraciones apropiadas para esta auxina, se reduciría la formación de callos, los cuales no son demasiado dados a que induzcan variaciones fenotípicas y/o genotípicas de las plantas obtenidas (Heinz y Mee, 1969; Liu, 1 981). IIl. PR 61632. Los meristemas sembrados en medio conteniendo las dosis de 0,2 y 1,0 mg AIA/I produjeron la formación de callo, el cual creció durante tres a cuatro semanas, sin llegar a la organogénesis. Esto hace pensar que las dosis señaladas, para el cultivar PR 61632, se encuentran en los niveles adecuados para la formación de callo. Las concentraciones de auxinas (exógena y endógena) producirían esa estructura callosa y posiblemente al ser ésta de más fácil degradación por los sistemas enzimáticos, va a agotar la cantidad (en exceso y normal) existente, deteniéndose la multiplicación celular (Posthumus, 1971; Chausat y Courduroux, 1980). Además, se debe tomar en cuenta que las enzimas degradadoras del AIA, especialmente las más eficientes: peroxidasas (Gaspar y col., 1982; Heller, 1977; Teisson, 1977) se encuentran a una concentración elevada en los meristemas de caña de azúcar (Bonazzi, 1933); más aun, el AIA es fácilmente degradado por la luz y altas temperaturas (Heller, 1977). Esta degradación produce un balance citocinina/auxina elevado, el cual favorece la formación de callo (Skoog, 1971). Con la dosis de 3,0 mg AIA/1 se formaron plantitas enteras sin recurrir al traslado del explante foliado a un medio sin auxina. Probablemente la mayor cantidad de auxina aplicada no afecta la eficiencia de los sistemas enzimáticos ya mencionados, haciendo al balance citocinina/auxina favorable a la organogénesis (Skoog y Miller, 1957). Una vez formada la parte aérea, favorecida además por la exposición a la luz, ocurrió la rizogénesis. Los tratamientos con AIB indican que 1,0 mg/I y 3,0 indujeron la formación de explantes foliados, los cuales desarrollaron raíces cuando fueron cambiados a un medio simple (sin sustancia de crecimiento). Es de hacer notar que la rizogénesis se realizó más lentamente al compararlo con el efecto producido por el ANA. Tampoco se observó la formación de callo (Figura l).
El ANA, aplicado ex6genamente, solo provocó la formación de callo al tenor de 0,2 mg/I. Iguales resultados fueron obtenidos por Lyrene (1976); Hain y Col., (1977); Alfonso y Capote (1980). Posteriormente, sobre los callos formados se desarrollaron hojas. Los explantes foliados fueron colocados sobre un medio simple, con el objeto de inducir la rizogénesis; lo cual se produjo siete días después del repicaje. Este efecto inhibidor del ANA sobre la rizogénesis fue señalado por Nadar y Heinz (1977).
IV. PR 62258. El tratamiento con 3,0 mg ANA/I solo permitió un incremento en pocos milímetros del tamaño del explante, sin desarrollar estructuras. Esto se puede asociar con un efecto inhibitorio de la sustancia de crecimiento a esa concentración. El ANA a dosis bajas (0,2 mg/I) indujo un pequeño aumento de tamaño en los explantes. A la concentración de 1,0 mg/l se produjo callo, sobre el cual se desarrollaron brotes aéreos, siendo necesario su traslado a medio sin sustancia de crecimiento, para favorecer la rizogénesis. La organogénesis se produjo a partir de pequeñas zonas del callo, confirmando lo encontrado por Heinz (1973), quien obtuvo formación de plantitas de caña de azúcar a partir de células simples o pequeñas masas de células que se encuentran sobre el callo. La ocurrencia de la organogénesis hace pensar en un balance citocinina/auxina favorable a la citocinina. En los tratamientos con AIB la respuesta fue muy diferente según la concentración. Con 0,2 mg AIB/I se formaron explantes foliados, regenerándose la plantita completa al cambiarla a un medio simple (sin sustancias de crecimiento). No hubo formación de callo, posiblemente debido a la estabilidad de esta sustancia de crecimiento. En el medio conteniendo 1,0 mg AIB/I, los explantes produjeron callo, sin lograr la formación de órganos; posiblemente la elevada concentración de esta auxina, moderadamente estable, resultó suficiente para inducir la división celular acelerada y la formación de una masa indiferenciado de células (Liu y Chen, 1974; Steward y col., 1958), manteniendo el callo en condiciones no morfogénicas. Resultados similares fueron encontrados por Bonnel (1980), cuando aplicó al medio de cultivo ANA o 2,4-D. El tratamiento con 3,0 mg/I, produjo un aumento en el tamaño de los explantes sin ningún tipo de diferenciación, lo cual podría ser el efecto de los compuestos fen6licos, así como a las condiciones propias del explante. En el mismo orden de ideas, se ha señalado la baja sensibilidad de los meristemas de algunas monocotiledóneas a la acción de auxinas exógenas (Bonnel, 1980); los daños producidos en el meristema al separarlo del resto de la planta y su exposición directa sobre el medio de cultivo conteniendo nutrimentos, auxinas y otros compuestos químicos, pueden actuar negativamente sobre el explante (Heinz y col., 1977). Tal efecto puede acentuarse con el medio de cultivo (MS) utilizado en esta investigación (Barba y Nickell, 1969). La aplicación de AIA a 0,3 y 1,0 mg/l indujo la formación de callo. Las bajas concentraciones de AIA parecen ser las más indicadas para la callogónesis, quizás por un balance citocinina/auxina, muy elevado (Skoog, 1971). Con 3,0 mg AIA/I se formaron plantitas enteras, manteniendo siempre al explante con los mismos componentes. CONCLUSIONES De los resultados obtenidos se hace evidente la importancia del tipo y concentración de la auxina utilizada, pues su efecto varía de acuerdo a esos factores. Con 1,0 mg/l de ANA se logró regenerar plantas sobre un callo, lo cual ha sido señalado como posible fuente de variabilidad genética (Heinz y Mee, 1969; Liu, 1981). El AIB a bajas concentraciones logró formar plantitas
aparentemente idénticas a la planta madre. Concentraciones bajas de AIA formaron callos sin su posterior diferenciación, pero 3,0 mg/l regeneró plantitas presuntamente semejantes a la planta madre, sin necesidad de hacer transferencias a medios simples. En cuanto al comportamiento de los cultivares utilizados se tiene que para V 64-10, pueden usarse dosis de AIA cercanas a 3,0 mg/l; para B 6749 se recomienda el uso de AIB a fin de regenerar plantitas; para PR 61632 los mejores resultados se obtuvieron con 3,0 mg/l de AIA y 1,0 mg/l de AIB, siendo este último de lento y problemático enraizamiento. Para PR 62258 funcionaron mejor el AIB a dosis bajas y el AIA a 3,0 y 0,2 mg/I. BIBLIOGRAFÍA 1. ALFONSO, A. y CAPOTE, A. Cultivo de tejidos de caña de azúcar. Obtención y posterior regeneración de plantas in vitro. CIENCIAS DE LA AGRICULTURA. 6:29-34.1980. 2. BARBA, R. y NICKELL, L.G. Nutrition and organ differentiation in tissue cultures of sugarcane a monocotiledon. PLANTA. 89, 299302. 1969. 3. BONAZZY, A. Studies in sugarcane physiology. Oxidasies. Proc. Assoc. Sug. Tech. Cuba 7, 3-12. 1933. 4. BONELL, E. Evaluation anatomique et variabilite cytogenetique desimplants foliares de canne a sucre cultivos in vitro. These presentée a L'Universite de Paris. X l. Centre D'Ersay pour obtenir le Diplome de Docteur de Specialité D'ameloration des plantes. (3 emecycle) 96 PP. 1980. 5. CHAUSAT, R. y COURDUROUX, J.C. Regulateurs de croissance et multiplication vegetativo. p. 31-50. In: Chaussat, R. y Bigot, C. La multiplication vegetative de plants superieurs, Gauthver-Villards Paris. 227 p. 1980. 6. COLEMAN, R. y NICKELL, L. Stabillity of the flower stimulus. l. lsolated stem tips of sugarcane. NATURE. 301:941-942. 1964. 7. GASPAR, T.L., PENEL, CL., THORPE, T. y GREPPIN, H. Peroxidases 1970-1980: a survey of their biochemical and physiological roles higher plants. Universite de Geneve-Centre de Botanique. 1 er ed. Geneve. p. 1-132. 1982. 8. HEINZ, D.J. MEE, G.W.P. Plant differentiation from callus tissue of Saccharurn species. CROP. SCIENCE. 9(3):346-348. 1969. 9. HEINZ, D. Sugarcane improvement through induced mutation using vegetatives propagues and cell culture techniques. p. 53-59. INDUCED MUTATION INVEGETATIVE PROPAGATED PLANTS IAEA VIENA. St.1P.V.G./399. 1973. 10. HEINZ, D., KRISHNAMURTHI, M., NICKEIL, 1. y MARETZKI, A. Cell, tissue and organ culture in sugarcane improvement. PLANT CELL, tissue and organ culture. J. Reinhert and Y.P.S. Bajaj eds, Springer Veriag New York 1-1 7 p. 1977. 11. HELLER, R. ABREGES PHYSIOLOGIE VEGETABLE. 2. Developpement 2eme edition. Masson, Paris. 211 pp. 19771. 12. HENDRE, R.R., MASCARENHAS, A.F., NADGIR, A.L. et al: Growth of mosaic virus free sugarcane plants form apical meristems. INDIAN Phytopatology 28:175-178. 1975. 13. KRISHNAMURTHI, M. Sugarcane improvement through Tissue culture. PROC. 16 Congress lnt. Soc. of Sugarcane Techonologists. 23-28. 1977. 14. KRISHNAMURTHI, M. Sugarcane tissue culture, an example for crop improvement. Proceedings of the Internacional Workshop on improvement of tropical crops. Throwhg tissue culture. Dacca (Bangladesh) Bar.c., 1981 p. 12-18. lssued APR. 1982. 15. LEU, L.S. Freeing sugarcane from mosaic virus by apical meristem culture and tissue culture. Rep. Taiwan Sugar Expt. STAT 57, 57-63. 1972. 16. LEVAN, A. Cytogical phenomena connected with the root swelling caused by growth substances. Hereditas 25, 87-96. 1939. 17. LIU, M.C. In vitro methods applied to sugarcane improvement Plant Tissue Culture. Method and application in agricutlure. N.Y. (USA). Academic Press. p. 299-323. 1981. 18. LIU, M.C., CHEN, W.H. Tissue and cell culture as aid to sugarcane breeding. 1. Creation of genetic variation through callus culture. Euphytica, 25:393-403. 1974. |
|||||||||||||||
|
|