|
Caña de Azúcar, Vol. 05(2):43-66. 1987 INFLUENCIA DE LA TEMPERATURA EN EL
DESARROLLO DE Blas A. Linares F.** **FONAIAP
-Estación Experimental Portuguesa. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
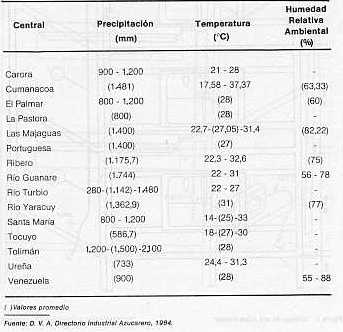
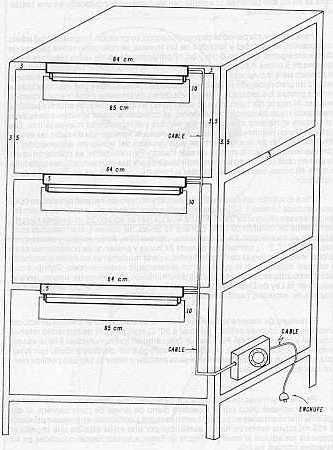
RESUMEN En vista de que Díatraea saccharaalís F. (Lepidóptera: Pyralídae), es la especie de taladrador de la caña de azúcar (Saccharum sp. ) de más amplio rango de distribución en América y en Venezuela, se le realizó un estudio para determinar la influencia de la temperatura sobre algunos parámetros biológicos en condiciones controladas de temperatura, humedad relativa ambiental y fotoperíodo (mantenimiento constante de los dos últimos). En general, se observó que al aumentar la temperatura de 26,06 a 30, 11° C, disminuyó la duración del desarrollo, mientras que a 35,50° C se produjo un retardo en el mismo. A 30, 11° C la duración del ciclo completo para la especie fue de 38,25 días para el macho y40,80días para la hembra; los máximos valores de fecundidad y fertilidad se obtuvieron a 36,06° C. Se detectó un número variable de instares larvales; no obstante, predominaron larvas con seis instares. Se pudo utilizar además, el diámetro de la cápsula cefálica para la determinación del instar larval respectivo mediante la aplicación de la Ley de Dyar. INFLUENCE OF TEMPERATURE ON THE DEVELOPMENT OF Diatraea saccharilis FABRICIUS ABSTRACT In view of the fact that Diatraea saccharalis F. (Lepidoptera: Pyralidae) is the specie of borer of the sugar cane (Saccharum sp.) of the most range of distribution in America and Venezuela, it was followed a study in order to determine the influence of the temperature upon some biological parameters in controlated conditions of temperature, relative humidity and photoperiod (maintaining constantthe lasttwo). ln general it was observed that the increase in temperature from 26.06 to 30.11°C, decreased the lenght of development, while that a temperature of 35.50° C produce a delay in the development. At the temperature of 30.11° C the duration of the life cicle of the specie was 38.25 days for the malle and 40.80 days for the female. The highest value of fecundity and fertility were obtained at 36.06° C. lt was observed a variable number of larval instars, however the larval with six instars were the predominant. Also it was possible to apply the Dyar.s rule using the diameter of the cephalic capsule for the determination of the larval instars. INTRODUCCIÓN El taladrador de la caña de azúcar Diatraea saccharalis Fabricius, es la especie de más amplio rango de distribución en América. Se localiza desde los Estados Unidos hasta el río de La Plata (Argentina), incluyendo las Antillas (1). Igualmente, se observa en Venezuela una amplia distribución por todas las áreas cultivadas de caña de azúcar. Por esta razón, es una de las pocas especies a la cual se le ha estudiado la biología con detalle. Para Venezuela sólo se cuenta con información procedente de investigaciones preliminares de hace más de 35 años realizadas por Box y Guagliumi (2, 6). Otra razón por la cual se realizó el estudio de biología, es la de constituir el huésped nativo de la mosca amazónica Metagonístylum mínense (Díptera: Tachínídae), por lo que la cría artificial de tal parásito en el laboratorio se realiza sobre ésta. La información preliminar sobre la biología, para permitir el establecimiento de la cría masiva del parásito en Venezuela, tuvo como base información referida por Pan (11); Walker (15); Hensley (8); Dinther (5); Risco (12) y King (10), procedente en su mayoría de otras latitudes. De allí que se hace necesario logar información más precisa en nuestro medio que permita a su vez, mayor eficiencia en la producción de parásitos tales como M. mínense, Cotesía sp. y Allorhogas pyralophagus, utilizando como huésped a D. saccharalís F. Por otra parte, estos estudios básicos ayudarían a comprender la biología y comportamiento de esta especie a nivel de campo, permitiendo fijar las pautas para continuar con el estudio de otras especies como D. rosa y D. busckella, cuya importancia económica en el país se acentúa. MATERIALES Y MÉTODOS El trabajo se realizó en el Laboratorio de Servicio Biológico, S. A. L., ubicado en Chorobobo, distrito Palavecino, estado Lara, Venezuela. Se condujo en condiciones controladas de temperatura, fotoperíodo (12 horas luz -12 horas oscuridad) y humedad relativa ambiental. Los dos últimos factores se mantuvieron constantes, mientras que las temperaturas se seleccionaron con base a las observadas a nivel de campo con las áreas cultivadas con caña de azúcar en el país (ver Cuadro 1) y las posibilidades climáticas ofrecidas por el laboratorio. Para tal fin fueron construidas tres cámaras de poliuretano (anime) en una armadura metálica cuyos detalles y diseño se muestran en las Figuras 1 y 2. La temperatura fue regulada en cada cámara mediante termostatos de pecera Hagen Radiant Plus(R) (115-120 v, 75 w) a los cuales se le eliminaron las respectivas resistencias calentadoras y los contactos libres fueron unidos a bombillas tipo vela, color rojo (125-130 v, 25 w). El fotoperíodo fue controlado, simultáneamente para las tres cámaras, mediante un interruptor de tiempo de 24 horas Sears(R) (125 v, 125 w) conectado a tres lámparas de luz blanca colocadas externamente (una para cada cámara) Duralux F20 TR DL. La humedad relativa ambiental fue suministrada mediante láminas de goma-espuma embebidas en agua destilada y renovadas cada siete días. Se llevó registro de humedad en forma rotativa (24 horas en cada cámara) mediante un termohigrógrafo semanal Serdex(R). La temperatura fue tomada por medio de un termómetro de máxima y mínima, el cual fue rotado con la misma frecuencia en las tres cámaras. El estante con las cámaras fue colocado en una habitación en oscuridad total.
Para estudiar los períodos de preoviposición, oviposición, longevidad del adulto y la duración, fecundidad y fertilidad de los huevos, se colocaron veinte parejas de adultos emergidos, entre las 6 pm y las 12 pm dentro de veinte vasos plásticos transparentes de 5 onzas. A cada vaso se le colocó en su interior papel parafinado doblado en abanico para la oviposición de la hembra (Figura 3). Con el objeto de determinar el período de preoviposición se realizaron observaciones diarias y una vez detectada la primera postura fue separada y mantenida dentro de la misma cámara en los mismos envases. Al cuarto día cuando ya se observó el cambio de color de amarillo pálido a anaranjado rojizo (desarrollo del embrión), se comenzó a contar el número de huevos por postura, el número de posturas por hembra y el numereo de huevos fértiles. Las posturas fueron mantenidas en observación hasta la emergencia de todas las larvas. Simultáneamente se llevó registro de la longevidad del adulto sin alimentación, tal como se realiza en la cría masiva de este insecto. Paralelamente, se colocaron cinco parejas en cada cámara en envases individuales para hacer observaciones cada hora durante 48 horas, con el fin de detectar la hora de cópula y hora de comienzo de la oviposición. Para el estudio del período de desarrollo y número de instares larvales. se colocaron en cada cámara 1.120 larvas emergidas durante la noche. a razón de cuatro larvas por envase plástico de 29 mI (Figura 4), a los que se agregó 25 ml de dieta King (8). Diariamente se retiraron de cada cámara 18 larvas. las cuales fueron matadas colocándolas en en solución KAAD (kerosene, alcohol 95%, ácido acético y dioxano) en proporción 1:7:2:1, mantenidas durante 24 horas y preservadas posteriormente en alcohol 95%. A las larvas correspondientes a cada muestreo se les midió el ancho de la cápsula cefálica con la ayuda de un microscopio estereoscópico Olympus con micrómetro adaptado al ocular, para la determinación del número de instares larvales basado en la Ley de Dyar (5). Las observaciones se mantuvieron por veintiséis días, después de iniciadas, hasta la formación de pupas. El número de instares larvales fue además estudiado por el método directo de detección de la cápsula cefálica residual a 300 C, más de 70% de humedad relativa ambiental y oscuridad total. Para ello se colocaron en forma individual 216 larvas en envases plásticos de 21 mI a los que se les agregó 5 mI de dieta artificial tipo King. Cada envase fue revisado diariamente para detectar y retirar la cápsula cefálica residual indicativa del cambio de instar. Para la determinación de la duración de la fase pupa, se separaron las prepupas en número variable dado por el muestreo diario de larvas de cada cámara. Al día siguiente (transformadas en pupas) fueron sexadas y colocadas en envases plásticos de 450 ml, cuyos extremos fueron sustituidos por una malla plástica que impidió el escape de los adultos al emerger (Figura 5). Estas, a su vez, fueron colocadas en su respectiva cámara de cría.
RESULTADOS Y DISCUSIÓN Las condiciones de humedad y temperatura registradas en cada una de las cámaras de cría, fueron de 26,06; 30, 11 y 35,50° C, respectivamente, tal como se indica en el Cuadro 2. De igual manera, en el Cuadro 3 pueden observarse valores de humedad relativa ambiental de 77,36; 78,25 y 64,51% correspondientes a cada una de las cámaras. En la cámara 3 la temperatura de funcionamiento condicionó una menor humedad relativa.
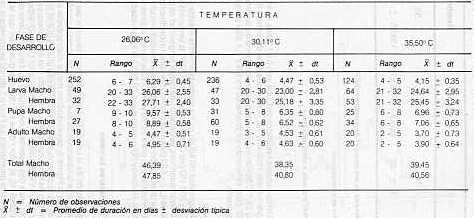
Duración de las diferentes fases de desarrollo Huevo La duración de esta fase se acortó con el incremento de la temperatura, tal como lo señala el Cuadro 4. Así, en las temperaturas de 26,06; 30,11 y 33,50°C el período de desarrollo fue de 6,29; 4,47 y 4,15 días, respectivamente. King (8) observó que a 26 y 30°C la duración fue de 5, 7 y 4,7 días, respectivamente, mientras que a 34°C se produjo el retardo en el desarrollo. Box señaló un período de 5,5 ~ 7 ,5 días (2). Guagliumi (6) indicó de 5 a 10 días de duración para esta fase. Holloway (7) obtuvo 6 días de desarrollo a 26,06° C, y temperaturas por encima de éstas redujeron la duración del desarrollo, pero no estudió temperaturas superiores a 30° C. Larva Se observó una disminución en el período de desarrollo larval al incrementar la temperatura de 26,06 a 30,11° C, mientras que a 35,50° C se produjo retardo en el desarrollo (ver Cuadro 4). Se observa mayor período de desarrollo para la hembra. A 30,11° C se produce una duración de 23,00 y 25,18 días en macho y hembra, respectivamente. Brewer (3), a 26 + 1°C, 50 + 5% de H.R. y 14,10 L:D de fotoperíodo, obtuvo 20,8 días de duración de desarrollo criado en dieta King, y en una repetición del experimento bajo las mismas condiciones logró 26,4 días. King (10), detectó una duración de uno o dos días para la hembra; a temperaturas superiores a 32aC retardo en el desarrollo ya 34°C el desarrollo fue nulo, igualmente, detectó a temperaturas inferiores una tendencia a disminución de la duración del desarrollo con el incremento de temperaturas. Box (2), obtuvo valores entre 30 y 40 días para la duración de la fase larval criadas en tallos de caña de azúcar. Vreugdenhil*, señala que esta especie cuando se cría en jojoto de maíz tiene de 18 a 21 días de duración larval. Holloway (9), trabajando en condiciones de cuatro estaciones anuales, señala para esta fase entre 20 y 30 días en el período de verano y de 30 a 35 días en condiciones de invierno, pudiendo observar hasta 275 días de desarrollo en los períodos más críticos del año; al estudiar el efecto de la temperatura, sus resultados fueron bastante variables: a 15aC o menos se alargó el período de desarrollo, mientras que a 26,30°C, obtuvo 24 días. Pupa La tendencia general en la duración del desarrollo es similar a la observada en la fase anterior, con una disminución en la duración al pasar de 26,06 a 30,11°C con un retardo a 35,50°C. Igualmente, se observó que la hembra tiene un mayor período de desarrollo, así a 30, 11°C se observó una duración de 6,35 y 6,25 días en macho y hembra, respectivamente (ver Cuadro 4). La mayor duración observada para la hembra podría tener relación con el peso adquirido por ésta, tal como se denota en el Cuadro 5. A 30°C, que es la condición normal de cría en el laboratorio, se obtuvo valores de 86,33 y 139,95 mg para macho y hembra, respectivamente. King (10), obtuvo a 26°C una duración de 8,2 a 8,3 días para macho y hembra, respectivamente, a 30°C, 7 y 6,9 días para macho y hembra. A partir de 30°C detectó retardo en el desarrollo con cero desarrollo a 34°C. Box (2), señaló una duración para esta fase entre 7 y 10 días por información de trabajos realizados en Cuba y de 6 a 11 días, en experimentos preliminares en Venezuela. Holloway (9), señaló que si se disminuye la temperatura desde 27,3 hasta 25,1 °C hay un incremento proporcional en la duración del desarrollo desde 6 hasta 22 días, señalando un promedio de 8,8 y 8,4 días para machos y hembras, respectivamente. *Vreugdenhil, Arie. C. A. Agrícola Yaritagua. Yaritagua, estado Yaracuy, 1986 (comunicación personal).
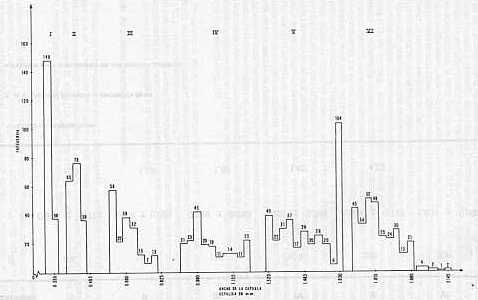
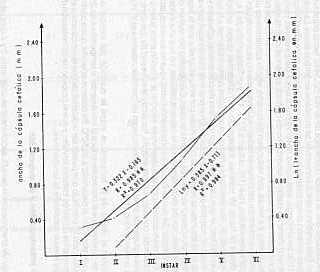
Adulto La longevidad del adulto no fue afectada en forma notable por las temperaturas entre 26,06 y 30.11°C (ver Cuadro 4), pero a 35,50°C la longevidad disminuyó. Al igual que en las fases anteriores, se detectó una mayor longevidad en la hembra. A 30°C, la misma fue de 4,53 y 4,63 días para macho y hembra, respectivamente. King (1 o), logró observar una disminución en la longevidad de la hembra con un incremento de 1 día al estudiar temperaturas entre 26, 30 y 34°C; obteniendo valores variables de longevidad por sexo. Holloway (9), reportó que a 28,28°C, la longevidad del adulto fue de 4,7 días. Número de Instares larvales La aplicación de la Ley de Dyar para la determinación del número de instares larvales condujo a la obtención de seis instares, tal como lo muestra el histograma de frecuencias en la Figura 6. observándose mayor discrepancia entre ellos hasta el V instar larval. No se observa traslape entre los seis grupos que se indican en el histograma. El diámetro de la cápsula cefálica de cada uno de los instares larvales se muestra en el Cuadro 6. En este mismo se presenta el valor r que corresponde a la relación de crecimiento entre dos instares sucesivos. el cual mostró cierta variación. Según Gaines y Campbell (6), el valor r debe mantenerse igual para que la tasa de crecimiento sea perfectamente geométrica. La Figura 7. donde se muestra la relación entre el estadio larval (X) y el ancho de la cápsula cefálica (V), dio una recta de regresión.
Utilizando los valores normales de ancho de la cápsula cefálica esta fue: Y = 0,322X 0,165 con un coeficiente de determinación (R2) de 0,970. Transformando logarítmicamente los mencionados valores, la recta fue: Iny = 0,358X 0,713 con un R2 de 0,994, el cual Corrobora su alto valor productivo para estimar el instar larval de este insecto. La aplicación del método directo (detección y colecta de la cápsula cefálica residual) condujo a determinar un número variable de instares larvales para esta especie a 30°C (ver Cuadro 7), detectándose que el mayor porcentaje de larvas (52,54%) forma pupa en el VI instar larval. Esta predominancia porcentual se mantiene en ambos sexos. La mayoría de los autores señalan cinco instares larvales para esta especie, entre ellos Guagliumi (7) y King (10); sin embargo, este último observó hasta seis y siete instares. Holloway (9), detectó un mínimo de cuatro a un máximo de catorce, en larvas invernantes. Este mismo autor detectó que a bajas temperaturas la larva continúa mudando con poco o ningún crecimiento, ya veces, con reducción de tamaño, efecto similarmente observado durante la conducción del presente trabajo en larvas que no se alimentaban en la dieta artificial suministrada. Roe (13), obtuvo a 27 + 1°C y un fotoperíodo de 14:10 L.D., larvas desde IV hasta VII instares, trabajando con diferentes dietas artificiales. Gaines y Campbell (6), han señalado entre otros aspectos como limitantes a la aplicación de la Ley de Oyar, el que cada sexo tenga una tasa de crecimiento diferente y que la especie tenga un número de instares variable. En el presente trabajo se observa que la tendencia en la abundancia relativa de cada instar por sexo es igual y que la especie realmente tiene un número variable de instares larvales. Esto explica por qué en el histograma de frecuencias de dimensiones de la cápsula cefálica, no hay una evidencia clara para un VI instar. Se puede indicar en el presente trabajo que no es descartable la aplicación de la mencionada Ley, si el objetivo es estudiar la relación entre la temperatura y la duración del Correspondiente estadio, haciendo la salvedad de que dentro de los individuos agrupados en el VI instar se incluyen los Correspondientes al V, VI y VII, tal como lo presenta King (10). En cuanto al efecto de la temperatura sobre la duración del estadio larval (Cuadro 8), se observa que el mismo se reduce al incrementar la temperatura de 26,06 a 30, 11°C, y un retardo en el desarrollo a 35,50°C. Se observa además, que a partir del V instar esta relación se pierde, lo que puede ser indicativo de que la temperatura afecta principalmente los primeros instares larvales y que el proceso de aclimatación de la larva, la hace menos sensible a la temperatura. Período de preoviposición y de oviposición El rango de preoviposición para D. saccharalis se sitúa entre 2 y 4 días, observándose que un incremento en la temperatura alarga sensiblemente este período y comenzando la oviposición por lo menos al segundo día después de la emergencia del adulto (ver Cuadro 9). King (10), logró un período de preoviposición de dos días con un rango desde 1,9 días a 24°C hasta 2,4 días a 30°C. Realizando observaciones cada hora en cinco parejas desde su emergencia, no se detectó a 26,06 y 30,11 °C un lapso de tiempo definido de cópula y de oviposición posterior a la cópula. Prácticamente, hubo actividad durante toda la noche. Se detectó como condición normal una cópula por pareja; sin embargo, en algunos casos se observaron hasta dos cópulas en un lapso de 48 horas. No hubo una hora de cópula preferentemente detectada. Entre las observadas estuvieron las 8, 9, 10, 11 y 12 pm, así como a las 3 y 5 am.
dt = Desviación típica
El período de oviposición se reduce a medida que se incrementa en la temperatura. Este período fue de 3,11 días a 30,11° C (ver Cuadro 10). Holloway (9), observó que la cópula era nocturna. Walker (14), notó que la cópula se realiza entre 8:30 y 9:30 pm, y que los huevos eran colocados de 7 a 8 horas después de la cópula. Fecundidad y Fertilidad La fecundidad y fertilidad disminuyen con el incremento de temperatura y con la edad del adulto. En general, a 26,06°C se obtienen los valores más altos para los parámetros señalados, tal como se detalla en el Cuadro 11 (538,60 huevos por hembra con valores de fertilidad de 99,60; 99,71 ; 78,29 y 50,03% al segundo, tercero, cuarto y quinto día, respectivamente). A 35,50°C de temperatura la fecundidad y la fertilidad se ven notablemente afectadas a medida que se hacen más viejas. King (10), trabajando a 26, 30 y 34°C, obtuvo valores de fertilidad de 98,6 ; 93,3 y 10,0%, respectivamente; mientras que a 35°C no logró desarrollo. El óptimo de fertilidad en su experimento fue de 24°C con un promedio de 729,8 huevos por hembra. En cuanto a posturas y huevos depositados, se determinó que el número de huevos por postura es bastante variable (ver Cuadro 12). En este cuadro se indica el número de posturas colocadas por hembra en un muestreo de cinco adultos, el cual varía entre 16 y 29 posturas por hembra para un promedio de 22,80. Holloway (9), afirmó que una hembra oviposita de 2 a 3 hasta 50 y más huevos por postura. Guagliumi (7), señaló que una hembra ovipone de 5 a 7 hasta 15 o más huevos por postura y unos 500 huevos por hembra. Hora de emergencia de los Adultos La hora de emergencia .de los adultos determinada durante 48 horas de observación continua, se muestra entre las 6 y las 12 pm, realizándose preferentemente entre las 7 y las 11 pm. El período en el cual se registra menor emergencia, es entre las 6 am y las 12 m. Además, se observa diferencia entre los sexos, ya que hay un mayor número de machos emergidos entre las 7 y 8 pm; mientras que para las hembras este período se sitúa entre las 10 y 11 pm. Esto último podría tener relación con la mayor longevidad de la hembra en su fase de pupa. Box (2), señaló que la emergencia del adulto se produce entre las 7 y 8:30 pm. La proporción sexual para machos y hembras respectivamente, observada en D. saccharalis, fue de 1: 0,87, tal como se indica en el Cuadro 14. Des Vignes (4), determinó una proporción sexual de 1,50: 1 para machos y hembras, respectivamente, en esta especie de taladrador.
BIBLIOGRAFÍA 1. BOX, H. E Informe preliminar sobre los taladores de la caña de azúcar (Diatraea spp.) en Venezuela. Bol. Técnico, MAC. Dpto. Entomología. Secc. Caña de Azúcar. Diciembre, 1947 p. 2. BOX, H. E. Investigaciones sobre los taladores de la caña de azúcar (Diatraea spp.) en venezuela. Informe del progreso durante 1947-1949 MAC. Direc. Agricultura. Div. Entomología y Zoología. Bol. Técnico No. 2. Septiembre, 1949. 60 p. 3. BREWER, F. D. Development of the sugar cane borer on varius artificial diets. Agric. Res. Serv., U.S. Dep. Agric. June, 1976. 6 p. 4. DES VIGNES, W.G.I. Estudios sobre la tabla de mortalidad de Diatraea caña de azúcar en Trinidad. Congress of the iscct, 18. La Habana Proceedings V.2. p. 661-671. 1984. 5. DINTERTHER, J. B. M.; Van and P. A. GOOSSENS. Rearing of Diatraea saccharalis on diet in Surinan. Entomol. Exp. Appl. 13: 320-326. 1970. 6. GAINES, J.R. y F.L CAMPBELL Dyar's rule as related to the number of instars of the corn ear worm Heliothis absoleta (Fab.), collected in the field. Ann. Entomol. Soc. Amer. 28: 445-461. 1935. 7. GUAGLlUMI,P. Las plagas de la caña de azúcar en Venezuela. Tomo l, MAC-CIA. Maracay, Venezuela. 1962. 482 p. 8. HENSLEY, S. D. and A.M. HAMMOND, Jr. Laboratory Techniques for rearing the sugar cane borer on an artificial diet. J. Econ. Entomol. 6: 1742: 43. 1968. 9. HOLLOWAY. T. E. The sugar cane moth borer in the United State. Tech. Bull. U. S. Dpt. Agriculture. No.41. 1928. 77 p. 10. KING, E. G.; F. D. BREWER and . E. MARTIN. Development of the Diatraea saccharalis (Lep.: Pyralidae) at constant temperatures. Entomophaga 20 (3): 301-306. 1975. 11. PAN, Y. S. and W. H. LONG. Diets for rearing the sugar cane borer. J. Econ. Entomol. 54: 257-261. 1961. 12. RISCO, S. H.; N. MORALES y G. AYQUIPA. Una dieta artificial para la crianza masiva de orugas del borer de la caña de azúcar: Diatraea saccharslis Fabr. (Lep.: Crambidae ). Instituto Central de Investigaciones Azucareras. Casa Grande. Perú. 1973. 42 p. 13. ROE, R. M.; A. M. HAMMOND, J. R. and T. C. SPARKS. Growth of larvae Diatraea saccharalis (Lepidóptera: pyralidae) on an artificial diet and synchronization of the last larval stadium. Ent. Soc. America. 75 (4): 421- 429. 1982. 14. WALKER, D. W. Bionomics of the sugar cane borer Diatraea saccharalis (Fab.) I. A descripcion of the mating behavior. (Lepidóptera: Crambidae). Proc. Ent. Soc. Wash., 67 (2): 80-83. 1965. 15. WALKER, D. W.; V. QUINTANA,; F. PADOVANI and K. S. HAGEN. Improved xenic diets for rearing the sugar cane borer in Puerto Rico. J. Econ. EntomoI. 59: 1-4. 1966. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||