|
Caña de Azúcar, Vol. 10(2): 51-59. 1992 ESTUDIO COMPARATIVO DE
LA PROPAGACIÓN in vitro Y POR ESTACAS EN CUATRO Ignacio Santana*, Odalis Nodarse* y Zuleika Fernández* *Instituto
Nacional de la Caña de Azúcar. INICA G.P. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
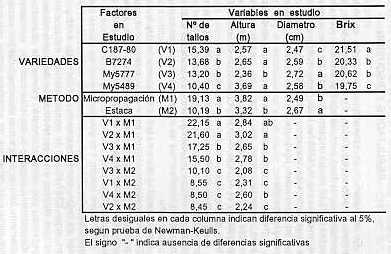
RESUMEN Los métodos de micro propagación in vitro y propagación agámica por estacas fueron estudiados comparativamente para las variedades de caña de azúcar C187-80, B7274, MY 5777 y MY 5489. Mediante el primer método, partiendo de un meristemo apical se obtuvieron 500 planticas por variedad. Después de una selección negativa, las planticas restantes fueron transferidas a bolsas de polietileno conteniendo una mezcla de suelo y posteriormente fueron colocadas en condiciones de vivero. Dos meses más tarde y después de otra selección negativa, se transplantaron al campo y simultáneamente se sembraron estacas de las mismas variedades, en idénticas condiciones. Cien cepas de las plantas endurecidas y cien de las agámicas fueron estudiadas, observándose características morfológicas (altura, grosor y número de tallos) y de rendimiento (Brix). Los datos fueron evaluados mediante el análisis de componentes principales y factoriales de correspondencia simple Los resultados muestran un incremento significativo de la altura y el número de tallos para el método de micro propagación y de diámetro de tallo para la propagación agámica. El Brix no presentó variaciones entre los métodos estudiados. INTRODUCCIÓN El azúcar, alimento energético primario, está entre los principales renglones agrícolas estudiados por los hombres de Ciencia. Su fuente más conocida es por medio del cultivo de la caña de azúcar. La búsqueda de mayores rendimientos permite contar con un numeroso grupo de nuevas variedades, las cuales son requeridas de inmediato para su explotación comercial. Pero esto tiene una limitación. el tiempo que media entre la producción de una nueva variedad y su explotación comercial es marcadamente largo si se utilizan los métodos tradicionales de propagación por estacas. Además del tiempo, se considera que esas nuevas variedades han sufrido un proceso degenerativo antes de comenzarse su explotación, debido principalmente a la continua contaminación en el campo durante la multiplicación (4). Los procedimientos para acelerar la reproducción de la caña de azúcar toman cada vez mayor importancia. Las plantas propagadas in vitro generalmente presentan un mayor crecimiento y vigor, produciendo semillas de alta calidad (10). En caña de azúcar, Anderlini y Kostka (1) encontraron aumento en los rendimientos entre 12 y 14%, al emplear semillas obtenidas de plantas micro propagadas de la variedad CP 65357 Pérez y Rodríguez (6) consiguieron incrementos en el número de tallos entre 5 y 30% cuando trabajaron con plantas micro propagadas de los soluciones UCL V159-84, UCLV103-84, UCLV86-84 y CP5243. Un factor de gran importancia en la reproducción es el coeficiente de multiplicación que se alcanza con la micro propagación, pudiéndose obtener numerosas plantas a partir de un solo meristemo, en cuestión de varios meses. Para caña de azúcar, se plantea la posibilidad de obtener 10.000 plantitas por año, a partir de un meristemo (3,9). Hendre et al. (2) reportan que se pueden producir 200.000 plantitas en seis meses; mientras que Lee (4) afirma que potencialmente esa cantidad se puede duplicar para el mismo tiempo, siempre partiendo de un solo individuo. El objetivo del presente estudio fue el de comparar la micro propagación con la propagación tradicional por estacas, en cuatro variedades de caña de azúcar, tomando como referencia algunos parámetros morfológicos y de producción. MATERIALES Y MÉTODOS Este trabajo se efectuó en la EPICA " Antonio Mesa ", ubicado en la provincia de Matanzas, Cuba, con las variedades C187-80, 87274, My5777 y My5489. Se realizó una selección fenotípica y bioquímica (electroforesis de peroxidasas} para homogeneizar el material a utilizar. De plantas de seis meses de edad de cada variedad, se tomaron explantes que contenían el ápice meristemático. Los explantes fueron esterilizados con alcohol durante un minuto y flameados después durante varios segundos, tal como rutinariamente se hace con este tipo de material. Se extrajeron domos meristemáticos con diámetro de 2 y 3 mm, con 2-3 hojas primordiales (2) y se establecieron en el medio de Murashige y Skoog (MS) durante 30 días (5). El pH de los medios fue de 5,6 -5, 7 y la esterilización en autoclave a 12 °C y 1 atm de presión. Después fueron colocados en un medio de producción de hijos (RPI 96188), haciéndose tres subcultivos con intervalo de 30 días. En cada uno de los subcultivos se realizó una selección negativa de las plantas descartando las que se encontraron en mal estado, con rangos de clorosis y con multiyemas. Las planticas fueron colocadas para enraizar en un medio que contenía las sales minerales de MS, 40 g/l de sacarosa y 3 m g/l de ácido indolacético y mantenidas a temperatura de 25 °C e iluminancia de 3.000 lux, en forma continua. Todas las planticas obtenidas (500 por variedad) fueron sembradas en bolsas de polietileno conteniendo una mezcla de suelo conveniente y llevadas a vivero, donde se realizó otra selección negativa, principalmente de aquellas planticas que presentaron daños mecánicos. Dos meses después se llevaron al campo ya los 8 meses se les hizo un chequeo de color. Al mismo tiempo que las plantas micro propagadas fueron llevadas a campo, se plantaron las mismas variedades en forma agámica, a las cuales también se les chequeó el color. A todo el material plantado (micro propagación y estacas) se les observaron las características de la hoja TVD, la forma de las yemas y se les realizó análisis de electroforesis de peroxidasas, para identificar las plantas homogéneas y descartar las que presentaron variabilidad generada por propagación. Para comparar ambos métodos de producción de semillas, se midieron altura, diámetro y número de tallos y refractometría del jugo (Brix), en 100 cepas tomadas aleatoriamente. Los datos fueron evaluados por análisis de componentes principales y factoriales de correspondencia simple para el caso de las variables cuantitativas, empleando la prueba de medias de Newman-Keuls a un 5% de significación. RESULTADOS Y DISCUSIÓN En el cuadro 1 se observan los resultados obtenidos para las variables y factores estudiados. En número de tallos, se consiguió diferencias significativas para variedades, métodos y su interacción. La variedad C187-80 mostró un promedio de 15,39 tallos, ocupando el primer lugar, mientras que My 5489 fue la de menor número de tallos con 10,40. Las otras variedades ocuparon una posición intermedia La diferencia entre las variedades posiblemente esté dada por diversidad en su complejidad gen ética. El método de micro propagación difiere significativamente al de las estacas, tomando valores más altos. Los mismos resultados fueron obtenidos por Santana et al. (8) en comparación de métodos de propagación y al de otros autores (4, 7) cuando estudiaron Brix, número de tallos y altura de las variedades micro propagadas. Al analizar la interacción de variedad por método, se nota el gran aporte del método de micro propagación, llegando a representar más del doble que el método por estacas, en las variedades C187-80 y B7274. Esto indica el beneficio que se obtiene en esas variedades, cuando se propaga in vitro. Para la variable altura de tallos, las variedades My 5489, C187-80 y B7274 se mostraron iguales entre sí y superiores a My 5777. Las micro propagadas superaron estadística mente a las propagadas por estacas, con sustancial aporte a cada variedad en prueba, tal como se observa en la interacción. En el mismo cuadro 1 se pueden apreciar los valores obtenidos para diámetro de tallos. Para este parámetro, la variedad My 5777 fue la más gruesa de todas, siendo intermedias B7274 y My 5489 y ocupando el último lugar C187-80. En la comparación de métodos se consiguen diferencias distintas a los parámetros discutidos anteriormente. Aquí, la propagación por estacas mostró valores de diámetro de tallos significativamente superficie a los obtenidos con la micro propagación. Posiblemente esto se deba a que las propagadas por estacas tienen un menor número de tallos que los originados por el otro método. No se consiguieron diferencias en las interacciones. En cuanto a los grados Brix, hubo diferencias significativas atribuibles únicamente a las variedades, siendo C187-80 la de mayor valor, con resultados promedios de 21,51. Las variedades My 5777 (20,62) y B7274 (20,33) mostraron valores similares y de último quedó M y 5489 con 19, 75. Tanto métodos como las interacciones no presentaron diferencias estadísticas.
El cuadro 2 contiene los valores y vectores propios, producto del análisis del factorial de correspondencia simple para los cuatros componentes. Se observa un 95,1% de variabilidad entre los tres componentes principales, existiendo 47,8 % de variabilidad explicada en el primero y 69,2 % en el segundo componente Las variables que más influyeron en ambos componentes fueron el método de propagación y el número de tallos. El resto de las variables muestra poca influencia, excepto variedad, con influencia alta y positiva en el cuarto componente.
CONCLUSIONES 1. El método de micro propagación in vitro presenta mejores resultados que el de estacas, para la producción de semillas de caña de azúcar, sobre todo en la formación de tallos. 2. Las variedades responden diferencialmente ante la micro propagación. Igualmente el contenido de Brix es diferencial para cada variedad, independientemente del método de propagación. 3. Las selecciones negativas realizadas durante la implantación y desarrollo de las plantas micro propagadas, propiciaron que no existiera variabilidad en el material examinado, comportándose como una población homogénea para cada variedad.
The methods of micropropagation in vitro and agamic propagation by setts. were comparatively studied for the sugarcane varieties C187-80, B7274. MY 5777 and MY 5489. By the first method 500 plants were obtained from one apical meristem. These plants were later transferred to polyethylene bags and mantained under nursery conditions for two months. After a negative selection they were transplanted to the field and simultaneously the same varieties were sowed using the setts method under equal conditions. One hundred stools of each propagation were studied, observing morphological characteristics (height, width and number of stalks) and Brix. Data were evaluated by main components and simple correspondence factorial analysis. The results showed significant increase of height and number of stalks for micropropagation and of stalk diameter for agamic propagation. The Brix did not differ between the two evaluated method. BIBLIOGRAFÍA 1. ANDERLINI, T.A.; S.J. KOSTKA. 1986. Initial yield responses of Kleentek tissue culture produced seed cane in Louisiana. XIX ISSCT Congress Proc. 391 -401. 2. HENDRE, R.R.; B.R. LYER; M KOTIVAL; S.S. KHUSPE; A.F MASCARENHAS. 1983 Rapid multiplication of sugar cane by tissue culture. Sugar Cane N o 1 .5-8. 3. HU,C.V.; JP. WANG 1983. Meristem, shoot tip and bud culture. In.Handbook of plant Cell. Ed. by David A. Evans, W.R. Sharp; P.V. Amirato and V Vamada 4. LEE, T.S.G. 1986. Multiplication of sugar cane by apex culture. Turrialba 36 (2) .231 -236 5. MURASHIGE, T.; F. SKOOG. 1962. A revised medium for rapid growth and biossays with tobacco tissue culture. Physiol. Plant 15.473 -497 6. PÉREZ, V.; C. RODRÍGUEZ 1987. Producción de semillas propagadas. Apuntes para un libro de texto. Fac Ciencias Agrícolas Universidad Central Las Villas (Cuba). 7. PÉREZ, V et al 1968. Micro propagación de la caña de azúcar (sin publicar). Universidad Central las Villas (Cuba). 8. SANTANA A., I.; O. NODARSE; A. PÉREZ; L. GÓMEZ; A. J. RODRÍGUEZ 1992. Estudio de la variabilidad en la micro propagación de la caña de azúcar. Cuba Azúcar 26(1).10-14. 9. SAUVAIRE, D.; R. GALZY.1981. Propagation de la canne a sucre par bouturage in vitro. Action d' une auxine et d' une citokinine. L' Agronomie Tropicale 36 (1) 6369. 10. VASIL, I.K. 1980. Perspectives in plant cell and tissue culture. International Review of Citology Academic Press |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||