|
Caña de Azúcar, Vol. 14(1): 3-14. 1996 UTILIZACIÓN DEL α-BROMONAFTALENO EN LA INDUCCIÓN DE MUTACIONES EN CULTIVO DE TEJIDOS DE CAÑA DE AZÚCAR Ignacio Santana*, Odalis Nodarse*, A. Arencibia* y Ana J. Rodríguez* *INSTITUTO NACIONAL DE
INVESTIGACIONES DE LA CAÑA DE AZÚCAR (INICA) |
||||||
|
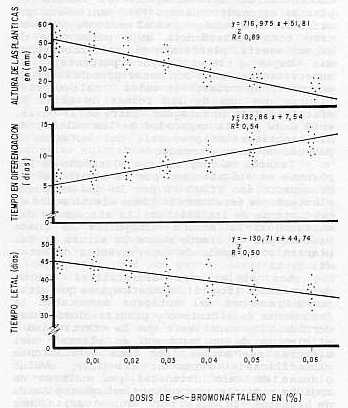
RESUMEN Se obtuvieron callos a partir de tejidos de la variedad C 127-78 en medio Payan suplementado con 5 mg/1 de 2,4-D y 18% de agua de coco; antes de la diferenciación se realizó un pase al mismo medio, pero con diferentes concentraciones de α-bromonaftaleno, desde 0,01-0,06%. Las variaciones clorofílicas, el efecto del mutágeno en la diferenciación, el tamaño de las plantas y la dosis letal fueron evaluadas, obteniéndose que estos factores disminuyen con el aumento de la concentración del mutágeno, siendo contrario el comportamiento del porcentaje de variaciones clorofílicas. Palabras Claves: Caña de mutación Azúcar, cultivo tejido, α-bromonaftaleno USE OF α-BROMONAPHTHALEN TO INDUCE MUTATIONS IN SUGARCANE TISSUE CULTURE ABSTRACT Callus obtained from C 127-78 sugarcane variety in a in vitro Payan medium supplemented with 5 mg/l 2,4-D and 18% coconut water, were treated with α-bromonaphthalen at seven different dose (from 0,00 to 0,06%) , prior the differentiation. Chlorophilic variations, the effect of mutagen on differentiation, plant size and lethal dosewere evaluated. The results showed that plant size and lethal time diminishedwhen the mutagen concentration was increased, enlarging differentiation time and production of chlorotic and albino plants. Key words: Sugar cane, tissue α-bromonaphthalen culture, mutation, INTRODUCCIÓN La idea de provocar mutaciones artificialmente y emplearlas con fines mejoradores fue planteada desde hace casi 70 años y desde entonces se ha progresado notablemente en este campo. No obstante, un gran número de autores recomiendan su aplicación sólo como un método complementario de las técnicas convencionales del mejoramiento gen ético, el cual mediante la técnica de cultivo in Vitro ha dado la posibilidad de selección de diferentes mutantes en los cultivos (5) .Uno de los avances más notables de estos sistemas, es el fácil tratamiento de grandes poblaciones de células con agentes modificadores del material gen ético. La aplicación de sustancias mutagénicas a las poblaciones celulares, hace que aumente la posibilidad de encontrar mutantes beneficiosos, debido a los cambios provocados en la estructura celular de las plantas, por las exposiciones de los callos o explantes a los agentes modificadores (3, 9, 10) . Handro (5) y Cornide (2) , reportan que dentro de los agentes mutagénicos químicos, están los pertenecientes a los bromuros, tales como el 5 bromodeoxyuridine y el 5 bromouracil, no habiendo reportado el α-bromoriaftaleno. Nickell (12) , plantea que los mutágenos químicos son de fácil manipulación y Handro (5) señala que los agentes químicos son muy afectivos y mucho más capaces de dejar mutaciones y cambios en las células. Este trabajo ha sido elaborado con el objeto de comprobar la eficacia del α-bromonaftaleno como agente mutagénico en caña de azúcar, usando poblaciones de células de la variedad C 127-78 y determinar la dosis más adecuada para tratamientos futuros. MATERIALES Y MÉTODOS Para realizar este trabajo, fueron sembrados meristemas de la variedad C 127-78, con diámetro de 10 ± 2 mm, en un medio Payan (13) , suplementado con 5 mg/l de 2,4-D y 18% de agua de coco. Después de 35 días se formaron los callos, siendo pasados a subcultivo por 21 días con el objeto de obtener mayor proliferación y aumentar en consecuencia las variaciones (6, 16) . Los callos fueron pasados al medio de Payan sin suplemento ya diferentes concentraciones de α-bromonaftaleno (0,00; 0,01; 0,02; 0,03; 0,04; 0,05 y 0,06%). Se efectuaron evaluaciones del tiempo de diferenciación, tiempo letal y altura de las plantas (1, 5) , y antes de llevarlos al campo, sus variaciones clorofílicas (5, 11, 14) . RESULTADOS Y DISCUSIÓN Cinco días después que los callos fueron colocados en el medio de diferenciación, bajo el efecto de las diferentes concentraciones de α-bromonaftaleno como agente mutagénico, se comprobó que su coloración oscilaba entre carmelita claro y carmelita oscuro. Siendo de color carmelita claro los callos expuestos a la concentración de 0,01%, carmelita más oscuro los que se encontraban en 0,02 y 0,03% y tomando un color más intenso los expuestos a las concentraciones más altas (0,04; 0,05 y 0,06%), manteniendo su coloración amarillenta los callos testigos. Siete días después de ser transplantados los callos, comenzó la diferenciación celular (fig. 1) , la cual se extendió hasta el día 15 después del subcultivo, observándose que esta es retardada a medida que las concentraciones del mutágeno son aumentadas. Bajaj (1), reporta que altas dosis, tanto física. como química retardan la diferenciación.
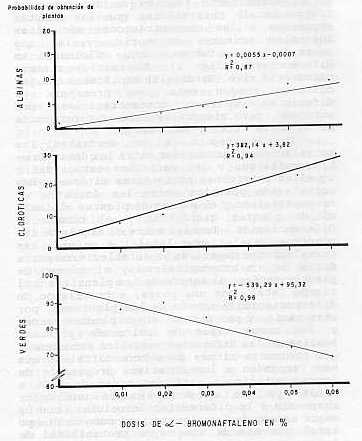
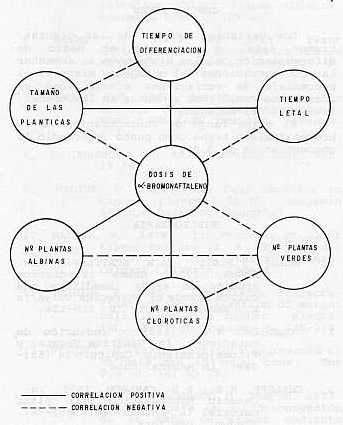
Cuando las plantas estaban diferenciadas se pudo observar que a medida que aumenta la concentración del mutágeno, el número de plantas es menor. Handro (5) , manifiesta que altas dosis de mutágeno en el medio de cultivo, trae como consecuencia bajo porcentaje de supervivencia, planteando que concentraciones más bajas, tienen mayor porcentaje de supervivencia, pero con menor probabilidad de encontrar un mutante de valor. Maliga (11), plantea que una de las formas de medir la efectividad de un mutágeno, entre otras cosas, está dada por la capacidad de las células de diferenciarse en presencia del mutágeno o después de un tratamiento. También se comprobó que el tamaño de las plantas se vio afectado por la acción del α-bromonaftaleno (fig. 1) por lo que se puede plantear que éste también tiene efecto sobre el crecimiento de las plantas. La eficiencia del mutágeno o la acción mutagénica se puede estimar por el efecto sobre la altura de las plantas y el grado de supervivencia de éstas (4, 7, 15). Las variaciones clorofílicas fueron determinadas (fig. 2), demostrándose que altas concentraciones del mutágeno aumentaban la frecuencia de albinismo y plantas cloróticas. Cornide (2) , manifiesta que la efectividad y eficiencia de un mutágeno en plantas casi siempre se estima por sus variaciones clorofílicas. Pérez et al. (14), evaluó plantas de caña obtenidas por cultivo de tejidos mediante tratamiento mutagénico Azida de sodio (N3NO3) por sus variaciones clorofílicas. Kriumbergel (18) plantea que los fenotipos, con variaciones cloróticas después de un tratamiento mutagénico, es suficiente para medir la efectividad del mutágeno. En el experimento también se determinó el tiempo letal, observándose que las plantas expuestas a las concentraciones más altas fueron las primeras en morir, y las que sobrevivieron fueron las últimas en diferenciarse (fig. 1) .El testigo siempre permaneció vivo. Handro (5) manifiesta que los cultivos pueden estar en presencia de diferentes dosis o concentraciones del mutágeno, pero siempre estarán en dependencia de la dosis letal y subletal. En la figura 3 se describen las correlaciones encontradas entre las dosis de α-bromonaftaleno y las variables estudiadas y aquellas existentes entre éstas últimas. Hay correlación positiva entre las dosis de α-bromonaftaleno y el número de plantas albinas, el de plantas cloróticas y el tiempo de diferenciación. También entre el tamaño de las planticas y el tiempo letal. A su vez, las correlaciones negativas se establecieron entre dosis de α-bromonaftaleno y el número de plantas verdes, el tamaño de las planticas y el tiempo letal, por una parte; entre tiempo de diferenciación y tamaño de las planticas, por otra parte, y por último, entre plantas verdes y los otros tipos de color de plantas. Analizando las diferentes variables estudiadas, las concentraciones de α-bromonaftaleno que más responden a los objetivos propuestos de lograr mutaciones están en orden de 0,01 a 0,03%, ya que es donde existe una mejor respuesta a la diferenciación celular, con un mayor tamaño de las plantas, así como un tiempo letal que nos da una mayor probabilidad de lograr mutaciones. es por eso que tomamos 0,02% como punto medio para trabajos posteriores.
CONCLUSIONES Los variables tamaños de las plantas, tiempo letal y respuesta al medio de diferenciación celular disminuyen al aumentar las concentraciones del mutágeno, mientras el porcentaje de variaciones clorofílicas se incrementa con dichos aumentos en las concentraciones del mutágeno. El mejor rango de concentración de α-bromonaftaleno tiene como punto intermedio la concentración de 0,02%. BIBLIOGRAFÍA 1. BAJAJ, Y.P.S.; A.W. SCATTLER; M.W. ADAMS. 1970. Gamma irradiation studies on seeds, seedlings and callus tissue of Phaseolus vulgaris L. Radiation Bot. 10: 119-124. 2. CORNIDE, M.T. 1985. Inducción de mutaciones. In: Gen ética Vegetal y Fitomejoramiento. Capítulo 14 (551584) .La Habana, Cuba. 3. CHALEFF, R.S.; P.S. CARLSON. 1975. In: Genetic Manipulation with plant material (L. Ledoux, ed.) 351-363. Plenum, New York. 4. GAUL, H. 1972. Proc. 121-139 Efficiency of mutagenesis. FAO. IAEA meeting. Viena. 121-139. 5. HANDRO, W. 1981. Mutagenesis and in vitro selection. Plant Tissue Culture. Academic Press. 155-179. 6. HEINZ, D.J. i G.W.P. MEE. 1969. Plant differentiation from callus tissue of Saccharum species. Crop Sci. 9: 346-348. 7. KONZAK, C.F. 1966. Development of genetic methods for wheat improvement. Proc. FAO-IAEA meeting. viena. 173. 8. KRIUMBERGEL, G. 1979. Enviton Expt. Bot. 19:99 9. MALIGA, P. higher Kiodo. 1976. In: Cell Genetics in plants. 59-76. Academia Budapest (Hungría) . 10. MALIGA, P. 1978. In: Frontier of plant tissue culture (T. A. Thorpe, ed.) 281-293. Univ. Calgary Press. Calgary, Alberta, Canadá. 11. MALIGA, P. 1980. Insolation, characterization and utilization of mutant cell lines in higher plants. Int. Rev. of Cytology 9: 225-249. 12. NICKELL, G. 1973. Test-tube approaGhes to by pass sex in sugar Gane. The Sug. J. 36: 19-25. 13. PAYAN, A.F.; H. CARMEN; G. TASCON. 1977. Técnicas para la micropropagación de la caña de azúcar mediante cultivo de tejidos y yemas. Acta Agron. 27: 43-79. (Colombia). 14. PEREZ P., J.; P. ORELLANA; A. CASTILLO; R. PORTAL. 1985. Inducción de mutaciones químicas in Vitro en caña de azúcar. Resumen IX Seminario Científico del CNIC, La Habana, Cuba. 15. SANTANA, I.; O. NODARSE ; A. DIAZ ; R. BLANCO . 1992. Selección de subclones resistentes al virus del mosaico de la caña de azúcar (SCMV) a partir de la variedad C 236-51. Rev. Caña de Azúcar 10: 71-78. 16. SCOWCROFT, D. 1984. Genetic variability in tissue culture impact germoplasm conservation and utilization. IBPGR, June 1984. |
||||||
|
|