|
|
||||||||||||||||||||||||||||
| FONAIAP DIVULGA > Colección > Número 24 Abril-Junio 1987 | ||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||
|
FONAIAP DIVULGA No. 24 Abril-Junio 1987 |
||||||||||||||||||||||||||||
|
Biol. José Antonio Sola
Y.,
TAI Freddy Hernández.,
TAI Francisco Pérez L., |
||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||
|
En la cachama, la gametogénesis (producción de gametos o células reproductoras) y las primeras etapas de maduración de los gametos, ocurren durante los primeros meses del año, siendo controlados independientemente por el sistema nervioso. La maduración final de los gametos, sin embargo, es mediada por la acción de hormonas gonadotrópicas, segregadas por la glándula pituitaria en respuesta a diversos factores ambientales, tales como la temperatura del agua, corrientes, fluctuaciones en el nivel del agua, etc.
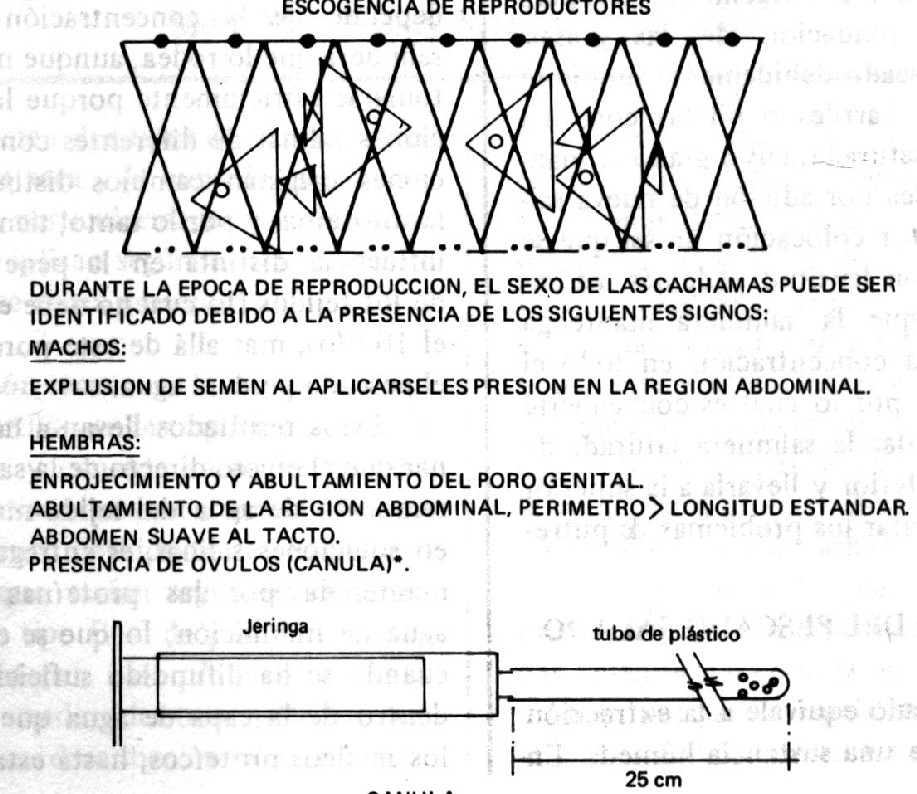
En ríos y cuerpos de aguas cubiertos, estos peces pueden llevar a cabo todos los procesos reproductivos, llegando a desovar (puesta de la huevos) con la llegada de las primeras lluvias. No obstante, en cuerpos de agua cerrados, tales como los característicos de la piscicultura, las últimas etapas de maduración de los huevos, generalmente no puede efectuarse debido a la falta de estimulación ambiental necesaria para la producción de las hom1onas gonadotrópicas. Dada la necesidad de obtener semilla de cachama para efectos de engorde, repoblación e investigación, se ha implementado el uso de técnicas de inducción de propagación en cautiverio, que permiten la obtención masiva y controlada de alevines. El trabajo de inducción de la reproducción y cría de cachamas en la Sub-Estación Experimental Guanapito, comienza generalmente durante la segunda quincena del mes de mayo, época en la cual se hacen aparentes las características sexuales en los reproductores que facilitan su identificación (Cuadro 1 ).
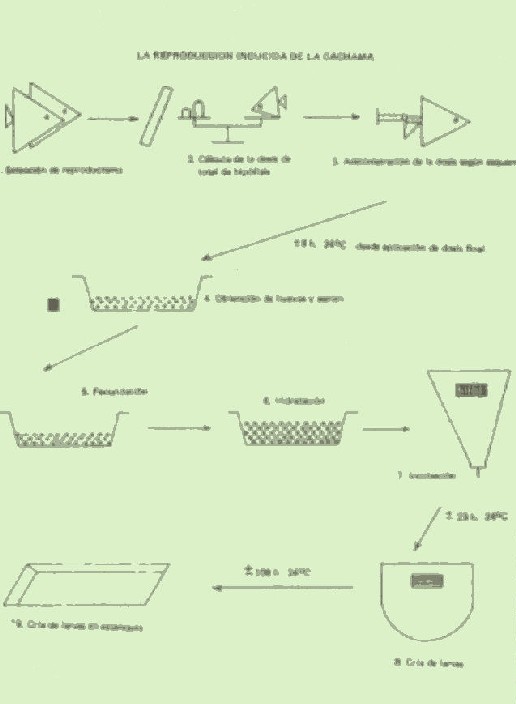
El proceso en sí consta de varias etapas, siendo la primera la selección de reproductores entre el stock y de peces de la estación. Debido a que el éxito del proceso depende, en gran parte, de la escogencia acertada de hembras en el apropiado estado de madurez gonadal, es recomendable la toma de una muestra de óvulos mediante el uso de una cánula {Cuadro 1). Esta última consiste en un tubo plástico del tipo utilizado para aireación de acuarios) de 25 cm de longitud, al cual se le ha suavizado y redondeado un extremo, y se ha conectado posteriormente a una jeringa de lO cc. La cánula se inserta por el poro genital (posterior) de la hembra, hasta una profundidad de 15.20 cm y luego se retira aplicando succión con la jeringa. Los óvulos obtenidos son suspendidos en agua y observados a la lupa para determinar su estado de madurez. Aquellas muestras de óvulos que no presenten vascularización, y que hidraten en contacto con el agua, determinarán la selección de sus donantes.
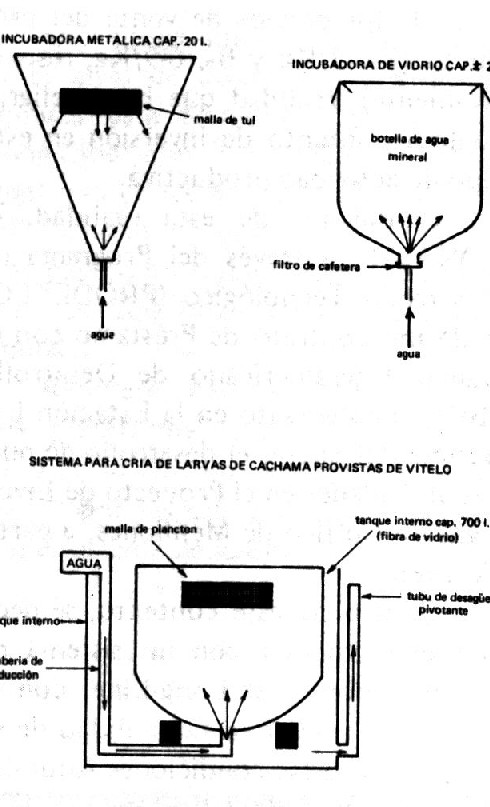
Una vez seleccionados los reproductores (2 machos/hembra), se procede a determinar la dosis de hipófisis necesaria para inducir el desove por parte 00 la hembra, mediante el uso de la relación perímetro peso, descrita en el Cuadro 2. La hipófisis es administrada disuelta en un mínimo volumen de suero fisiológico por vía intramuscular, según el esquema de dosificación. Durante la administración de la hipófisis, los reproductores son mantenidos en ayunas en estanques cubiertos de baldosas y provistos de recambio continuo de agua. Ocho horas (24° C) después de la aplicación de la última dosis de hipófisis, la hembra es sacada del agua, colocada sobre una superficie esponjosa húmeda, y masajeada vigorosamente para propiciar la expulsión de los Óvulos maduros, los cuales son colectados en un recipiente seco previamente esterilizado. Simultáneamente, se procede a la extracción del semen de los machos, utilizando para tal fin un colector o trampa de semen, mantenido en condiciones asépticas y de extrema sequedad a manera de evitar la activación prematura de los espermatozoides por con tacto con agua. Una vez obtenidos los gametos masculinos y femeninos, se procede a mezclarlos en seco con una pluma de ave, añadiendo tan sólo 100 ml de una solución de carbamida al 1 0/0 por cada litro de huevos secos obtenidos. La solución cumple un doble propósito, el de activar loS espermatozoides e incrementar su vida hasta por un período de lO minutos, lo cual optimiza el porcentaje de fecundación. Transcurridos 10 minutos desde la mezcla de los gametos, se añade agua a éstos para propiciar la hidratación de los huevos y lavar restos de sangre u otro material presente en los mismos. El agua es de cantada y el volumen repuesto varias veces durante un período de 20 minutos, para propiciar un máximo de hidratación. Los huevos hidratados son distribuidos a razón de 250 ml de huevos/ 20 L de agua, en incubadoras {Cuadro 3) provistas de flujo ascendente continuo de agua. El proceso de incubación dura 22-23 horas a 24 o C, siendo posible observar la larva moviéndose dentro del huevo horas antes de su eclosión. La eclosión (o salida) de las larvas ocurre de manera sincrónica en todas las incubadoras, siendo necesario reducir el flujo de agua en las mismas para evitar cl escape de ellas sobre el borde, y asegurar un máximo de colección por sifoneo. Las larvas recién eclodidas no se alimentan de fuentes externas durante los primeros cinco días ( 44° C), ya que poseen una reserva nutritiva en su saco vitelino. Durante este período, las larvas son mantenidas en tanques de cría también provistos de flujo ascendente continuo de agua (Cuadro 3). Al cabo de cinco días, las larvas ya están en condiciones de ingerir zooplancton, por lo cual es necesario trasladarlas a estanques externos. Los estanques son preparados y fertilizados con sólo tres días de anticipación a la siembra de las larvas, para permitir el desarrollo de una población de plancton ya la vez disminuir la proliferación de larvas de odonatas que prendan sobre las larvas de cachama. Transcurrido un período de dos semanas de cría en los estanques, los alevines pueden ser alimentados con polvillo de productos comerciales, siendo necesario incrementar la ración y el tamaño del pellet paulatinamente. Al cabo de 45 días los alevines
alcanzan una tala promedio de 3 cm pudiendo ser dispuestos para cultivo
intensivo. |
||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||