|
Veterinaria Tropical 21(2): 111-127. 1996 EFECTO DEL Trypanosoma vivax SOBRE LA GESTACIÓN DE VACAS MESTIZAS HOLSTEIN-CEBU INOCULADAS EXPERIMENTALMENTE. Nersa González*, Emir Espinoza* y Luis Rangel** * Universidad Simón Rodríguez. Recibido: febrero 2, 1996 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
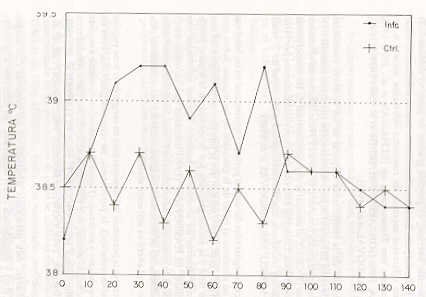
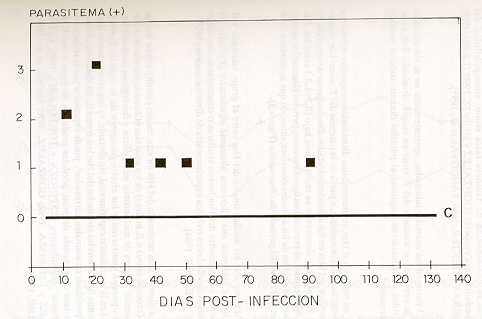
RESUMEN Este trabajo tuvo como objetivo conocer el efecto del Trypanosoma vivax en hembras mestizas Holstein-Cebú, inoculadas experimentalmente en el último tercio de la gestación. Se seleccionaron 6 hembras, 4 fueron usadas como grupo experimental y dos como controles. El grupo experimental fue inoculado con un estabilizado de T. vivax (Guárico -IIV), administrado por vía intravenosa con una dosis total de 104. Las variables temperatura, peso corporal, parasitemia, hematocrito, titulación de anticuerpos y niveles de progesterona se evaluaron cada 10 días durante los 140días del período experimental. Hubo diferencias altamente significativas (P<0,01) en los promedios de la temperatura corporal entre los animales infectados y controles. La parasitemia fue moderada, tendiendo a disminuir a medida que la enfermedad avanzó. El parto no fue afectado por la presencia o ausencia del T. vivax. El grupo infectado evidenció una diferencia altamente significativa (P<0,01) al comparar las medias totales del hematocrito. No hubo diferencias significativas (P < 0,01) cuando se compararon los porcentajes de peso promedio de los grupos, entre el último registrado en la gestación y el primero post-parto. Los animales infectados desarrollaron títulos anti T. vivax a partir del día 10 post-inoculación hasta el final del experimento. Los niveles promedios de progesterona (P4) en la gestación y la diferencia entre medias totales de P4 en el post-parto no fueron estadísticamente significativas (P < 0,05). Palabras Clave: T. vivax; gestación; post-parto; progesterona; IFI. INTRODUCCIÓN Los Trypanosoma patogénicos de los animales domésticos causan importantes daños económicos en muchos países africanos, americanos y asiáticos (ESPINOZA, 1994; TORO, 1990). La anemia es el carácter fundamental de la infección (MORRY y DEXTER, 1988); pero, últimamente se señala con mayor frecuencia una amplia variedad de desórdenes reproductivos tanto en la hembra así como en el macho (ELHASSAN et al., 1994; 1995; IKEDE y LOSOS, 1972; SEKONI, 1994). La Tripanosomiasis podría contribuir con los altos niveles de infertilidad de los rebaños en los diferentes países afectados endémicamente por la hemoparasitosis y los fracasos en la preñez, a menudo asociada con esta enfermedad en el campo (MOTA YOBA et al., 1988a: 1988b; 1989). En Venezuela pocos estudios se han conducido sobre otras noxas, y que por falta de un buen diagnóstico estén afectando la eficiencia reproductiva de la hembra bovina, como es el caso del Trypanosoma vivax, hemoparásito que afecta a bovinos, ovinos y caprinos (ESPINOZA, 1988; 1994). La enfermedad, por ser endémica, genera importantes consecuencias sobre la industria ganadera del país (DUNO, 1992; TORO, 1990). El objetivo del presente trabajo fue obtener información preliminar sobre los efectos de la infección experimental con un aislado de T. vivax, en vacas mestizas Holstein-Cebú en el último tercio de la gestación. MATERIALES Y MÉTODOS La experiencia fue realizada en un rebaño comercial bovino de doble propósito, perteneciente a la Estación Experimental Río Negro de la Universidad Simón Rodríguez, ubicada en el Edo. Miranda, municipio Acevedo, Asentamiento Campesino Río Negro (Venezuela). La misma se encuentra a 42 m.s.n.m., con vegetación de bosque húmedo tropical, temperatura anual promedio de 27,2 °c y una pluviosidad total anual de 1913,7 mm. El ensayo se desarrolló en dos etapas: una que comprendió el período gestación (90 días) y la otra, el período post-parto (50 días). Animales experimentales Se utilizaron seis hembras 1/2 sangre Holstein-Cebú; en el último tercio de la gestación, con un historial de dos o tres partos. Fueron divididas aleatoriamente (DUNCAN et al., 1978) en dos grupos, uno experimental de cuatro hembras y otro de dos como controles. Las hembras, antes del inicio del experimento, fueron bañadas con un ectoparasiticida; se sometieron a pruebas parasitológicas y serológicas, a fin de descartar la presencia de hemoparásitos y/o títulos reaccionantes a brucelosis, leptospirosis y anticuerpos anti T. vivax. Ambos grupos (inoculado y control) fueron aislados y alimentados con pasto picado, alimento concentrado, sales minerales y agua ad libitum. Material parasitológico e infección experimental La inoculación del grupo experimental se realizó con un estabilizado de T. vivax (Guárico-IIV), conservado por cinco años en dimetil sulfóxido (DMSO), al 5%, y almacenado en nitrógeno líquido (ESPINOZA y TORTOLERO, 1990). Fue administrado vía intravenosa (vena yugular), con una dosis total de 104 T. vivax. Estudio de las variables clínicas La temperatura rectal se tomó en las primeras horas de la mañana (8-9 AM), tres veces por semana. Seguido a la inoculación, todas las vacas fueron sangradas diariamente en los primeros cinco días; posteriormente, cada 10 días hasta el final del experimento. Las muestras de sangre fueron colectadas por punción de la vena yugular en tubos "venojet" con ácido etileno diaminotetracético (EDTA) como anticoagulante, y conservadas en hielo hasta su traslado al laboratorio. Una vez en el laboratorio, las muestras sanguíneas fueron analizadas para parasitemia (T. vivax) por la técnica del microcapilar (microcentrífuga Clay Adams, Autocrit Ultra); lo cual permitió a su vez la estimación simultánea de la anemia a través del hematocrito (Hm) (ESPINOZA, 1994). El peso corporal se determinó cada 10 días, mediante una romana de 5000 kg. Los cambios clínicos asociados con la parasitosis fueron registrados al momento de la toma de la muestra de sangre y pesaje. Durante el período post-parto la evaluación de los ovarios se efectuó a través de la palpación rectal, cada 10 días. Inmunodiagnóstico Para los exámenes serológicos (títulos anti T. vivax) cada 10 días se tomaron muestras de sangre. Los sueros fueron obtenidos por medio de la retracción del coágulo sanguíneo en tubos sin anticoagulante, transportados en refrigeración al laboratorio para su procesamiento, y guardados a -20 o -70 °C hasta el momento de sus análisis. La titulación de anticuerpos anti T. vivax se realizó mediante el uso de la técnica de inmunofluorescencia indirecta (IFI) (ESPINOZA, 1988; 1994; ESPINOZA y TORTOLERO, 1990), ligeramente modificada al utilizar como antígeno sangre de caprino infectada con T. vivax. Determinación de la progesterona sérica (P4) Se obtuvo muestras de sangre cada 10 días, entre las 8 y 9 AM, mediante la punción de la vena yugular con tubos "monojet", sin anticoagulantes, y transportadas en hielo hasta el laboratorio, donde se centrifugaron a 3 000 9 por 30 min a 4 °C (Centrífuga refrigerada, DAMON/IEC, CRU-5000), dentro de las dos horas siguientes a su extracción (GONZÁLEZ, 1991; 1994; GONZÁLEZ y MUÑOZ, 1990). Los sueros se almacenaron, previamente divididos en alícuotas, a temperatura de -20 °C, hasta su procesamiento en el Laboratorio de Endocrinología de la Maternidad Concepción Palacios. Para la determinación de la progesterona (P4) en suero, se empleó como prueba piloto (GONZÁLEZ y MUÑOZ, 1990; GONZÁLEZ, 1991; GONZÁLEZ y ESPINOZA, 1992), un sistema de ensayo enzimático heterólogo (Kit Comercial Delfia), el cual consistió en un inmunoensayo en fase sólida, basado en la competición de la progesterona (P4) marcada con un compuesto fluorescente (europión) y anticuerpos antiprogesterona policlonales (derivados de conejo). Análisis estadísticos Los resultados promedios totales de la temperatura y el Hm en las hembras infectadas y controles, fueron analizados por medio de la prueba "t" de Student's para muestras independientes (DUNCAN et al., 1978); la comparación de los porcentajes de pesos se utilizó el estadístico Z (DUN- CAN et al, 1978; SPIEGEL, 1980). Las estructuras morfológicas de los ovarios de ambos grupos de animales se compararon por medio de la prueba no paramétrica de Friedman (SIEGEL, 1982), y los datos de progesterona se analizaron a través de un análisis de varianza (STEEL y TORRIE, 1986). RESULTADOS Y DISCUSIÓN Los signos clínicos de la infección comprendieron: 1) fiebre de tipo remitente, 2) parasitemia fluctuante, 3) disminución del hematocrito, 4) mucosas externas ictéricas, 5) pérdida gradual de peso, 6) debilidad, 7) pérdida de brillo del pelo. Estas manifestaciones clínicas, son características generales en diferentes especies de rumiantes infectados natural o experimentalmente con Trypanosoma sp (ELHASSAN et al., 1994; 1995; ESPINOZA, 1988; GONZALEZ, 1991; IKEDE et al. 1988; OGWU et al., 1984; 1986; SANDOVAL et al., 1995). El promedio de la temperatura corporal en las hembras inoculadas osciló, desde el día 20 hasta el 80 post-infección, por encima de la media total (38,5 °C) de los animales controles, (Figura 1). Hubo diferencias altamente significativas (P < 0,01 ), al comparar el promedio total de las temperaturas entre los dos grupos. Coincidió ésto con anteriores señalamientos por otros autores, quienes trabajaron con diferentes aislados y/o cepas de T. vivax (OGWU y MJOKU, 1987; SANDOVAL et al . 1995). Las pirexias registradas durante el período experimental en las hembras infectadas no afectaron el curso de la gestación de las mismas. Sobre este aspecto, OGWU et al. (1984) señalan que la hipertermia en conjunción con la infección fetal y la anoxia generada por la anemia en la madre, puede desencadenar cuadros de abortos en hembras bovinas infectadas con tripanosomiasis. ELHASSAN et al. (1995) indicaron que en ovejas en el último tercio de la gestación, e infectadas con T. vivax, los abortos observados en ellas posiblemente se debieron a los estados febriles presentados en esos animales, lo cual alteró su ambiente uterino. Al detectarse la presencia del hemoparásito en sangre de la vena yugular (día 10 post-inoculación), la parasitemia, en términos generales, tuvo un desarrollo ondulante y moderado (Figura 2), tendiendo a disminuir a medida que la enfermedad avanzó; este hallazgo, concuerda con datos obtenidos en otras investigaciones (BETANCOURT, 1978; ELHASSAN et al., 1994; 1995; ESPINOZA, 1994; OGWU y MJOKU, 1987; SANDOVAL et al., 1995). Sin embargo, esta parasitosis advertida en las hembras (1/2 sangre Holstein-Cebú) y considerada como moderada, fue diferente a la enfermedad generada en hembras Holstein y ovejas mestizas West-African inoculadas con la misma cepa de T. vivax por ESPINOZA (1988) y SANDOVAL et al. (1995). Lo anterior se podría explicar como consecuencia de la combinación de factores tales como: susceptibilidad del hospedador, raza y especie (GONZÁLEZ y MUÑOZ, 1990; ILRAD, 1989; MURRAY y DEXTER, 1988; SANDOVAL et al., 1995).
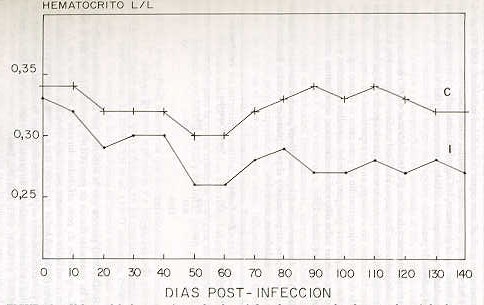
El parto en los animales infectados, aparentemente no se vió afectado por la presencia o ausencia del T. vivax en sangre circulante. Las vacas controles permanecieron negativas al parásito durante todo el período experimental. Con respecto al Hm, se presentó una disminución progresiva del mismo en todas las vacas inoculadas, a partir de la patencia del T. vivax. Los valores promedios del Hm en los animales infectados disminuyeron desde el día 10 post-inoculación, alcanzando su registro más bajo (0,26 L/L) entre los días 50 y 60. Después, se presentó un ligero aumento, pero sin alcanzar los valores promedios del Hm de los animales controles, situación que se mantuvo igual durante el resto del período de observación (Figura 3).
Al comparar las medias totales del Hm entre el grupo infectado y el control, se evidenció una diferencia altamente significativa (P < 0,01). El descenso en los niveles del Hm fueron similares o concordaron con informaciones reseñadas en trabajos experimentales de diversos autores (MURRAY y DEXTER, 1988). La disminución moderada del Hm en este ensayo permite inferir que la raza (cruce B. taurus x B. indicus) de los animales utilizados, manifiesta cierta resistencia a través de mecanismos metabólicos y fisiológicos mediante los cuales pueden contrarrestar los efectos patógenos de la cepa de T. vivax usada en la inoculación experimental. No obstante, es importante acotar que la anemia ligera (niveles atenuados del Hm) en forma de un síndrome clínico de hipoxidosis en animales "estresados", puede expresarse por la reducción en la tasa de ganancia de peso, pérdidas graduales de peso y una baja eficiencia reproductiva (ESPINOZA y TORTOLERO, 1990; GONZÁLEZ y ESPINOZA, 1992; GONZÁLEZ, 1990; OGWU et al. 1986; SEKONI, 1994). Las vacas inoculadas, en la medida que la infección progresó, mostraron un emaciación gradual, con cierta variabilidad individual. OGWU et al. (1986) informan que en novillas preñadas e infectadas con T. vivax, en el último tercio de la gestación, los signos de emaciación y letargia son más pronunciados, posiblemente debido a un aumento del "estres", que da el propio período de preñez. En el mismo orden de ideas, ELHASSAN et al. (1995) indicaron que en ovejas infectadas con T. vivax, en el último tercio de la gestación, los signos externos (peso) fueron menos severos que en aquellas ovejas infectadas en el primer trimestre. Sin embargo, en este experimento la comparación de la pérdida de porcentajes promedio de peso entre el último registrado en la gestación y el primero post-parto de los animales infectados y controles, demuestra que no hubo diferencias estadísticas significativas entre ambos grupos (P < 0,01) (Cuadro 1).
ILRAD (1986) plantea que la infección por tripanosomas parece no afectar las ganancias diarias de peso (GDP), pero sí el promedio de peso vivo. Las pérdidas de peso señaladas durante la infección con T. vivax pueden ser un factor importante que influya sobre la actividad hipotalámicapituitaria (ELHASSAN et al.., 1995; ILRAD, 1986; MUTAYOBA et al., 1988), y en consecuencia se presenten disturbios endocrinos que afecten la ciclicidad en hembras rumiantes no preñadas o abortos en hembras gestantes (OGWU y NURU, 1981; SEKONI, 1994). Los animales inoculados desarrollaron títulos anti T. vivax a partir del día 10 post-inoculación hasta el final del experimento. Posteriormente, las titulaciones de los anticuerpos se mantuvieron positivas (línea base 1:80) con intervariaciones entre títulos de 1:160 y 1:320. Los animales controles fueron negativos durante toda la fase experimental. La incorporación de antígenos de T. vivax procedente de sangre de caprino altamente infectado ( 4 + ), previamente lavados y resuspendidos en albúmina al 2%, permitió reducir en un amplio rango las fluorescencias no específicas; situación desventajosa que se presenta cuando se utilizan láminas de antígenos con sangre completa o lavada obtenida de bovinos infectados con el hemoparásito (ESPINOZA, 1988). El estudio de la actividad reproductiva post-parto a través de las estructuras ováricas encontradas por medio de la exploración transrectal en la hembras infectadas con T. vivax y controles, indica que las mismas pudieron haber reanudado su ciclicidad tempranamente, correspondiéndole a las hembras inoculadas entre los 30 y 50 días post-parto, y las controles a los 30 días del mismo período (Cuadro 2); no obstante, en este ensayo, no se evidenció, ni en el grupo experimental y ni en el control, manifestaciones externas de celo en el post-parto, tales como: inflamación de la vulva, descarga de limo, monta de una hembra con otra. Estadísticamente no hubo diferencias entre las estructuras ováricas del grupo infectado y control con un nivel de significación de P < 0,05. Los anteriores hallazgos coincidieron con los encontrados para la misma condición ecológica, de manejo y tipo racial de animales por GONZÁLEZ y MUÑOZ (199<1) y GONZÁLEZ (1990).
OGWU et al. (1984) observaron que novillas infectadas experimentalmente con T. vivax no llegaron a preñarse ya los 40 días post-parto no evidenciaron ningún cuerpo lúteo o folículo en los ovarios a la palpación rectal. Contrariamente, LLEWELYN et al.. (1987) indicaron, en ovejas infectadas con T. congolense, la persistencia de cuerpo lúteo basado en un criterio de la concentración elevada de la progesterona (P4) más allá de los 30 días después de su última medición basal. ELHASSAN et al. (1995) señalaron que ovejas infectadas con T. vivax no manifestaron ninguna pauta de fase folicular y luteal durante el período experimental. Para explicar la persistencia del CL, LUCKINS et al.. (1986) sugirieron una falla en la síntesis o transporte de la prostaglandina F2 o una disminución de la respuesta por parte del ovario a la acción de la misma. MUTAYOBA et al.. (1986) concuerdan con la anterior apreciación al estimar una posible participación de las prostaglandinas sobre el CL inducida por los tripanosomas en la infertilidad de las cabras. En este estudie, el promedio de los niveles de progesterona (P4) en las hembras del grupo de las infectadas (15,3 ng/mL), para el día de la , inoculación (día 0) con el T. vivax, comparado con la media del grupo control (9, 7 ng/mL), no difirieron significativamente (P < 0,01). Los valores oscilaron dentro de variaciones consideradas como normales para hembras , gestantes en el trópico (GONZÁLEZ, 1990). Igualmente, la contrastación de los niveles promedios de progesterona en la gestación (infectados, 11,1 ng/mL y controles, 7,4 ng/mL) y la diferencia entre las medias de P4 para el post -parto (infectados, 2,3 y controles, 3,09) entre ambos grupos, no fue c significativo (P < 0,05). Tomando como base, al menos un valor alto, seguido de uno bajo de progesterona que permitiese sospechar la existencia o presencia de un ciclo regular (GONZÁLEZ, 1990; LUCKINS et al., 1986), los niveles de P4 determinados por el método inmunofluométrico indicaron que los animales infectados y controles no reanudaron la ciclicidad. La ausencia de la ciclicidad en los 50 días post-parto puede atribuirse al cruce de los animales usados, al plano nutricional o a que la cepa de T. vivax haya afectado en un grado considerable a la glándula pituitaria, lo cual conduciría a una deficiencia de las secreciones hormonales o a una menor respuesta del ovario (ELHASSAN et al., 1995; LUCKINS et al., 1986). Se desprende de este estudio preliminar la necesidad de continuar trabajando sobre el impacto del hemoparásito (T. vivax americano) en los mecanismos endocrinos reguladores de la actividad cíclica normal de hembras bovinas, explotadas bajo la modalidad de doble propósito y expuestas a la naturaleza adversa nutricional y sanitaria del medio venezolano. SUMMARY The present work had as objetive to know the clinical effects of Trypanosoma vivax in cross-breed Holstein-Zebu females, experimentally inoculated in the last third of the gestation. Six females were selected; four of them were used as experimental group and two as controls. The experimental group was intravenously inoculated with a stabilized of T. vivax ( Guárico-IIV) with a total dose of 104 trypanosomes. Parasitaemia, tempera ture, body weight, titration of antibodies and levels of progesterone were evaluated during 140 days. Differences highly significant (P < 0,01) were detected in the averages of the corporal temperature between the infected animals and controls. The parasitaemia was moderated, it tended to decrease while the disease advanced. The delivery was not affected by the presence or absence of the T. vivax. The infected group evidenced a highly significant differences when the total means of hematocrit were compared. There were not significant differences (P < 0,01) when the percentages of average weight of the groups were compared among the last registered in the gestation and the first post-partum. The infected animals developed titles anti T. vivax from day 10 post-infection until the end of the experiment. The averages levels of progesterone (P4) in the gestation and the difference among total means of hormone in the post-partum were not estadistically meaningful (P < 0,05). Key Words: T. vivax; gestation; post-partum; progesterone; IFA. BIBLIOGRAFÍA BETANCOURT, A. 1978. Transmisión prenatal del Trypanosoma vivax de bovinos en Colombia. Revista Instituto Colombiano Agropecuario. 3(1): 127-129. DUNCAN, R., R. KNAPP y M. MILLER. 1978. Bioestadística. México. Interamericana. p. 43-66. DUNO, F. 1992. Prevalencia de la tripanosomiasis bovina en la Región Nor-Oriental del Edo. Falcón. Tesis MSc. Universidad Central de Venezuela. Maracay. Venezuela. 159 p. ELHASSAN, E., B. IKEDE, and O. ADEYEMO. 1994. Trypanosomosis and reproduction: II. Effect of Trypanosoma vivax infection on the oestrous cycle and fertility in the ewe. Tropical Animal Health and Production. 26:213-218. ELHASSAN, E., B. IKEDE, and O. ADEYEMO. 1995. Trypanosomosis and reproduction: II. Effect of Trypanosoma vivax infection on pregnancy and post/partum cyclicity in ewes. Tropical Animal Health and Production. 27:9-14. ESPINOZA, E. 1988. Evaluación clínica, Parasitológica y serológica de bovinos infectados experimentalmente con Trypanosoma vivax. Tesis MSc. Universidad Central de Venezuela. Maracay. Venezuela. 224 p. ESPINOZA, E. 1994. El Trypanosoma vivax y su impacto sobre la ganadería de doble propósito de la Estación Experimental La Iguana. Trabajo de ascenso. Universidad Simón Rodríguez. 120 p. ESPINOZA, E y E. TORTOLERO. 1990. Un método simple de conservación de Trypanosoma vivax para su uso en infecciones experimentales. In: Hemoparásitos: Biología y Diagnóstico. Caracas. Venezuela. Universidad Simón Bolívar. p. 147-154. GONZÁLEZ, N. 1991. Infección experimental con Trypanosoma vivax en vacas mestizas Holstein-Cebú, durante el último tercio de la gestación y el post-parto. Trabajo de ascenso. Universidad Simón Rodríguez. Caracas. Venezuela. 99 p. GONZÁLEZ, N. and E. ESPINOZA. 1992. Experimental infection with Trypanosoma vivax in Holstein-Cebú cows, during the last trimester of gestation and the post partum period. First International Seminar on non tsetse transmitted animal trypanosomoses. Annecy, France. 208 p. GONZÁLEZ, S y G. MUÑOZ. 1990. Relación entre aspectos de la eficiencia reproductiva y variables hematológicas, morfométricas y fisiológicas en vacas Holstein-Cebú. Acta Científica Venezolana 41(Sup 1):363. GONZÁLEZ, S. 1990. Medición de variables hematológicas, morfométricas y fisiológicas durante la gestación y el post-parto en vacas mestizas Holstein-Cebú pertenecientes a la Estación Experimental Río Negro de la Universidad Simón Rodríguez. Trabajo de grado. Universidad Simón Bolívar. Caracas. Venezuela. 88 p. IKEDE, B and G. LOSOS. 1972. Hereditary transmission of Trypanosoma vivax in sheep. Veterinary Pathology 9: 272-278. IKEDE, B, E. ELHASSAN and S. AKPAVU .1988. Reproductive disorders in African Trypanosomiasis. A Review. Acta Tropica 45: 5-10. ILRAD. 1986. Trypanosomiasis. Annual Report of the lnternational Laboratory for Research on Animal Diseases. p. 33-61. ILRAD. 1989. Trypanosomiasis. Annual Report of the lnternational Laboratory for Research on Animal Diseases. p. 31-56. LLEWELYN, C, A. LUCKINS, C. MUNRO and J. PERRIE. 1987. The effect of Trypanosoma congolense infection on the oestrus cycle of goat. British Veterinary Journal143: 423-431. LUCKINS, A, C. LLEWEL YN, MUNRO, C and M. MURRA Y. 1986. Effects of pathogenic trypanosoma on the mammalian reproductive system. Nuclear and related techniques in animal production and health. International Atomic Energy Agency. Vienna. p. 351-363. MURRA Y, M and T. DEXTER. 1988. Anaemia in bovine African trypanosomiasis. Acta Tropica 45:389-432 MUTAYOBA, B, H. MEYER, J. OSASO and S. GOMBE. 1989. Trypanosoma induced increase in prostaglandin F2 and its relatioship with corpus luteum funtion in the goat. Teriogenology 32(4): 545-555. SIEGEL, S. 1982. Estadística no paramétrica. 2 ed (7 reip). México. Trillas. p. 195-203. MUTAYOBA, B., S. GOMBE, G. KAAYA and E. WAINDI. 1988a. Effect of chronic experimental Trypanosoma congolense infection on the ovaries pituitary, thyroid and adrenal glands in famale goats. Research in Veterinary Science. 44(2): 140-146. MUTAYOBA, B, S. GOMBE, E. WAINDI and G. KAAYA. 1988b. Depression of ovarian funtion and plasma progesterone oestradiol 17 B in female goats chronically infected with Trypanosome congolense. Acta Endocrinologica (Copenh) 177: 477-484. MUTAYOBA, B., S. GOMBE, G. KAAYA and E. WAINDI. 1998. Trypanosome induced ovarian dysfuntion. Acta Tropica 45: 225-237. OGWU, O. and s. NURU. 1981. Transplacental transmission of trypanosome in animals and man. A Review. Veterinary Bulletin. 51(6): 381-384. OGWU, O., C.NJOKU, O. OSORI, C. EZEOKOLI andJ. KUMI-OIAKA. 1984. Effects of experimental Trypanosoma vivax on fertility of heifers. Theriogenology 22(6): 625-633. OGWU, D., C. NJOKU and D. OSORI. 1986. Effects of experimental Tripanosoma vivax infection on first, second and third trimester pregnancy in heifers. Theriogenology 25(3): 383-398. OGWU, o. and c. MJOKU. 1987. Effect of pregnancy on clinical manifestation of bovine trypanosomiasis. Veterinary Parasitology 25: 25-33. SANDOVAL, E., E. ESPINOZA y A. VALLE. 1995. Parasitemia y comportamiento clínico en ovejas infectadas experimentalmente con Trypanosoma vivax. Veterinaria Tropical 20:67-84. SEKONI, V. 1994. Reproductive disorders caused by animal trypanosomiasis: A review. Theriogenology 42: 557-570. SPIEGEL, M. 1980. Teoría y problemas de estadística. Bogotá. McGRAW HILL. p. 141-183. STEEL, R y J. TORRIE. 1986. Bioestadística: Principios y procedimientos. Bogotá. McGRAWHILL. p. 132-148. TORO, M. 1990. Seroepidemiología de las hemoparasitosis en Venezuela. In: Hemoparásitos: Biología y Diagnóstico. Caracas. Venezuela. USB. p. 33-50. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||