|
Veterinaria Tropical 23(2): 117-125. 1998 ESTUDIO DE LA CRIPTOSPORIDIOSIS AVIAR EN GRANJAS DE LA REGIÓN CENTRAL DE VENEZUELA Queila Surumay*, Isbelia Esqueda** y Carmen Balestrini*
|
||||||||||||||||||||||||||
|
RESUMEN Para conocer la presencia de la criptosporidiosis aviar en granjas comerciales de pollos de engorde de la Región Central de Venezuela, se realizó un estudio en el Laboratorio de Parasitología del Instituto de Investigaciones Veterinarias (FONAIAP), en Maracay, estado Aragua. Se procesó un total de 485 muestras de tractos gastrointestinales de pollos en edades comprendidas de 2 a 6 V2 semanas, utilizándose la coloración Kinyoun como medio de diagnóstico y, como apoyo, estudios histopatológicos y exámenes macroscópicos en los órganos involucrados para detectar la severidad de las lesiones. El hallazgo fue positivo a la presencia del protozoo Cryptospordium baileyi, agente causal de la criptosporidiosis aviar en 216 muestras. Esta parasitosis se asocia a cuadros de morbilidad y mortalidad, presentándose problemas respiratorios y diarréicos y otros, y consecuentemente aves con bajo peso corporal al momento de ser llevadas a matadero. Palabras Claves: Cryptosporidium baileyi; protozoo; pollos de engorde. INTRODUCCIÓN El Cryptosporidium baileyi (Levine,1985b) es un protozoo (2-6 um), familia Cryptosporidiidae, que crece y se reproduce en la superficie de las células epiteliales que cubren los tractos gastrointestinal (Current et al..,1986) y respiratorio (Dhillon et al., 1981). En 1929, Tyzzer, citado por Currentel et al.. (1983) señala por vez primera la existencia de criptosporidiosis en el ciego de pollos de engorde, pero es ahora cuando otros investigadores han comenzado a determinar la importancia de su presencia. Diversos estudios revelan su existencia en granjas del país, entre ellos el estudio de Soto Bracho (1994), en el estado Zulia, quien reseña infecciones con C. baileyi en pollos de engorde y ponedoras; en Aragua se conocen los trabajos de Silva et al.. (1990), y el de Surumay et al. (1994, 1996), señalándose en estos últimos una prevalencia hasta de 25%. Adicionalmente se han señalado otros casos de criptosporidiosis con implicaciones en salud pública (Chacín-Bonilla, 1995; CDC, 1984). Debido a la importancia ya la poca información que se tiene en Venezuela acerca de esta parasitosis, el objetivo de este estudio fue conocer la prevalencia del Cryptosporidium en granjas comerciales de pollos de engorde de la Región Central, diagnosticados en el Laboratorio de Parasitología del Instituto de Investigaciones Veterinarias (IIV) durante los años 1994, 1996 y 1997. MATERIALES Y MÉTODOS Se efectuaron muestreos en granjas comerciales de pollos de engorde ubicadas en la Región Central, específicamente en los estados Aragua, Carabobo y Miranda, donde se encuentran importantes zonas productoras de pollos. En el Laboratorio de Parasitología del IIV fueron procesados 485 tractos gastrointestinales provenientes de aves con edades entre 2 y 6 1/2 semanas. Primeramente se hicieron exámenes macroscópicos de todos los órganos involucrados para detectar la presencia de lesiones; seguidamente frotis directo de los intestinos y ciegos para la detección de huevos, oocistos, y otros; a fin de diagnosticar otras parasitosis. También se efectuaron frotis de heces y por aposición de los órganos relacionados (intestinos, ciegos, cloaca, bursa). Los frotis fueron coloreados con la técnica de Kinyoun (Vestal, 1975), específica para la detección de oocistos de Cryptosporidium spp. Parte de los órganos estudiados se fijaron en una solución de formol neutro a1 10% (100 cc Formaldehido al 37% + 900 cc agua destilada + 4 g de Fosfato monobásico de sodio + 6,5 g Fosfato dibásico de sodio) para realizarles los estudios histopatológicos con la coloración especial de Giemsa, lo cual constituye una de las técnicas más rápida y segura para este diagnóstico (Soto Bracho, 1994). RESULTADOS Y DISCUSIÓN Del total de muestras analizadas 216 (44,5%) resultaron positivas a C. baileyi (Cuadro 1), siendo el intestino delgado, la cloaca y la bursa de Fabricio los órganos más afectados, ocupando el mayor porcentaje la bursa con un 85,9%, resultados que superan a los de Goodwin y Brown (1989).
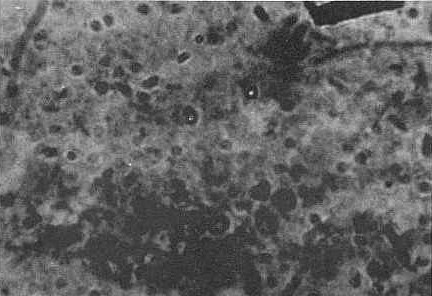
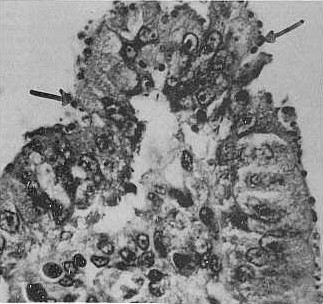
Como resultado de la coloración de los frotis con la técnica de Kinyoun (Vestal, 1975) se apreciaron al microscopio oocistos de color rosa, con unas inclusiones citoplasmáticas negruzcas (Figura 1). Los casos positivos a C. baileyi se presentaron asociados a lesiones inmunosupresoras de los órganos linfoides siendo las más significativas la destrucción e inflamación de la mucosa, la cual se presentaba aguda, difusa y escasa, probablemente debido a enfermedades manifiestas en estos lotes de animales tales como enfermedad infecciosa de la bursa, enfermedad de Marek, Newcastle. Esto coincide con los resultados obtenidos en estudios efectuados en Estados Unidos, realizados por Gorham et al.. 1987. Macroscópicamente se observó la mucosa del intestino delgado ligeramente congestionada, pálida y con numerosas áreas petequiales; la bursa de Fabricio aumentada de tamaño evidenciando infección de este órgano, similar a lo observado en trabajos realizados en Georgia, USA, por Goodwin y Brown (1988). Microscópicamente se apreció una degeneración mucinosa quística de los folículos, destrucción de las microvellosidades epiteliales, inflamación aguda de la mucosa e hiperplasia epitelial de la bolsa (Figura 2); similares observaciones fueron observadas por Soto Bracho (1994) en el estado Zulia, Venezuela.
Se encontró un incremento de la morbilidad y mortalidad de un 12% en el grupo de animales que resultaron positivos a Cryptosporidium, y que presentaron problemas respiratorios, diarrea y disturbios en la ganancia de peso, resultados que coinciden con lo observado en Venezuela por Colmenares y de La Rosa (1996). A pesar de la alta prevalencia de este protozoo en Venezuela ya nivel mundial, no se le había dado importancia a este parásito hasta años recientes (Current et al., 1983). En este sentido, se pensaba que su presencia era rara y ocasional, pero se ha evidenciado que las infecciones por Cryptosporidium son más bien comunes, especialmente en animales jovenes (Goodwin, 1989) y hasta 11 semanas de edad (Fayer y Ungar, 1986), aunque experimentalmente se han logrado infectar aves hasta de 6 meses (Angus,1983), no se ha señalado diferencias entre sexos y razas (Current et al., 1986). Histológicamente se informa una incidencia igual entre pollos y raza ponedoras (Fletcher et al., 1975). Al respecto, en Venezuela, Soto Bracho (1994) informó sobre varios casos de criptosporidiosis en pollos de engorde reproductoras y ponedoras en granjas del estado Zulia. El Cryptosporidium se considera como agente primario en problema: diarréicos y respiratorios, así como causa de poco desarrollo corporal y bajo peso en pollos al momento de ser llevados a matadero. AGRADECIMIENTOS A FUNDACITE -Aragua y Empresa SERAVIAN C.A., por haber hecho posible la realización de este trabajo. SUMMARY In order to detedt the presence of poultry criptosporidiosis in commercial broilers farms of the Central Region Venezuela, a study was conducted at the Parasitology Laboratory of the Veterinarian Research Institute (FONAIAP) in Maracay, Venezuela. A total of 485 samples of intestinal tracts were analyzed in two to six and half week's chickens. The diagnosis was performed through the Kinyoun coloration. Additionally, histopathologic analysis and macroscopic tests of the involved organs supported the study, determining the severity of the lesions. The collected data showed that 216 samples (44,5%) resulted positive to Cryptosporidium baileyi. The mentioned parasitic illness is associated to increased morbidity and mortalily due to respitatory and intesinal problems. As a consequence, the poultry have low body weight when they go to slaughterhouse. Key words: Cryptosporidium baileyi; protozoa; broilers. BIBLIOGRAFÍA ANGUS, K. W. 1983. Cryptosporidosis in man, domestic animals and birds: a review. J. R. Soc. Med. 76: 62-70. CENTER OF DISEASES CONTROL (CDC). 1996. Humans cryptosporidiosis morbid mortal weekly rep., Alabama, 31:252-254. COLMENARES M. y M. DE LA ROSA. 1996. Cryptospoidiosis intestinal en pollos de engorde. In: Memoria del VI congreso Nacional de Avicultura. Maracaibo -Edo. Zulia. pp. 509-511. CURRENT, W. L., N. C. REESE, J. V. ERNEST, W. S. BAILEY, M. D. HEYMAN and M. D. WEINSTEIN. 1983. Humans cryptosporidiosis in inmunocompetent and inmunodeficient persons: studies of an out break and experimental transmision. N England J Med 308: 1 252-l257. CURRENT , W. L., S. J. UPTON and T. B. HA YNES. 1986. The life cycle of Cryptosporidium baileyi (Apicomplexa Cryptosporidiidae) infecting chickens. Journal of Protozoology 33:289-296. CHACIN-BONILLA, L. 1995. Criptosporidiosis en humanos Revisión. Revista Investigación Clínica 36(4):207-250. 123 DHILLON, A. S., H. I. THACKER, A. V. DIETHEL and R. W. WINTERFIELDS. 1981. Respiratory cryptosporidiosis in broiler chickens. Avian Diseases 25:747-751. FAYER, R. and B. L. P. UNGAR.1986. Cryptosporidium spp. and cryptosporidiosis. Microbiological Reviews 50:458-483. FLETCHER, O..J., J. F. MUNELL and R. K. PAGE. 1975. Cryptosporidiosis of the bursa of Fabricius of chickens. Avian Diseases 19:630-639. GOODWIN, M. A. and J. BROWN. 1988. Histologic incidence and distribution of Cryptosporidium sp. infection in chickens-68 cases in 1986. Avian Diseases 32:365-369. GOODWIN, M. A., 1989. Cryptosporidiosis in birds -A review. Avian Pathology 18: 365-384. GOODWIN, M. A. and J. BROWN. 1989. Light-Microscopic lesions associated with naturally occurring bursa cryptosporidiosis in chickens. Avian Diseases 33:74- 78. GORHAM, S. L., E. T. MALLISON, D. B. SYNDER and E. M. ODOR. 1987. Cryptosporidia in the bursa of Fabricius broilers chickens. Avian : Pathology 16:205-211. LEVINE, N. D. 1985. Phylum II. Apicomplexa Levine 1970. In: Ilustrated Guide to the Protozoa, Edited by J. J. Lee, S. H. Hunter and E. C. Boves, Lawrence, Kansas: Society of Protozoology pp 322-374. SILVA, L., M. JARAMILLO y H. RUIZ.1990. Criptosporidiosis en la bolsa de Fabricio de pollos de engorde. Memorias de las 2das. Jornadas Nacionales de Actualización Avícola. SOVVEA. SOTO BRACHO, J. 1994. Criptosporidiosis, histomoniasis y trichomoniasis en aves del estado Zulia. Memoria del V Congreso Nacional de Avicultura. Mayo, Maracaibo. SURUMAY, Q., J. SOTO BRACHO e I. ESQUEDA. 1996. Cryptosporidium baileyi en la bolsa de Fabricio de pollos de engorde, región centro-costera de Venezuela. Veterinaria Trop. 21 (1):103-107. SURUMAY, Q. I. ESQUEDA. 1996. Cryptosporidium baileyi en pollos de engorde en la región central de Venezuela. Memoria del 3er. Congreso de Ciencias veterinarias "Eduardo Mendoza Goiticoa". pp 19. VESTAL, A. L. 1975. Procedures for the isolation and identificaction of mycobacteria. Center of Disease Control. Atlanta. Georgia. USA. |
||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||